计算机辅助分析冷冻前后褐牙鲆精子运动特征
2019-03-08黄晓荣冯广朋刘鉴毅章龙珍
黄晓荣,冯广朋,刘鉴毅,王 妤,张 涛,赵 峰,章龙珍,庄 平
(中国水产科学研究院东海水产研究所,农业部东海渔业资源开发利用重点实验室,上海 200090)
鱼类精子冷冻保存开始于20世纪50年代初期,有关鱼类精子的冷冻保存已有许多报道[1-4]。我国已建立了包括“四大家鱼”在内的淡水鱼类精子库[5-7],并建立了相关技术规程。在海水养殖鱼类方面,也开展了精子冷冻保存技术的探索[8-11]。精子运动性能是判断精液质量与受精能力的关键因素及进行人工受精的重要参数[12],在生产应用及生殖研究方面具有重要的意义。传统的分析方法是采用显微镜观察后进行评估分级,存在较大的主观性。CASA(computer-aided sperm analysis),即计算机辅助精子自动化分析,通过半自动或全自动的方法测得精子运动的速度、轨迹和距离等参数,能够真正实现对精子运动性能的客观评价[13]。运用CASA技术已开展了几种鱼类和无脊椎动物精子的运动性能研究[13-16],也在人类精液冷冻前后精子的变化研究上进行了应用[17],但用于检测冷冻前后鱼类精子运动性能变化的对比研究尚未见详细报道。
褐牙鲆(Paralichthysolivaceus)属鲽形目,牙鲆科,牙鲆属,俗称片口、比目鱼,是近海暖温性底层鱼类,具有生长快、个体大、肉质细嫩鲜美等特征,是名贵的重要海水养殖品种之一[18]。章龙珍等[19]已开展了褐牙鲆精子生理特性及超低温冷冻保存研究,建立了冷冻保存方法,但未对冷冻前后精子运动性能开展评估。本研究运用CASA技术开展冷冻前后褐牙鲆精子运动特征的变化研究,旨在为褐牙鲆精子超低温冷冻保存及精子质量检测提供技术支撑,为开展重要海水养殖鱼类人工繁育提供理论基础。
1 材料与方法
1.1 精子采集
2016年4月,挑选来源于浙江省海洋水产研究所繁殖用褐牙鲆雄性亲本10尾,亲本体长(38.25±1.24)cm、体质量(1.02±0.26)kg。将亲鱼从池中捞出后用纱布将鱼体表面的水擦干,轻挤压腹部,用滴管从生殖孔吸取无污染(无血、无水、无粪尿等)的精液放入密封袋内,充氧保存于4℃冰盒中带回实验室。光学显微镜(Olympus DP71)下观察精子活力,挑选活力90%以上的精子用于实验。采集部分精液,用蒸馏水稀释100倍后,用血球计数板计数,在光学显微镜(Olympus DP71)下观察统计,计算精液的密度。
1.2 精子活力观察
每隔一段时间从低温(4 ℃)和室温(25 ℃)下取出精子,用盐度31的砂滤海水激活,观察和记录精子活力和存活时间。精子活力以激活后视野中运动精子占所有精子的百分数表示,存活时间为精子从被激活到90%以上精子停止运动的时间。每个处理重复3次,结果取平均值。
1.3 精子超低温冷冻保存
在前期研究基础上,选取S3液(135 mmol·L-1NaCl+20 mmol·L-1NaHCO3+24 mmol·L-1KCl+1mmol·L-1CaCl2,pH=8)作为精子稀释液,16%的DMSO作为抗冻剂,形成精子冷冻保存液。精子冷冻保存液在实验前配制,存于冰箱(4 ℃)中备用。用0.2 mL的塑料离心管保存精子,按精液与抗冻保护液比1∶1迅速混匀,将装有混合液的离心管置于液氮面上-20 ℃处平衡1 min后迅速投入液氮中保存。冻精的解冻采用水浴(38 ℃)快速解冻法。解冻后,用砂滤海水(pH为8.0、盐度为31)激活精子,在显微镜下观察精子活力。
1.4 精子运动分析
在室温下,将5 μL稀释后的鲜精和冻精(1∶100)与45 μL砂滤海水在干净载玻片上充分混匀。在混匀后0.5 min、4 min和10 min,参照LINHART 等[20]的方法用CASA系统记录精子运动轨迹和速度等参数。即通过安装显微镜(BX51, 200×)上并与计算机联接的高敏感的数码摄像机(CCD,DP71)进行记录,每次曝光时间为20 ms,连续自动曝光30次。精子运动的轨迹用配套的自动分析软件(Image-Pro Plus 5.1)进行分析。目标精子头部的运动轨迹呈现在计算机的显示屏上,并以平面图形记录于软件中。所有数据以Excel文件输出、处理,并计算出精子运动的百分数、速度和距离。对于每个样本,分析50~100个精子。
参考LINHART 等[20]的方法,将褐牙鲆精子运动分为4种运动类型:运动速度大于70 μm·s-1接近直线方式前进的为直线运动;速度在30~70 μm·s-1之间呈曲线形运动的为曲线运动;速度在5~30 μm·s-1之间不规则运动的为左右摆动运动;运动速度小于5 μm·s-1的视为不运动。实验中所涉及的参数为:
MOT:样品精液中运动精子占精子总数的百分率(%);
VCL:精子头部实际行走的轨迹路径速度(μm·s-1);
VSL:精子头部呈直线移位的前向运动速度(μm·s-1);
VAP:精子沿轨迹曲线行走的平均速度(μm·s-1);
LIN:精子实际运动路线的曲折程度(%),LIN=VSL/VCL×100。
1.5 统计分析
每个实验重复3次,数据采用平均值±标准差表示(Mean±SD),所得数据用Statistica中单因子方差分析(ANOVA)进行分析。
2 结果与分析
2.1 保存温度对精子活力和寿命的影响
由图1可见,低温下在0~3 d内精子活力变化趋于平稳,但从4 d开始精子活力快速下降,在6 d时,精子活力降至10%左右,7 d时精子无活力。在室温下,精子活力也随时间的延长而逐渐降低,但活力下降速度明显比低温下快,4 d时精子无活力。
在室温与低温状态下,精子寿命均随着保存时间的延长逐渐缩短(图2)。室温下精子的寿命为4 d,低温下精子的寿命为7 d,与不同温度下精子的活力变化规律一致。

图1 不同保存温度下褐牙鲆精子活力与时间的关系Fig.1 Relationships between motility andstoring time of sperm of P. olivaceusunder different temperatures

图2 不同保存温度下褐牙鲆精子寿命与时间的关系Fig. 2 Relationship of longevity and storing time of sperm of P. olivaceus under different temperature
2.2 超低温冷冻前后褐牙鲆精子运动参数的比较
褐牙鲆鲜精中精子的密度为(1.02±0.08)×1010个·mL-1。鲜精用沙滤海水激活后0.5 min、4 min和10 min,精子的活性分别为(87.74±5.47)%、(71.58±6.19)%和(50.88±11.23)%;冻精用海水激活后0.5 min、4 min和10 min,精子活性分别为(84.00±3.67)%、(59.37±5.21)%、(39.27±8.97)%。鲜精和冻精被激活后,随着运动时间的延长,精子的运动状态逐渐发生变化。表1列出了激活后不同时间内鲜精和冻精各运动参数的变化。在3种激活时间下,除激活0.5 min时鲜精与冻精的运动百分率(MOT)间无显著差异外(P>0.05),其它2种激活时间下,鲜精与冻精运动百分比间都有显著性差异(P<0.05);在3种激活时间下,鲜精与冻精的平均曲线运动速度(VCL)、平均直线运动速度(VSL)、平均路径运动速度(VAP)和精子运动路线的曲折程度(LIN)间都有显著性差异(P<0.05)。
2.3 褐牙鲆鲜精与冻精运动状态的变化
图3和图4分别显示了鲜精和冻精激活0.5 min、4 min和10 min后,不同运动状态精子的数目变化。鲜精在激活0.5 min时,呈直线运动的精子数占(24.49±3.87)%,呈曲线运动的精子数占(48.53±4.55)%,呈左右摆动型运动的精子数占(24.72±2.86)%,不运动的精子所占比例为(2.27±1.22)%。当激活的时间延续到4 min和10 min时,向前直线运动的精子数分别下降到(9.82±2.15)%和(2.16±0.98)% ,而不运动的精子数则分别上升到(5.57±1.46)% 和(9.02±2.38)%。
冻精在激活0.5 min时,呈直线运动的精子数占(18.58±1.33)%,呈曲线运动的精子数占(35.67±3.00)%,呈左右摆动型运动的精子数占(35.24±2.67)%,不运动精子所占比例为(10.51±1.33)%。当激活后的时间延续到4 min和10 min时,向前直线运动的精子数分别下降到(2.57±1.45)%和(0.41±0.03)% ,而不运动的精子数则分别上升到(14.43±2.86)%和(19.69±2.74)%。

表1 褐牙鲆鲜精与冻精运动参数比较(Mean±SD,n=5)Tab.1 Comparison of parameter between fresh sperm and post-thawed sperm of P. olivaceus
注:相同激活时间下同列中不同字母表示差异显著(P<0.05)
Note: Different letters in the same column at the same activation time mean significant differences (P<0.05)
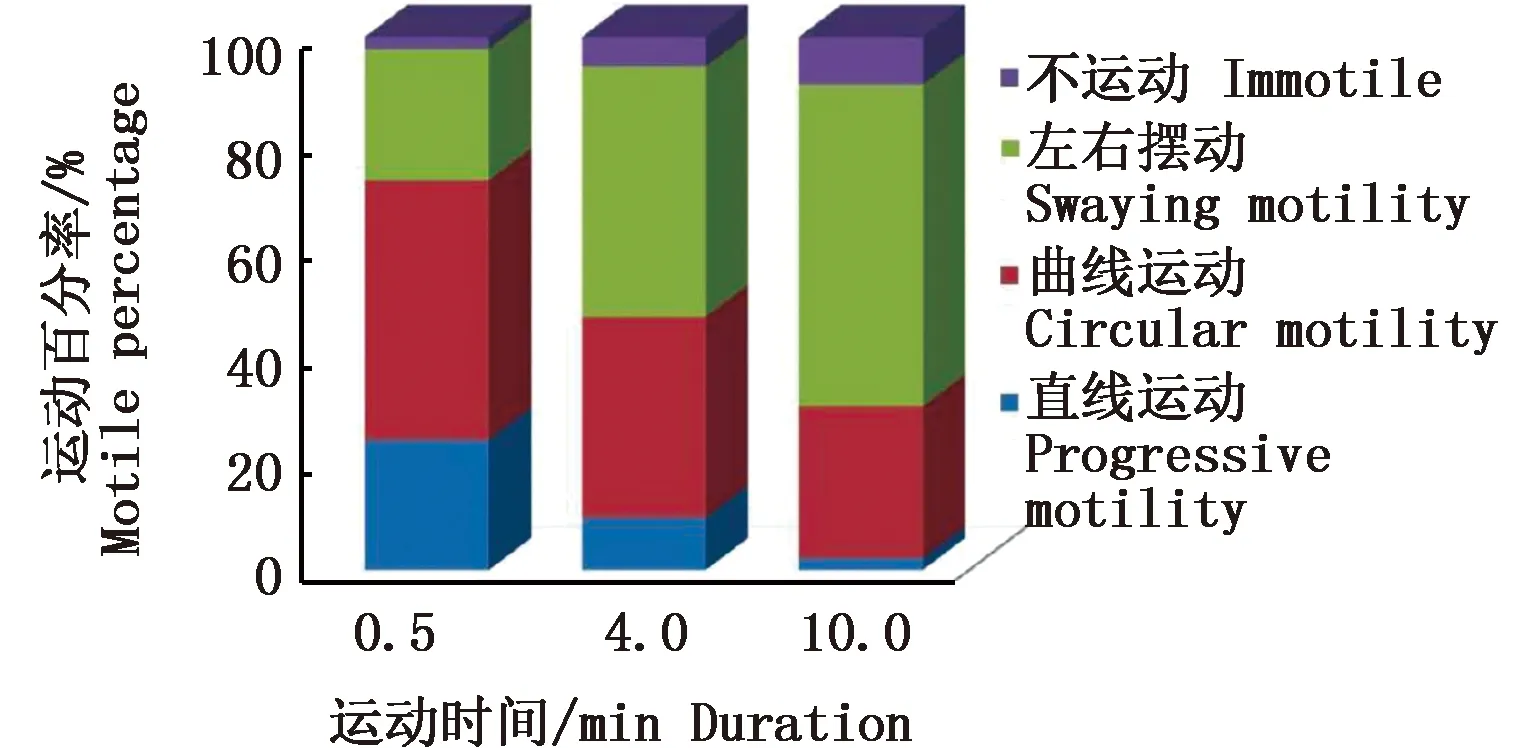
图3 褐牙鲆鲜精激活0.5、4、10min后不同运动形式精子的百分率变化Fig.3 Percentages of fresh sperm of P. olivaceus0.5 min, 4 min and 10 min after activation

图4 褐牙鲆冻精激活0.5、4、10min后不同运动形式精子的百分率变化Fig.4 Percentages of frozen sperm of P. olivaceus0.5 min, 4 min and 10 min after activation
需要说明的是,精子运动轨迹的变化是一个连续的动态的过程,没有绝对的界限(图5)。几种运动方式的划分也是人为分类的。一个激活后0.5 min向前直线运动的精子,延续到4 min或10 min后可能变成曲线运动、左右摆动或不运动。事实上,为了更好地分析鲜精和冻精的运动状态,常把精子运动轨迹和运动速度结合起来,综合判断精子的运动情况。一般地,精子运动速度越快,其运动轨迹越直;运动速度越慢,其运动轨迹越弯曲(图6,图7)。

图5 褐牙鲆鲜精激活0.5min时精子运动轨迹Fig.5 Trajectory of fresh sperm ofP. olivaceus 0.5 min after activation

图6 直线运动褐牙鲆精子运动速度与轨迹Fig.6 Velocity and trajectory of linear motion sperms of P. olivaceus

图7 摆动运动褐牙鲆精子运动速度与轨迹Fig.7 Velocity and trajectory of swing sperms of P. olivaceus
3 讨论
在鱼类的繁殖中精子的质量至关重要。除了精子本身的成熟度外,精子的活力是决定精子受精能力的主要因素,也是判断精子质量的重要指标之一[21]。鱼类精子在精浆和等渗液中是不动的,但精子离体后由于营养消耗、代谢产物积累、环境不适等原因会很快死亡。温度对精子的作用主要通过低温使精子消耗的ATP减少而延长精子运动时间[22],褐牙鲆精子的短期保存研究也表明,与常温相比,低温下精子能保存更长的时间,在4℃下褐牙鲆精子可以保存7d,这也证实了低温能延长精子的寿命。在开展精子的超低温冷冻保存研究中,为了提高精子冷冻保存的成活率,必须根据精浆的成分和渗透压配制冷冻保存液[23]。在前期研究基础上,筛选出了S3稀释液和16%的DMSO作为冷冻保护液,经过冷冻保存后,褐牙鲆冻精的最好活力为(84.00±3.67)%,与鲜精无显著差异,这一结果表明筛选出的冷冻保护液较为适宜。
计算机辅助精子活力分析系统(CASA)是在包含显微摄影、显微图像分析和荧光显微技术等多项技术和设备的基础上发展起来的新技术[24],此项技术最初是应用在男性生殖学研究中,此后随着技术的发展和完善逐渐被运用于其它哺乳动物精子活力检测中[25-27]。COSSON 等[28]首次使用频闪观测仪和录像的方法对鲑鱼的精子运动进行了描述。随着这项技术的成熟,近年来,CASA技术已在鱼类和无脊椎动物精子活力检测上进行了广泛应用[15, 28-29]。本文采用CASA技术对冷冻前后褐牙鲆精子运动性能进行了检测,结果发现鲜精和冻精随激活时间的延长活力均逐渐下降,除了在激活最初的0.5min鲜精与冻精活力间无显著差异外,其它激活时间两者间均有显著差异。此外,随激活时间的延长,鲜精与冻精的VCL、VSL、VAP和LIN都呈逐渐下降的趋势,在不同的激活时间下两者间都有显著性差异,表明激活时间的长短对褐牙鲆精子运动性能有显著影响,在开展褐牙鲆人工繁殖及授精实验中精子激活时间最好集中在30s以内。
与其它鱼类精子和无脊椎动物精子相比,褐牙鲆精子运动也可以分为向前直线运动、弧形直线运动、左右摆动和不运动4种类型[12]。褐牙鲆鲜精在激活0.5min的平均运动速度为(55.94±13.88)μm·s-1,低于虹鳟(Oncorhynchusmykiss)精子平均运动速度77 μm·s-1[28],略高于青岛文昌鱼(Branchiostomabelcheritsingtauens)精子平均运动速度(46.00±32.60)μm·s-1[15]。褐牙鲆鲜精和冻精被激活后随时间的延长,精子的运动方式发生了明显改变,向前直线运动的精子逐渐变为弧形曲线运动,原本曲线运动的精子则变为左右摆动,而左右摆动的精子变成不运动,这种运动方式的改变可能与细胞内贮存的能量被逐渐耗尽有关[30]。
在对黄鳍石鮰(Noturusflavipinnis)、鲤(Cyprinuscarpio)、舌齿鲈(Dicentrarchuslabrax)和湖鲟(Acipenserfulvescens)精子的研究中发现,最重要的参数是精子的VCL和VSL[14,28,32],本文对褐牙鲆精子的研究也表明,随着激活时间的延长,褐牙鲆鲜精和冻精的VCL和VSL都发生了较大变化。另一个与精子运动速度有关的参数是精子的VAP,有学者认为它在鱼类精子参数分析中不重要,因为鱼类精子总是在一个方向上做平滑的曲线运动。因此,认为鱼类的VAP和VCL基本相同[31-33];但另有学者则认为VAP和VCL同样重要。在对花狼鱼(Anarhfminor)和棘鱼(Acanthodiiaculeatus)精子的研究中发现,由于这两种鱼精子要在胶体渗透压很高的激活液中运动,激活液所产生的阻力迫使精子的运动轨迹呈飘逸状,因此,VAP和VCL产生了很大的差异[34-35]。柳凌等[30]对4种鲟鱼精子的研究也发现VAP和VCL有很大差异,分析认为鱼类精子的VAP和VCL是否有差异主要取决于精子的体积和形状、精子运动速度、精子运动方式以及精子在激活液中所受到的阻力,精子在运动过程中所受的阻力很大,则迫使精子做不规则的飘逸运动。对人类精液冷冻前后的CASA分析表明,超低温冷冻后,反映精子运动速度的参数如VAP、VSL、VCL都有不同程度的下降[17]。本研究中,褐牙鲆鲜精和冻精在相同的激活时间下,VAP和VSL相差不大,这可能是因为褐牙鲆精子的体积小,精浆渗透压低,对精子运动的阻力小。此外,由于褐牙鲆精子的密度较高,激活后的精子相互间容易发生碰撞(从激活0.5 min时鲜精和冻精MOT差异不显著可以看出),不容易形成长的平滑的运动曲线,因而造成VAP和VCL差异不显著。
