基于RAPD的白色金针菇菌株遗传多样性分析
2019-03-08杨和川谭一罗苏文英秦裕营浦汉春周振玲
杨和川,谭一罗,苏文英,秦裕营,马 腾,浦汉春,周振玲
(连云港市农业科学院,江苏 连云港 222000)
金针菇(Flammulinavelutipes)又名毛柄金钱菌、构菌、朴菇、冬菇等,在自然界中分布广泛,是我国最早开始人工栽培的食用菌之一,具有广阔的市场前景[1]。金针菇鲜菇的颜色是其销售的重要分级指标之一,早期生产企业多采用黄色金针菇菌种,但由于黄色金针菇菌株在栽培中易发生褐变等问题,严重影响了金针菇的品质、销售及加工。因此,近年来金针菇工厂化生产企业均以白色金针菇的生产为主[2-3]。由于金针菇可以通过无性繁殖进行菌种生产,且菌种分离难度低,因此市场上金针菇菌种自行编号或命名现象普遍,菌种生产、销售混乱,极易出现同种异名、异种同名的情况,既给金针菇生产中菌种管理带来了困难,又影响了育种者的权益,同时,劣质菌种流入生产还会造成巨大的经济损失。因此,研究目前市场上白色金针菇种质资源的遗传多样性,对金针菇的种性鉴定、遗传育种等基础科研和产业体系建立等具有重要意义。
传统的菌株鉴别方法,如子实体形态特征和拮抗试验等易受外界环境的影响,同一菌株在不同栽培条件下表现出较大的差异,不能鉴别出亲缘关系较近的菌株[4-6]。近年来,DNA指纹技术被广泛应用于真菌的系统学研究及其分类鉴定,随机扩增多态性DNA(randomly amplified polymorphic DNA,RAPD)、扩增片段长度多态性(Amplified Fragment Length Polymorphism,AFLP)、简单重复序列(Simple Sequence Repeats,SSR)、简单重复序列区间(Inter-Simple Sequence Repeats,ISSR)、特征性片段扩增区域(Sequence Characterized Amplified Region,SCAR)等技术[7-11]在食用菌种质资源的评价、菌株鉴别、遗传多样性的研究中取得了显著成效。其中,RAPD分子标记技术具有操作简便、对基因组DNA浓度和试剂要求低、成本低廉的优点。为了避免在实际生产中品种混乱,降低栽培风险,本研究对15种白色金针菇菌株进行了RAPD分子标记分析,以期为金针菇的种性研究、良种选育及种质资源管理提供参考和依据。
1 材料与方法
1.1 供试菌株
15株白色金针菇菌株的编号和来源如表1所示。
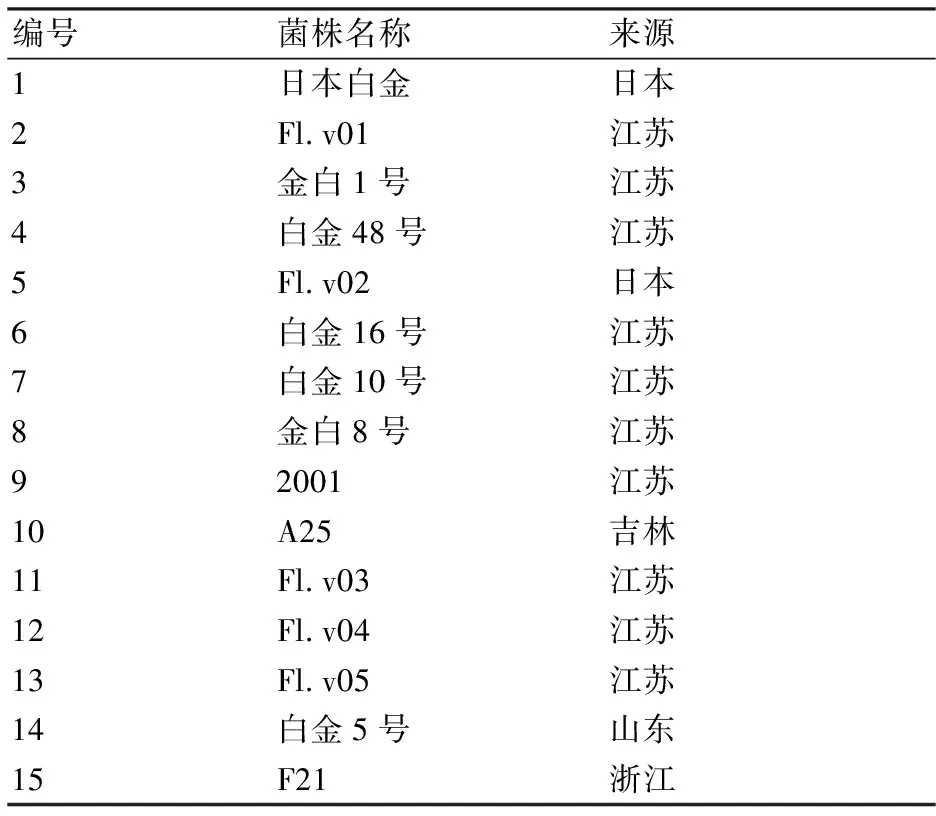
表1 供试菌株编号及来源
1.2 试剂和仪器
DreamTaq PCR Master Mix(2×)购自赛默飞世尔科技公司,DNA提取试剂盒购自康为世纪生物科技有限公司,DNA marker、引物序列购自北京鼎国昌盛生物技术有限责任公司,其余试剂购自北京奥博星生物技术有限责任公司。PCR仪为德国艾本德股份公司产品,电泳仪、电泳槽为伯乐生命医学产品(上海)有限公司产品。
1.3 培养基
MYG固体培养基:葡萄糖5 g、酵母浸粉5 g、麦芽糖10 g、琼脂糖15 g、水1000 mL、自然pH值。该培养基用于金针菇菌丝培养。
1.4 试验方法
1.4.1 总DNA的提取 将供试菌株分别接种于MYG固体培养基平皿,25 ℃恒温培养10 d,刮取平皿上菌株气生菌丝体于1.5 mL离心管中,放入液氮研磨成粉末,采用DNA提取试剂盒提取金针菇的基因组DNA,提取的DNA于-20 ℃下保存备用。
1.4.2 RAPD-PCR的扩增 采用的20条RAPD引物序列见表2。PCR反应体系20 μL,包含模板DNA 1 μL、引物1μL、DreamTaq PCR Master Mix(2×)10 μL、ddH2O 8 μL。PCR反应程序:92 ℃预变性5 min;92 ℃变性1 min;35 ℃退火1 min;72 ℃延伸2 min,循环40次,72 ℃延伸10 min,扩增产物于-20 ℃下保存。从20条RAPD引物中筛选谱带清晰、多态性丰富的引物,采用1%琼脂糖凝胶电泳,拍照记录电泳结果。
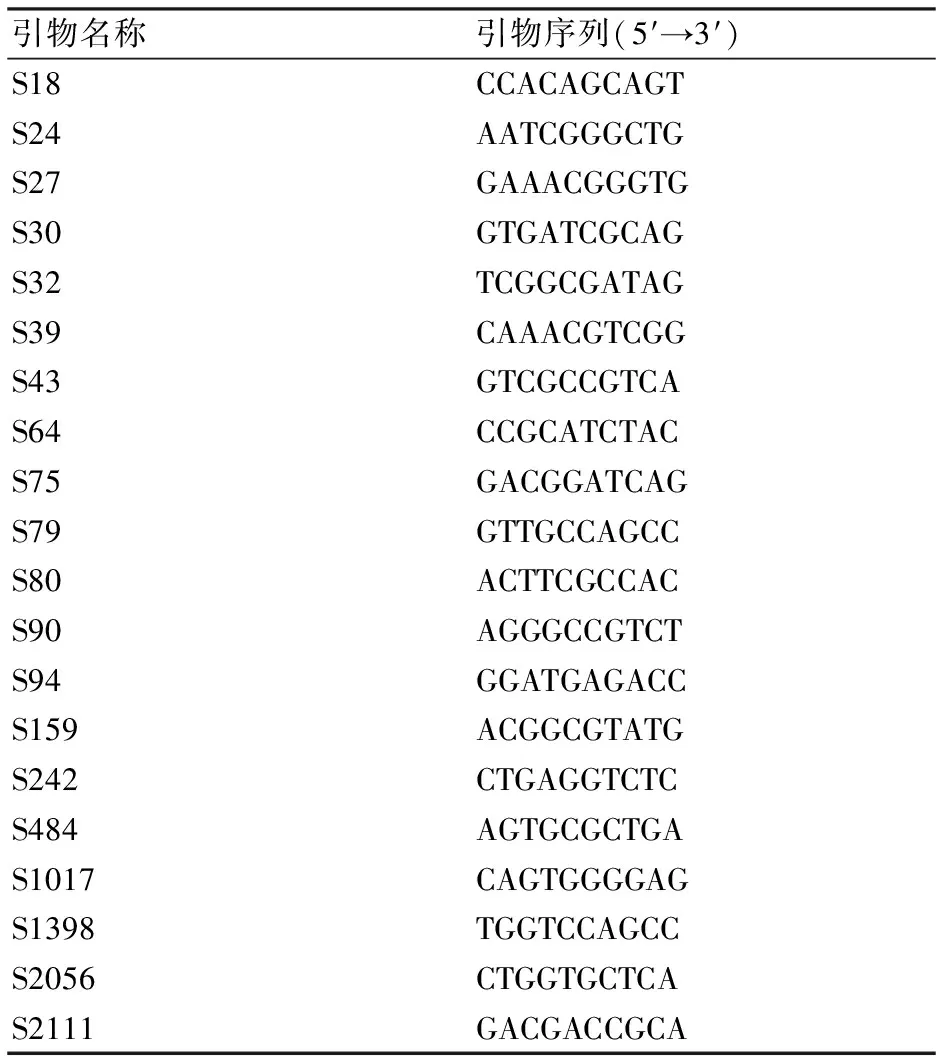
表2 RAPD扩增使用的引物
1.4.3 数据处理 对电泳图谱进行条带统计,相同位移上有条带记为“1”,无条带记为“0”,转换为0/1矩阵。利用NTSYSpc 2.11软件对0/1矩阵数据进行分析,通过非加权配对算数平均法(Unweighted Pair-group Method with Arithmetic means,UPGMA)进行聚类分析,并基于原始0/1矩阵进行主成分分析(Principal Component Analysis,PCA)。
2 结果与分析
2.1 RAPD-PCR扩增
从20条RAPD引物中筛选出8条谱带清晰、多态性丰富的引物,分别为引物S43、S75、S79、S80、S90、S484、S1398、S2111。使用这8条引物对15株白色金针菇菌株进行多态性分析(图1),共计扩增出45条片段,其中多态性片段33条,多态性比率为73.3%,说明RAPD分子标记有较好的多态性。

1~15为供试菌株编号,与表1中品种编号一致;M为DL2000 Marker。下同。
2.2 供试菌株遗传相似性分析
通过NTSYSpc 2.11软件对15株白色金针菇菌株间遗传相似系数进行了计算,结果表明:供试菌株的遗传相似系数在0.560~0.984之间,2号菌株与15号菌株的遗传相似系数最小,12号菌株与13号菌株的遗传相似系数最大,说明2号菌株与15号菌株的亲缘关系较远,12号菌株与13号菌株的亲缘关系较近(表3)。

表3 基于RAPD的供试菌株的遗传相似系数矩阵
注:1~15为供试菌株编号,与表1中品种编号一致。下同。
2.3 供试菌株UPGMA聚类分析
采用UPGMA法进一步聚类进行分析,构建遗传亲缘系数树状图(图2)。当遗传相似系数在0.68时,15株供试菌株被聚为1类;在0.830水平上被聚为4类,其中,类群Ⅰ包含1号和2号菌株;类群Ⅱ包含4、5、10、12、13、11号菌株;类群Ⅲ包含3、8、9号菌株;类群Ⅳ包含6、7、14、15号菌株。
2.4 供试菌株的主成分分析
对15株供试金针菇种质的原始矩阵进行主成分分析,第1主坐标和第2主坐标的方差贡献率分别为45.31%和15.40%,以第1、第2主坐标的二维图排序绘制主成分分析二维聚类图(图3)。可以看出,二维聚类图将15个白色金针菇菌株分为4类,比较图2和图3,主成分分析结果与遗传相似系数0.830水平上聚类分析结果相似,聚类图中部分菌株间的遗传多样性较高,因此对应在主成分分析图中的分布相对分散。
3 讨论
利用菌株的拮抗反应和农艺性状比较是鉴别食用菌菌株的常见办法。但是,一方面,遗传背景相似或亲缘关系很近的菌株则难以区分,且拮抗试验不具有传递性;另一方面,金针菇子实体农艺性状受环境因素的影响大,栽培流程复杂、耗时耗工,因此采用分子生物学技术研究金针菇菌株间的亲缘关系成为一种重要方法。其中,RAPD技术不需要供试菌株的基因组序列信息,而是采用随机引物,因此,该方法具有流程简单、成本低廉的优势。
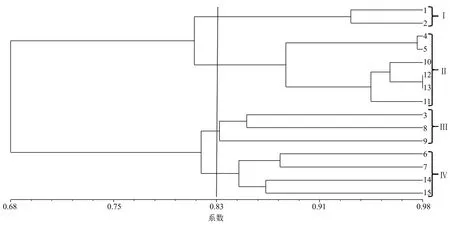
图2 15株供试菌株的RAPD分子标记聚类图

图3 供试菌株二维主成分分析图
基于RAPD技术对供试菌株进行遗传多样性的分析,试验结果能明显反映供试菌株间的遗传差异和亲缘关系。15株白色金针菇菌株根据子实体颜色又可以分为乳白色和白色2类,聚类分析结果虽然可将供试菌株分为4类,但是无法将白色和乳白色菌株子实体按颜色区分,乳白色金针菇菌株可能来源于不同颜色菌株的杂交。对照UPGMA聚类图和主成分分析图,在主成分分析图中类群Ⅰ和类群Ⅱ能明显划分,且类群内的菌株分布较近,说明类群内菌株的亲缘关系较近,2个类群间的亲缘关系较远;而类群Ⅲ、类群Ⅳ内菌株间分布较分散,说明类群内菌株彼此亲缘关系相对较远,与UPGMA聚类结果一致。本研究结果表明:RAPD分子标记是研究金针菇菌株遗传多样性的一个有效方法,菌株DNA指纹图谱的建立对知识产权保护具有重要意义。但是,单一分子标记技术在计算遗传相似系数时存在偏差,因此同时结合其他分子标记技术综合分析金针菇菌株的遗传多样性,开发SCAR和SSR等能特异鉴别金针菇菌株的分子标记,对金针菇菌株的准确鉴定、保护知识产权、育种亲本选择、提高育种效率均具有重要意义。
