胰岛素对胞内不同水平环二鸟苷酸铜绿假单胞菌运动能力的影响
2019-03-08丁雨迪韦球张真强王可
丁雨迪 韦球 张真强 王可
糖尿病患者最常见的严重感染是糖尿病足合并感染[1],而铜绿假单胞菌(Pseudomonas aeruginosa,PA)是在糖尿病足表面感染的组织中培养出的最常见的革兰氏阴性菌[2]。糖尿病及相关感染性疾病已经成为一项棘手的、重要的公共卫生问题。PA 所致的感染性疾病具有持续时间长、难治性、反复性的特点,这一特点与其泳动、群集、蹭动运动能力有关[3]。运动能力下降的细菌对抗生素和宿主免疫系统具有很强的抵抗力,从而导致严重的临床问题,引起许多慢性和难治性感染疾病的反复发作。环二鸟苷酸(c-di-GMP)在PA 运动能力的调控中起关键作用。
中国2 型糖尿病诊治指南(2017年版)指出:糖尿病合并感染如肺部感染、皮肤感染、足部溃疡以及合并囊性纤维化的患者均推荐胰岛素控制血 糖[4]。胰岛素对胞内c-di-GMP 不同表达量PA 运动能力影响的机制尚未阐明,本研究观察胰岛素对不同c-di-GMP 表达的PA 菌株的泳动、群集、蹭动能力的影响,并分析其影响是否与胰岛素浓度存在剂量依赖性。
1 材料与方法
1.1 菌株及试剂 本实验所需野生对照株PAO1、c-di-GMP 低表达株PAO1/Plac-yhjH、c-di-GMP 过表达株PAO1/ΔwspF 由新加坡南洋理工大学生命科学学院惠赠。中效胰岛素:精蛋白锌重组人胰岛素注射液(优泌林N 中效型3ml:300 单位笔芯/礼来苏州制药有限公司),热变性优泌林N;ABTGC 培养液(基),主要成分:硫胺素注射液(国产)、硫酸铵、磷酸氢二钠、磷酸二氢钾、氯化钠、氯化镁、氯化钙、三氯化铁、琼脂粉、葡萄糖,均为国产分析纯;四环素粉(批号:T04422-10G)、酪蛋白氨基酸,LB 培养基、LB 肉汤。
1.2 检测泳动能力 将三种菌株复苏后,接种到装有3ml LB 培养液的12ml 培养管中,置于37℃恒温箱,转速250r/min,连续过夜培养16h;次日清晨,离心,4℃,3 000r/min,15min,沉淀物用ABTGC 培养液洗涤2 次,用ABTGC 培养液将菌悬液浓度调到光密度值OD600=0.1(~108CFU/ml),再用ABTGC 培养液10 倍系列稀释100 倍(以下同)。取菌液2μl针刺接种于不同浓度胰岛素的琼脂含量为0.3%的ABTGC 培养基表面的中央,置于37℃恒温箱中静止培养24h,用尺子测量细菌在不同方向上的泳动运动菌落的直径。
1.3 检测群集能力 取菌液2μl 针刺接种于不同浓度胰岛素的琼脂含量为0.5%的ABTGC 培养基中央的里面,置于37℃恒温箱中静止培养24h,用尺子测量细菌在不同方向上群集运动菌落的直径。
1.4 检测蹭动能力 取菌液2μl 针刺接种于不同浓度胰岛素的琼脂含量为1%的ABTGC 培养基中央表面穿透到达底部,置于37℃恒温箱静止培养24h,去除琼脂培养基,室温干燥,用0.1%结晶紫溶液2ml,对培养皿底部进行染色20min,倒掉染液,取灭菌生理盐水洗培养皿2min,室温干燥,尺子测量培养皿底部着色范围的直径大小。
1.5 统计学分析 采用SPSS 18.0 软件包分析,每组至少复盘3 次,重复3 次,取平均值,以±s±s 表示,组间均数符合正态分布者比较采用ANOVA 分析,组间比较采用LSD 检验,k-1 组与对照组比较采用Dunnett Text,不符合正态分布者采用秩和检验,P<0.05 为差异有统计学意义。
2 结果
2.1 c-di-GMP 抑制铜绿假单胞菌的泳动、群集、蹭动能力
2.1.1 泳动能力 PAO1、PAO1/Plac-yhjH、PAO1/ΔwspF三组菌株均以接种点为中心形成雾状同心圆样区域,PAO1/Plac-yhjH 泳动直径较对照PAO1 组稍大,差异具有统计学意义(P<0.05);而PAO1/ΔwspF 组泳动直径较对照PAO1 组显著变小,仅为对照组泳动直径的1/5,差异具有统计学意义(P<0.001)。与对照PAO1 组泳动能力相比,PAO1/Plac-yhjH 组泳动能力稍增强,而PAO1/ΔwspF 组则明显被抑制,见表1。实验结果表明c-di-GMP 可以抑制PA 的泳动能力。
2.1.2 群集能力 PAO1/Plac-yhjH 组菌落呈分支状,其区域直径大于对照PAO1 组,差异具有统计学意义(P<0.05); 而PAO1/ΔwspF 组周围光滑,无伪足样放射,且区域直径明显小于PAO1 组,差异具有统计学意义(P<0.01),见图1、表1。实验表明c-di-GMP 可抑制PA 的群集能力。
2.1.3 蹭动能力 PAO1、PAO1/Plac-yhjH、PAO1/ΔwspF三组菌株均以接种点为中心形成同心圆样区域,测量培养皿底部着色范围直径大小。PAO1/PlacyhjH 组菌落直径大于对照PAO1 组,表明PAO1/Plac-yhjH 组蹭动能力较对照PAO1 组强,差异具有统计学意义(P<0.05),而PAO1/ΔwspF 组同心圆区域直径小于对照PAO1 组,其蹭动直径仅为对照组的1/3,差异具有统计学意义(P<0.01),说明PAO1/ΔwspF 组菌落的蹭动能力明显被抑制,见表1。结果表明c-di-GMP 可抑制PA 的蹭动能力。

表1 c-di-GMP 表达不同的菌株运动能力比较
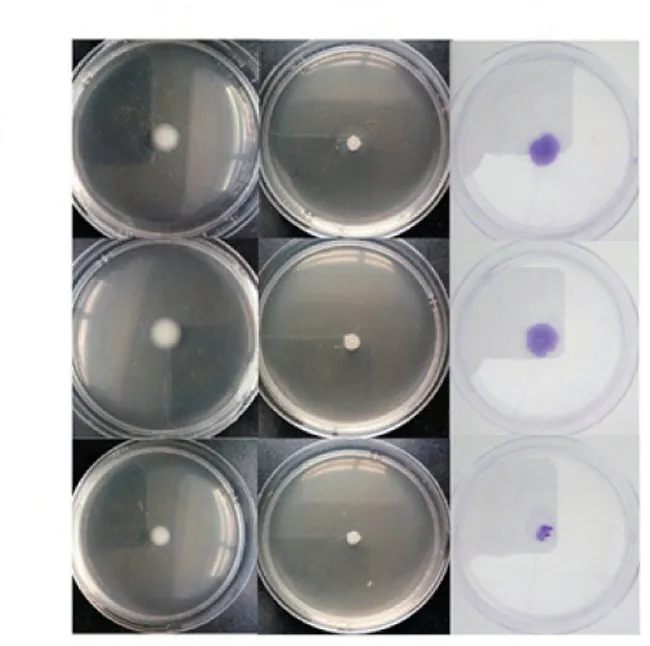
图1 c-di-GMP 表达不同的菌株运动能力比较
2.2 胰岛素抑制PA 野生菌株及胞内c-di-GMP 低表达菌株的泳动、群集、蹭动能力
2.2.1 胰岛素抑制PA 野生菌株及胞内c-di-GMP 低表达菌株的泳动能力 在野生PAO1、胞内c-di-GMP 低表达PAO1/Plac-yhjH 菌株中,与热变性胰岛素对照组相比,含有不同浓度胰岛素组的泳动直径明显变小,差异具有统计学意义(P<0.05),且在三个浓度之间菌株的泳动能力无统计学差异(P>0.05)。而在胞内c-di-GMP 过 表达PAO1/ΔwspF 菌株中,各组之间泳动直径大小变化不大,差异无统计学意义(P>0.05),见表2。表明胰岛素能抑制PA 野生菌株及细胞内c-di-GMP 低表达菌株的泳动能力,而对PA 细胞内c-di-GMP 过表达菌株的泳动能力无影响。
2.2.2 胰岛素抑制PA 野生菌株及细胞内c-di-GMP低表达菌株的群集能力 在野生PAO1、胞内c-di-GMP 低表达PAO1/Plac-yhjH 菌株中,与热变性胰岛素对照组相比,含有不同浓度胰岛素组的群集直径明显变小,差异具有统计学意义(P<0.05),且在三个浓度之间无统计学差异(P>0.05),见表2。在胞内c-di-GMP 过表达PAO1/ΔwspF 菌株中,各组之间群集直径大小变化不大,差异无统计学意义(P>0.05)。表明胰岛素能抑制PA 野生菌株及细胞内c-di-GMP 低表达菌株的群集能力,而对PA 细胞内c-di-GMP 过表达菌株的群集能力无影响。
2.2.3 胰岛素对PA 野生菌株、胞内c-di-GMP 低表达菌株、胞内c-di-GMP 过表达菌株的蹭动能力无影响 在野生PAO1、胞内c-di-GMP 低表达PAO1/Plac-yhjH、胞内c-di-GMP 过表达PAO1/ΔwspF 菌株中,胰岛素对照组及含有200mU/ml、200μU/ml、200nU/ml 组之间的蹭动直径大小变化不大,差异无统计学意义(P>0.05)。实验结果表明,胰岛素未能影响PA 野生菌株、胞内c-di-GMP 低表达菌株、胞内c-di-GMP 过表达菌株的群集能力。
表2 胰岛素对胞内c-di-GMP 不同表达量PA 泳动、群集、蹭动能力的影响(mm,±s)

表2 胰岛素对胞内c-di-GMP 不同表达量PA 泳动、群集、蹭动能力的影响(mm,±s)
注:与对照组比较,*P<0.05,**P<0.01,***P<0.001
菌株 胰岛素浓度 泳动运动 群集运动 蹭动运动PAO1 热变性胰岛素 13.25±1.90 5.29±0.28 10.96±0.39 200nU/ml 7.50±1.38** 4.25±0.22** 11.25±0.72 200μU/ml 6.43±2.43** 4.21±0.21** 10.79±0.88 200mU/ml 5.75±0.63*** 3.79±0.20** 11.00±1.26 PAO1/ 热变性胰岛素 14.42±2.67 6.96±0.79 11.83±0.90 Plac-yhjH 200nU/ml 9.21±1.72* 4.92±0.59* 10.50±0.81 200μU/ml 8.70±1.98* 4.79±0.85* 12.25±0.23 200mU/ml 6.29±0.64** 3.75±0.35** 11.71±0.23 PAO1/ 热变性胰岛素 2.13±0.27 2.42±0.16 3.57±0.30 ΔwspF 200nU/ml 2.38±0.38 2.46±0.24 3.67±0.49 200μU/ml 2.00±0.23 2.67±0.22 3.96±0.58 200mU/ml 2.04±0.17 2.63±0.27 3.44±0.36
3 讨论
PA 广泛分布在自然界中,各种水、土壤、空气、正常人的皮肤、呼吸道和消化道等均有该菌的存在。PA 是一种条件致病菌,是医院感染最常见的革兰氏阴性菌之一,它能适应各种环境并形成生物膜,而该生物膜的形成则使医院感染具有难治性和反复发作性的特点。细菌的黏附是形成生物膜引起感染的初始阶段,细菌黏附于医疗植入物,通过分泌胞外多糖等物质将其包绕其中形成具有三维结构的聚集体,即为生物膜,生物膜的形成使临床上的感染迁延不愈。因此,抑制细菌的黏附也是控制细菌生物膜感染的重要环节之一。PA 的黏附力与鞭毛、菌毛及其自身运动-泳动、群集和蹭动有着密切的关系。细菌群集不仅是一种运动形式,而且代表了其复杂的适应性,导致毒力基因表达和抗生素抗性的变化。
c-di-GMP 是细胞内第二信使,其控制许多细菌的生物膜生命周期。就PA 而言,胞内高c-di-GMP 含量通过降低运动性和生物膜基质的产生来增强生物膜形成,而胞内c-di-GMP 含量降低导致运动性增强和生物膜分散[5],因此,c-di-GMP 信号通路可以调控细菌的运动能力[6]。PA 的鞭毛和菌毛、群集和蹭动运动等被视为急性毒力表型,生物膜被视为慢性毒力表型;而这些毒力表型都受c-di-GMP 信号通路的调节[3,6]。糖尿病患者容易并发各种感染[1],而PA 是在糖尿病足表面感染的组织中培养出的最常见的革兰氏阴性菌[2]。2017 中国糖尿病足诊治指南指出糖尿病足的内科诊治中控制血糖首选胰岛素[7],而胰岛素对胞内c-di-GMP 不同表达的PA 运动能力的影响机制尚未阐明。
本研究发现在未使用胰岛素干预下,与对照株PAO1 相比,c-di-GMP 低表达株PAO1/Plac-yhjH的运动能力影响不明显,而c-di-GMP 过表达株 PAO1/ΔwspF 的泳动、群集、蹭动能力都明显被抑制。在本研究的预实验中,我们先将胰岛素进行变性,生理盐水为空白对照组,发现变性胰岛素组和空白组比较,对c-di-GMP 浓度不同的PA 运动能力的影响不显著。因此,之后进行实验时所用到的变性胰岛素均指直接变性后的胰岛素原液。胰岛素可抑制对照菌株PAO1 和c-di-GMP 低表达菌株PAO1/Plac-yhjH 泳动能力和群集能力,且其效应与胰岛素剂量无依赖性,但胰岛素对胞内c-di-GMP过表达菌株PAO1/ΔwspF 的泳动、群集能力均无影响。此外,胰岛素不影响PA 野生菌株、胞内c-di-GMP 低表达菌株、胞内c-di-GMP 过表达菌株的蹭动能力。
研究报道胞内过表达c-di-GMP 的PA 菌株能刺激表多糖产生,从而增加细菌表面粘附性,使菌株的运动能力下降;相反,胞内低表达c-di-GMP 的PA 菌株则可刺激细菌运动性[8]。本研究也验证了这一结论,在未使用胰岛素干预下,c-di-GMP 过表达株PAO1/ΔwspF 组运动能力明显被抑制,其机制可能是过表达的c-di-GMP 刺激表多糖产生,增加细菌细胞表面粘附性,致使菌株的运动能力下降。Watters 等[9]报道胰岛素加快PA 在体外的生物膜形成,从而显著延缓糖尿病患者伤口的愈合[10]。相反,也有研究报道低剂量胰岛素能改善宿主对铜绿假单胞菌感染的抵抗力[11]。本研究发现胰岛素可抑制野生菌株PAO1 以及细胞内c-di-GMP 低表达菌株PAO1/Plac-yhjH 的泳动运动、群集运动能力,且其效应与胰岛素剂量无依赖性,而胰岛素对c-di-GMP 过表达株 PAO1/ΔwspF 三种运动能力均无影响,考虑其原因可能是c-di-GMP 过表达对菌株运动能力的抑制效应明显大于胰岛素的抑制效应,相关机制有待于进一步探讨。
综上所述,胰岛素抑制野生株PAO1 和c-di-GMP 低表达株PAO1/Plac-yhjH 泳动能力和群集能力,且其效应与胰岛素剂量无依赖性,而对三种菌株的蹭动能力均无影响。本研究为进一步分析糖尿病鼠模型中生物膜形成提供理论依据。
