红树林植物来源内生真菌构巢曲霉MA143次级代谢产物的分离与结构鉴定
2019-03-06冷懿
冷 懿
(北京林业大学,北京100083)
天然产物在现代疾病治疗与防治中依然发挥着重要作用,一直是许多新药制剂或药物先导化合物的重要来源[1]。如今,一些治疗重大疾病,如癌症、感染性疾病、代谢紊乱、免疫缺陷的药物依然主要来源于天然产物或其类似物[1-2]。从天然产物的来源来看,微生物次生代谢产物是天然药物或先导化合物的重要来源。微生物能够产生结构复杂多样、活性广泛显著的次生代谢产物,如临床上使用的阿司匹林、环洛伐他汀、紫杉醇、吗啡等,成为人们进行新药研发的重要研究对象[3](如图1-2)。本文以红树林植物来源内生真菌构巢曲霉MA143为研究对象,对其ICI培养基发酵粗提物的化学成分进行初步研究,以期从红树林植物中分离得到具有显著生物活性的新化合物,用于如抗肿瘤、抗真菌等医药用途。
1 材料与方法
1.1 研究对象——构巢曲霉MA143
构巢曲霉(Aspergillus nidulans,也称为 Emericella nidulans,构巢裸胞壳)(如图3)通常为单倍体,但能诱导为异核体或二倍体,产生有性和无性孢子,而其他大部分曲霉是无性的。构巢曲霉是遗传学和生物化学研究得最广泛的微生物之一,已经成为真核生物细胞生物学上一个重要模式生物,可表达哺乳动物基因。构巢曲霉是工业和医学上使用较多的曲霉菌如黑曲霉(Aspergillus niger)、米曲霉(A.oryzae)、黄曲霉(A.flavus)和烟曲霉(A.fumigatus)等的近缘种。构巢曲霉基因组约31 Mb是目前NCBI上公开发表的47种真菌的基因组序列之一。研究构巢曲霉的次生代谢产物具有重要意义,这将有助于了解构巢曲霉的生物学特性,还能促进疫苗和药物的研制开发。

图1 天然产物是医药发展的重要动力Figure1 Natural products is the important driving force of the development of the medicine
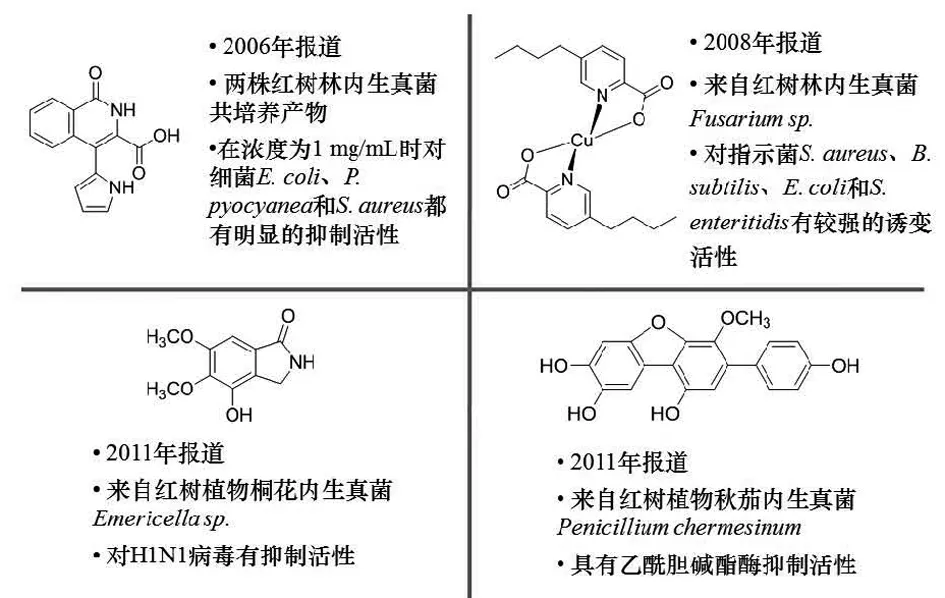
图2 红树林内生真菌活性代谢产物研究进展Figure2 Mangrove endophytic fungi active metabolites were reviewed

图3 构巢曲霉MA143Figure3 Structure aspergillus MA143 nest
1.2 ICI培养基配方

表1 ICI培养基配方Table1 ICI medium formula
1.3 培养方式
自然光照,静置发酵30天。
1.4 主要分离方法原理及操作[4-7]
1.4.1 硅胶柱层析
分离原理:根据硅胶对物质的吸附力不同而达到分离目的。正常情况下,极性大的物质容易被硅胶吸附,极性较小的物质不易被硅胶吸附,适用于分离极性小的化合物。
其主要操作步骤如下:
拌样:用最少量的低沸点合适有机溶剂(如二氯化碳)将待分离的样品充分溶解,与能充分吸附该样品量的100~200目硅胶搅拌均匀,挥干溶剂,得到柱层析所用样品;
装柱:根据拌样量硅胶量的多少,选择直径、长度适当的玻璃柱,装入适量300~400目的硅胶(使拌样的硅胶高度与固定相填料的高度比在1:15左右),用真空泵抽匀、抽实;
上样:将拌样得到的硅胶样品在层析柱上表面均匀铺撒,再用真空泵抽匀、抽实,然后在样品上表面添加保护层硅胶和脱脂棉;
洗脱:根据TLC薄层板中化合物的比移值(Rf值)不同,所要得到的化合物的Rf值大小,选择适当的洗脱剂,按极性从小到大的顺序,选择不同的梯度连续洗脱,收集洗脱剂组分;
回收组分的处理:通过薄层层析分析法显色后,把含有相同Rf值并且显色相同的组分合并在一起。合并到一起的各个组分分别用旋转蒸发仪于40℃左右减压浓缩,得到浓缩浸膏或干粉颗粒。
1.4.2 凝胶柱层析(Sephadex LH-20)
分离原理:凝胶柱层析也叫分子筛过滤,它是利用分子筛效应过滤分离物质的方法,其所用载体,如Sephadex-LH-20,具有三维的网状结构。当在有机溶剂中充分溶胀后装入色谱柱中,加入样品混合物,用同一溶剂洗脱时,由于凝胶网孔半径的限制,大分子物质不能进入到凝胶颗粒内部网孔中,在颗粒间隙流动,随着洗脱剂一起从柱底流出,小分子化合物因为能够进入凝胶颗粒内部,而后流出。从而样品按分子量从大到小先后流出凝胶色谱柱。实验操作步骤如下:
装柱:本实验所用的凝胶为葡聚糖凝胶Sephadex LH-20。凝胶在使用前用甲醇充分溶涨,装柱完成后再用3倍柱体积的洗脱液置换;
上样:将浓缩后的样品用尽量少的溶剂充分溶解(样品用初始洗脱剂溶解),上样结束后,使样品全部进入柱内再用尽量少的洗脱液清洗漏斗及柱壁,
洗脱:待样品完全进入柱材料中时,缓缓加入洗脱液(甲醇,甲醇与二氯甲烷的混合溶剂),调至合适的流速 (流速与柱长度和直径有关系),常压过柱;
回收组分的处理:通过薄层层析分析法显色后,把含有相同Rf值并且显色相同的组分合并在一起。合并到一起的各个组分分别用旋转蒸发仪于40℃左右减压浓缩,得到浓缩浸膏或干粉颗粒。
1.4.3 反相柱层析
分离原理:反相柱层析其固定相为非极性基团,如十八烷基(C18)、辛烷基(C8)、甲基与苯基等,流动相用强极性溶剂,如水、醇、乙腈或者无机盐缓冲溶剂,最常用的是不同比例的水和甲醇配制的混合溶剂。极性大的组分先流出,极性小的组分后流出,恰好与正向法相反,故称反向层析。本法适合于小分子物质的分离纯化。实验操作步骤如下:
装柱:本实验所用的反相柱层析填料为RP-C18。选择直径、长度适当的玻璃层析柱,将适量RP-C18填料和起始梯度的洗脱剂混悬(甲醇)后进行装填;
平衡层析柱:用起始梯度的洗脱剂(不同浓度的甲醇或丙酮)平衡柱子;
上样:将样品用适量起始梯度的洗脱剂完全溶解,用漏斗过滤后,液体上样;
洗脱:根据TLC薄层板中化合物的比移值不同,所要得到的化合物的比移值大小,选择适当的洗脱剂,按极性从大到小的顺序进行洗脱;
回收组分的处理:通过薄层层析法显色后,把含有相同Rf值并且显色相同的组分合并在一起。合并到一起的各个组分分别用旋转蒸发仪于40℃左右减压浓缩,得到浓缩浸膏或干粉颗粒。
1.5 实验过程
1.5.1 实验流程图(如图4)
1.5.2 发酵物的处理:
加入乙酸乙酯浸没菌丝体,72小时后,过滤,将滤渣用玻璃棒搅碎,再加入乙酸乙酯浸泡并超声20 min,然后过滤。将乙酸乙酯相合并蒸干,得到粗提物浸膏4.6g。(如图5)为粗提物HPLC谱图分析。
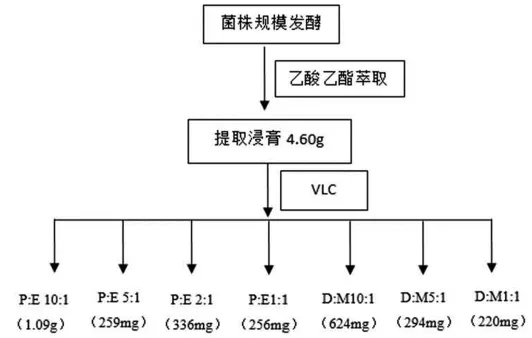
图4 实验流程图Figure4 Flow chart of the experiment
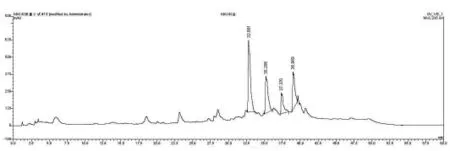
图5 粗提物HPLC谱图分析Figure5 Crude extractings HPLC chromatogram analysis
1.5.3 代谢产物的分离
菌株发酵浸膏通过真空柱层析(VLC)进行极性分段。用100~200目硅胶拌样,200~300目硅胶装柱子,真空泵抽紧后上样,用不同比例的、极性从小到大的石油醚-乙酸乙酯和氯仿-甲醇溶液进行层析洗脱。收集到的各个组分,再经反复的正相、反相色谱层析和重结晶等方法,分离纯化得到单体化合物。综合运用现代波谱技术 (旋光、UV、1H-NMR、13CNMR、DEPT、1H-1H COSY、HSQC、HMBC) 以及与标准品或文献比对,共鉴定了3个化合物的结构。
2 结果与分析
试验结果见图5-图14
化合物1的1H和13C谱数据(如图6-7)
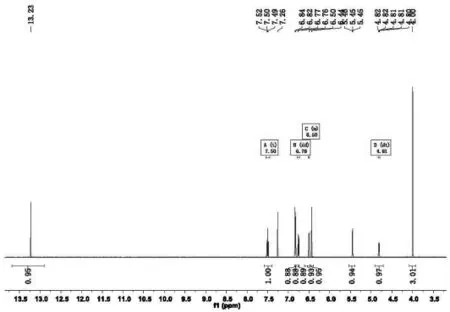
图6 化合物1的氢谱数据Figure6 Compounds 1 h NMR data
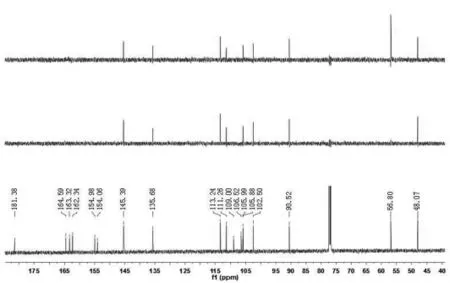
图7 化合物1的碳谱数据Figure7 c NMR data of compounds 1
化合物2的1H和13C谱数据(如图8-9):

图8 化合物2的氢谱数据Figure8 Compounds 2 h NMR data

图9 化合物2的碳谱数据Figure9 Compounds 2 c NMR data
化合物3的1H和13C谱数据(如图10-11):
2.1 化合物1为白色针状晶体,有亮蓝色荧光,茴香醛显绿色。该化合物的一维核磁数据显示了氧杂蒽酮(xanthones)的结构特征,经过文献[8]查阅和比对,发现化合物1与sterigmatocystin(柄曲菌素)的数据几乎完全一致,因此将其鉴定为sterigmatocystin(如图12)。该化合物被报道对人肝癌肿瘤细胞株Bel-7402和人大细胞肺癌细胞株NCIH-460有微弱抑制活性。
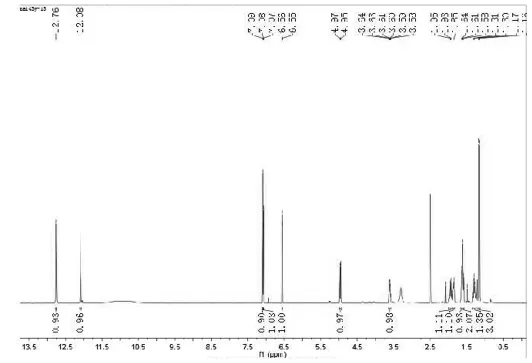
图10 化合物3的氢谱数据Figure10 Compounds 3 h NMR data
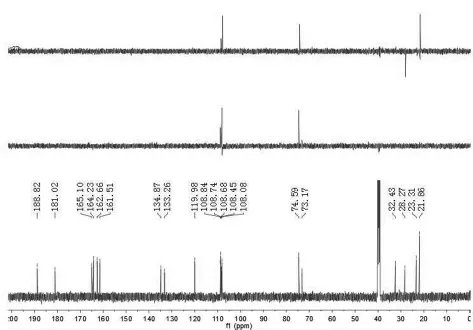
图11 化合物3的碳谱数据Figure11 Compounds 3 c NMR data
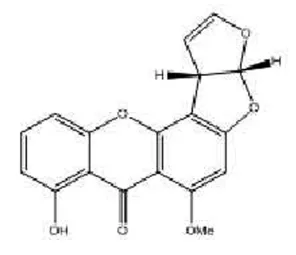
图12 化合物1结构Figure12 Compounds 1 structure
2.2 化合物2为橙黄色固体粉末,有黄色荧光,茴香醛显黄色。该化合物的一维核磁碳谱数据显示了蒽醌类化合物的结构特征,经过文献查阅和比对,发现化合物2与Versicolorin A(杂色曲霉素)的数据几乎完全一致,因此将其鉴定为Versicolorin A(如图13)。

图13 化合物2结构Figure13 Compounds 2 structure
2.3 化合物3为红色固体粉末,有黄色荧光,茴香醛显血红色。该化合物的一维核磁碳谱数据显示了蒽醌类化合物的结构特征,经过文献查阅和比对,发现化合物3与Averufanin的数据几乎完全一致,因此将其鉴定为Averufanin(如图14)。

图14 化合物3结构Figure14 Compounds 3 structure
3 结论
红树林植物开发新型生物活性物质的潜能不可低估[9],开发其药物价值,发挥其经济效益与生态效益,促进海岸居民对其加以保护和种植,具有非常重要的现实意义[10]。
