HAART对AIDS合并HBV/HCV感染患儿CD4+T细胞、病毒载量的影响
2019-03-05蒋晓军刘青海
蒋晓军,刘青海
(1.邵阳学院附属第一医院检验科,湖南邵阳 422000;2.隆回县妇幼保健院,湖南邵阳 422000)
由于HIV与HBV以及HCV的传播途径相似,HIV患儿感染合并HBV/HCV的感染在临床治疗中并不少见[1]。高效抗逆转病毒疗法(HAART)是现目前临床上用来抑制艾滋病毒最为有效的治疗措施,能够有效抑制病毒复制,增加艾滋病患儿的CD4+T细胞数,有效缓解患者病情[2]。据研究报道显示,HBV/HCV 合并感染不仅仅会对患儿的肝脏功能造成损伤,还会影响HAART的治疗效果[3]。据悉,患儿肝毒的发生率在12.3%~15.6%。目前,临床中对HAART治疗HIV合并HBV/HCV感染患儿过程中,患儿的肝功能以及病毒载量的变化状况研究较少[4]。本院旨在研究艾滋病合并HBV/HCV患儿在进行HAART治疗后,患儿肝功能以及病毒载量的变化。现将研究结果报道如下:
1 材料与方法
1.1一般资料 选取2014年4月至2015年4月在本院接受治疗的艾滋病患儿117例,入选标准为[5]:(1)HIV-1抗体为阳性;(2)患儿的年龄必须小于16岁;排除标准:(1)合并HBV、HCV以外的感染患儿不得参加本次研究;(2)采用HbsAg检测阳性来诊断HBV感染,通过抗体HVC阳性且HCV-RNA定量阳性来诊断患儿的HCV感染。其中男性患儿有56例,占47.86%,女性患儿有61例,占52.14%,患儿的年龄为4~12岁,平均(8.21±1.45)岁。主要传播途径为血液、母婴传播。其中母婴传播患儿84例,血液传播患儿33例。检测结果显示,符合以上条件的有88例患儿为单纯HIV感染,分为A组;8例患儿合并HBV感染,分为B组;21例合并HCV感染的患儿,分为C组。整个研究过程取得本院伦理委员会批准同意,并且经所有的患儿或者是患儿家属同意且签署知晓同意书。
1.2方法 治疗方案:(1)齐多夫定/拉米夫定/依非韦伦29例,其中合并有HBV感染患儿1例,HCV感染患儿2例;(2)齐多夫定/拉米夫定/奈韦拉平26例,其中合并HBV感染的患儿有4例,HCV感染患儿6例;(3)司他夫定/拉米夫定/奈韦拉平30例,其中合并有HBV感染的患儿3例,合并HCV感染的患儿2例;(4)司他夫定/拉米夫定/依非韦伦32例,其中HBV感染患儿6例,HCV感染患儿3例。肝功能检测:采用酶联免疫法检测丙氨酸转氨酶(ALT),患儿的正常值为≤40 U/L;而总胆红素(TBIL)采用化学氧化法检测,标准值为3.40~20.10 μmol/L,试剂盒由广东生物科技有限公司提供,操作步骤严格按照试剂盒说明书进行;肝毒性损伤标准:1级:50 病毒载量测定:采用的是上海欣欣生化有限公司生产的商品话试剂盒检测,对患儿血浆样品中的HIV-RNA进行定量分析,以每毫升的血浆病毒的含量拷贝数表示,最低检测限制在50 copies/mL。具体操作步骤严格按照试剂盒说明书进行。 CD4+T细胞检测:抽取所有入选患儿晨间空腹EDTA-K2抗凝血2.0 mL,细胞检测采用单克隆抗体试剂盒进行检测,由美国瑞美公司提供,抽取50 μL抗凝全血,采用抗人CD4单克隆抗体进行孵育25 min,然后采用红细胞裂解液裂解红细胞,之后在采用流式细胞仪进行检测,同时采用软件对CD4+T细胞进行分析。 1.3观察指标 观察比较3组患儿治疗前后肝功能、病毒载量以及CD4+T细胞变化情况。 2.1不同患儿接受HAART治疗前后肝功能变化情况比较 治疗前,3组肝功能异常的患儿共计29例(24.79%),3组比较差异无统计学意义(P>0.05);治疗后,3组肝功能异常的患儿共计82例(70.09%),3组治疗前后比较差异有统计意义(P<0.05)。详见表1。 2.2治疗前后肝功能指标分析 治疗前,3组患者的AIT、AST及TBIL水平差异无统计学意义(P>0.05);治疗后,3组患儿的AIT、AST及TBIL水平均明显升高,差异有统计意义(P<0.05);且A组的ALT水平明显低于B组和C组,差异有统计意义(P<0.05)。3组AST、TBIL水平比较差异无统计学意义(P>0.05),见表2。 2.3治疗前后CD4+T细胞以及病毒载量情况比较 治疗前,3组患儿的CD4+T细胞及HIV RNA水平差异无统计学意义(P>0.05);治疗后,3组患者的CD4+T细胞水平均明显增高,差异有统计意义(P<0.05),HIV RNA水平均明显降低,差异有统计意义(P<0.05),3组患者组间比较差异无统计学意义(P>0.05),详见表3。 表2 不同患儿接受HAART治疗前后肝功能变化情况比较 表3 治疗前后CD4+T细胞以及病毒载量情况比较 注:与治疗前相比,*P<0.05 近十年,我国开展了艾滋病儿童免费HAART治疗,取得了较好的效果[6]。但是服药依从性已经成为目前临床上影响HAART药物治疗的主要问题,服药依从性与多种因素有关,据研究资料表明,肝毒性是影响服药依从性的主要原因之一。目前临床上关于影响药物依从性患儿HAART肝毒性肝损伤的相关研究报道比较少。且这些研究报道都是关于成年人艾滋病患者的研究[7],对于儿童艾滋病合并HCV感染受HAART治疗效果的研究报道较少。 HAART是现目前临床上用来抑制HIV最为有效的治疗措施,能够有效抑制病毒复制,增加艾滋病患儿的CD4+T细胞数,缓解患儿的病情。本研究发现,无论是单纯的HIV感染患儿还是合并HBV或者是合并HCV感染的患儿在接受HAART治疗后,CD4+T细胞数都得到了明显提升,但是患儿的病毒载量却明显降低。将单纯HIV患儿、合并HBV感染患儿以及HCV 感染的患儿治疗后的CD4+T细胞以及病毒载量进行比较,差异无统计学意义(P>0.05),由此可以说明,HAART的治疗效果还是受到肯定的,同时受合并HBV感染患儿以及HCV感染患儿的影响也比较小。 本研究结果表明,对患儿进行为期平均2年以上的HAART治疗,治疗后患儿的肝损伤比例由原来的24.79%上升到后来的70.09%,增加幅度特别明显,由此可以说明,患儿在采用HAART治疗后,加重了肝脏损害。这一研究结果与相关研究报道基本一致[8-9],由此说明了患儿在经过HAART治疗后,加重了肝脏的损伤,治疗后3组2级肝毒性肝脏损伤增多。 合并肝功能损伤的患儿主要表现在:合并HCV感染的患儿高于单纯HIV感染的患儿,但是合并HBV感染的患儿与单纯HIV、合并HCV感染的患儿肝脏损伤无显著差异。由此得出的结论是,合并HCV感染的患儿肝功能损伤更加明显。但是从患儿肝功能损伤的程度来看,所有的患儿在讲过HAART治疗后,对AST以及TBIL均无明显影响。有相关研究结果提示,HIV合并HCV感染是HAART患儿肝脏损害的重要危险因素,由此对患儿肝脏损害的程度提高,所以临床医生在遇到HIV患儿进行HAART治疗时,尤其是合并HCV感染的患儿时,必须要强化对患儿ALT指标的监测[10]。因为肝转氨酶的升高也反映了一种免疫重建综合征,但是随着HAART的治疗,肝转氨酶也会得到一定的改善。 治疗过程中,若遇到血清ALT低于正常上限值的患儿时,不需要暂停抗病毒治疗,及时进行对症护理便可,有利于提高HAART治疗的依从性。有研究表明,无论是儿童还是成年人,病毒载量以及CD4+T淋巴细胞都是评价HAART疗效中最常用的指标[11]。且有相关研究报道指出,合并肝炎病毒感染可能会影响HAART的治疗效果,同时有会导致合并HCV增加感染HIV感染患儿的病死率[12]。 HIV合并HBV或者是HCV感染的患儿在进行HAART治疗时,可以显著改善艾滋病患儿的免疫学指标,同时也能改善患儿的病毒学状况,但是在治疗过程中需密切关注患者肝功能变化情况。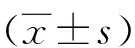
2 结 果


3 讨 论
4 结 论
