ISL-1诱导脂肪干细胞向起搏样细胞分化
2019-03-05黄从新
张 健 黄从新
迄今为止,药物治疗和安装电子起搏器挽救了很多缓慢性心律失常患者的生命,但长期药物治疗并不能解决根本问题而且存在严重的不良反应,电子起搏器也存在导线断裂、电磁干扰、囊袋感染、电池寿命有限以及缺乏自主神经反应等问题。生物起搏器既避免了传统治疗方式的问题,又具有长期的神经体液系统反应,是更理想的缓慢性心律失常患者的治疗方式[1]。
由于窦房结(sinoatrial node,SAN)的发育是多因素和多机制的结果,随着基因工程和干细胞的研究进展,联合基因治疗和细胞治疗诱导胚胎发育通路再激活成为构建生物起搏器的研究热点[2~4]。脂肪干细胞(adipose-derived stem cells,ADSCs)是从脂肪组织中分离得到的一种具有多向分化潜能的间充质干细胞,凭借着来源广泛,体内储备量大,取材容易,体外稳定增生且衰亡率低,对机体损伤小,适宜自体移植等优点,成为生物起搏的种子细胞[5, 6]。Rangappa等[7]首先证明30%的ADSCs在用5-氮杂胞苷处理2周后聚集形成具有自发收缩性的球状结构。随后,Planat-Benard等[8]证实,ADSCs可以在没有5-氮杂胞苷的甲基纤维素培养基中分化成能够自发跳动的心肌细胞。Chen等[9]在未添加任何辅助试剂的条件下,培养的棕色ADSCs可以自发性搏动,表明棕色ADSCs可以向起搏样细胞的分化,同时沉默Tbx18可终止棕色ADSCs分化为起搏样细胞。表明ADSCs是否分化为起搏样细胞可能取决于这些细胞中的转录因子,提示着可从窦房结发育机制着手,关键的转录因子可诱导ADSCs向起搏样细胞分化。
ISL-1是LIM同源转录因子,标记着第二心脏区未分化的心脏祖细胞,对促进心脏发育和分化起着非常重要的作用。Vedantham等[10]利用RNA测序技术证实ISL-1调控着小鼠窦房结的早期发育。Dorn等[11]研究也证实了ISL-1在小鼠胚胎干细胞或非洲爪蟾胚胎中过度表达会导致窦房结特异性基因的上调和工作心肌基因的下调。Liang等[12]利用ISL-1基因敲除小鼠,证实ISL-1在多种窦房结起搏功能必需的基因中均存在结合位点,对起搏细胞的发育和功能方面均有影响。因此,多项研究表明,ISL-1位于多种转录因子及离子通道上游并调控SAN特异性基因表达,本研究旨在联合生物起搏基因治疗和细胞治疗,探索ISL-1是否能在体外成功诱导脂肪干细胞向起搏样细胞分化,并初步探讨相应机制,为生物起搏寻求新的突破点。
材料与方法
1.材料:SD雄性大鼠10只(体质量约100~150g),出生后1~3天的SD乳鼠60~100只,雌雄不限,由湖北省疾病预防控制中心提供,实验动物许可证号:SCXK(鄂)20150018。胎牛血清(美国Gibcao公司),Ⅱ型胶原酶(武汉Biosharp公司),Ⅰ型胶原酶(中国Biosharp公司),5-溴脱氧尿嘧啶核苷(美国Sigma公司),DMEM/F-12培养基,胰酶细胞消化液(武汉碧云天公司),携带ISL-1基因的慢病毒质粒由上海吉凯基因科技有限公司提供,携带Tbx18基因的慢病毒质粒由上海汉恒生物科技有限公司提供,大鼠HCN4单克隆抗体(英国Abcam公司,ab32675),Alexa Fluor 647标记的山羊抗大鼠IgG(英国Abcam公司,ab150159),Trizol试剂、实时荧光定量聚合酶链式反应(qRT-PCR引物),细胞培养箱、37℃水浴锅、超高分辨共聚焦荧光显微镜(德国莱卡,Leica-LCS-SP8-STED),电泳仪、电泳槽、膜片钳系统。
2.慢病毒载体的构建及扩增:从基因文库查询目的基因ISL-1序列,化学合成cDNA并进行聚合酶链反应(PCR)扩增,将酶切好的慢病毒载体与ISL-1片段连接,得到重组慢病毒质粒Ubi-MCS-ISL-1-3FLAG-SV40-Cherry。然后将其转化DH5a感受态菌株,将转化后的ISL-1平板挑菌,提取质粒后酶切鉴定,用293细胞进行扩增,直至获得大量纯化的ISL-1慢病毒。进行效价测定,纯化病毒效价至1×108TU/ml。
3.ADSCs的分离和培养:3~4周龄雄性SD大鼠,体重约100~150g,由湖北省疾病预防控制中心提供。采用0.1%的Ⅰ型胶原酶胰酶消化法分离ADSCs,悬浮细胞经血细胞计数板计数后,按细胞密度1×106cells/ml接种于培养皿后置于 37℃、5% CO2培养箱培养,48h后首次换液,以后隔天换液,贴壁细胞至80%~90%融合时,用0.25%胰蛋白酶消化传代,期间应用相差倒置显微镜观察细胞形态变化,取第3~5代细胞进行各项实验。
4.慢病毒转导及转导效率的测定:首先确定最适感染复数(即MOI值),将第3~5代ADSCs种于24孔板内,细胞计数并调节各孔至相同数量,根据MOI值0、20、50、80、100分别加入ISL-1基因的慢病毒和阴性对照组病毒液+感染增强液(enhanced infection solution,ENI.S.)+助染剂(Polybrene)的混合液,置37℃,5%CO2培养箱中培养,8~12h后将换回常规培养基,48h后荧光显微镜下观察,72~96h用流式细胞仪测病毒转染效率,确定本实验的最适MOI进行后续实验。
5.NRVMs的分离与共培养:1~3日龄SD乳鼠,由湖北省疾病预防控制中心提供。采用0.125%胰酶+Ⅱ型胶原酶消化法分离心室肌细胞,90min差速贴壁法去除成纤维细胞,前2天加入终浓度0.0031%(0.1mmol/L)的5-溴脱氧尿核苷(Brdu),抑制成纤维细胞生长,心肌细胞的接种浓度为5×105cells/ml,48h后首次换液时,分别与各组转染成功的NRVMs共培养(ADSCs∶NRVMs=1∶10),以后每隔48h换液,观察细胞形态和搏动频率变化。
6.实时荧光定量PCR(qRT-PCR)分析:共培养7天后用Trizol试剂提取各组细胞总RNA,使用SYBR®Premix Ex TaqTM试剂盒(日本TaKaRa公司)将其反转录为cDNA,然后按照Life Technologies公司的StepOneTMReal-time PCR的操作说明和SYBR®Premix Ex TaqTM试剂盒进行(日本TaKaRa公司)的说明书进行荧光定量检测,每个样品均作3个复孔,反应条件为:95℃预变性1min,95℃变性15s,58℃退火20s,最后72℃延伸45s,共循环40次,溶解曲线从60~95℃,每20s升温1℃,以GAPDH作为内参,各指标引物序列详见表1。

表1 各基因的引物序列及产物长度
7.免疫荧光(immunofluorescence):将细胞种入共聚焦皿共培养7天后,4%多氯甲醛室温固定15min,用含0.2%riton X-100和0.3% H2O2的甲醇溶液封闭15min,2%BSA封闭15min后加入HCN4的一抗4℃过夜,荧光二抗室温孵育1h,DAPI室温核染10min后,抗荧光淬灭封片剂封片,超高分辨共聚焦荧光显微镜观察并拍照。
8.全细胞膜片钳分析:利用膜片钳系统Axopatch-ID放大器和pCLAMP软件在共培养5~7天后以全细胞模式记录mcherry组和ISL-1组的起搏电流If。控制温度约25℃,电极芯片电阻(2.0~3.5)MΩ,封接电阻(1~2)GΩ,钳制电位-40mV,给予幅值-40mV→-140mV的超极化脉冲,阶跃电压为10mV,超极化电压钳制时间4s,最后回归到+20mV,在+20mV处测尾电流。细胞外液: NaCl 135mmol/L, KCl 5.4mmol/L, CaCl21.8mmol/L,MgCl21.0mmol/L,glucose 10mmol/L, BaCl22.0mmol/L, HEPES 5.5mmol/L,用 NaOH 调至pH值为7.4。电极内液:KCl 120mmol/L,CaCl25.0mmol/L,MgCl25.0mmol/L, HEPES 10mmol/L,EGTA 10mmol/L,用KOH调至pH值为7.3。封接破膜后形成全细胞记录模式,所有记录数据应用pCLAMP 10.1软件进行处理。

结 果
1.ADSCs细胞形态观察:刚分离的原代ADSCs以圆形为主,4~5h逐渐开始贴壁,24h后可见少量细胞贴壁,形态不规则,以多边形和梭形为主,48h 后可见较多细胞贴壁,贴壁细胞以长梭形为主,较为扁平,可见个别折光率较高卵圆形细胞(图1A)。5~7天后,细胞密度可达90%以上,形态为成纤维样长梭形为主,大小略有不同,相邻细胞向一定方向生长。消化传代后,细胞生长呈梭形,突起减少,形态大小趋于一致,细胞呈束状或漩涡状排列,增殖速度较原代明显增快,2~3天即可覆盖约90%以上(图1B)。
2.MOI值和转染效率检测:根据MOI值0、20、50、80、100分别加入带ISL-1基因的慢病毒和阴性对照组病毒液+ENI.S.+Polybrene的混合液,48h后荧光显微镜结果显示(图1C),转染成功的ADSCs发出红色荧光,随着MOI值的升高,荧光的强度逐渐增加,MOI≥50时,转染效率≥80%,同时细胞死亡数量也逐渐增加,与流式结果一致,综合荧光强度和细胞毒性,确定本实验最适MOI=50(图1D)。
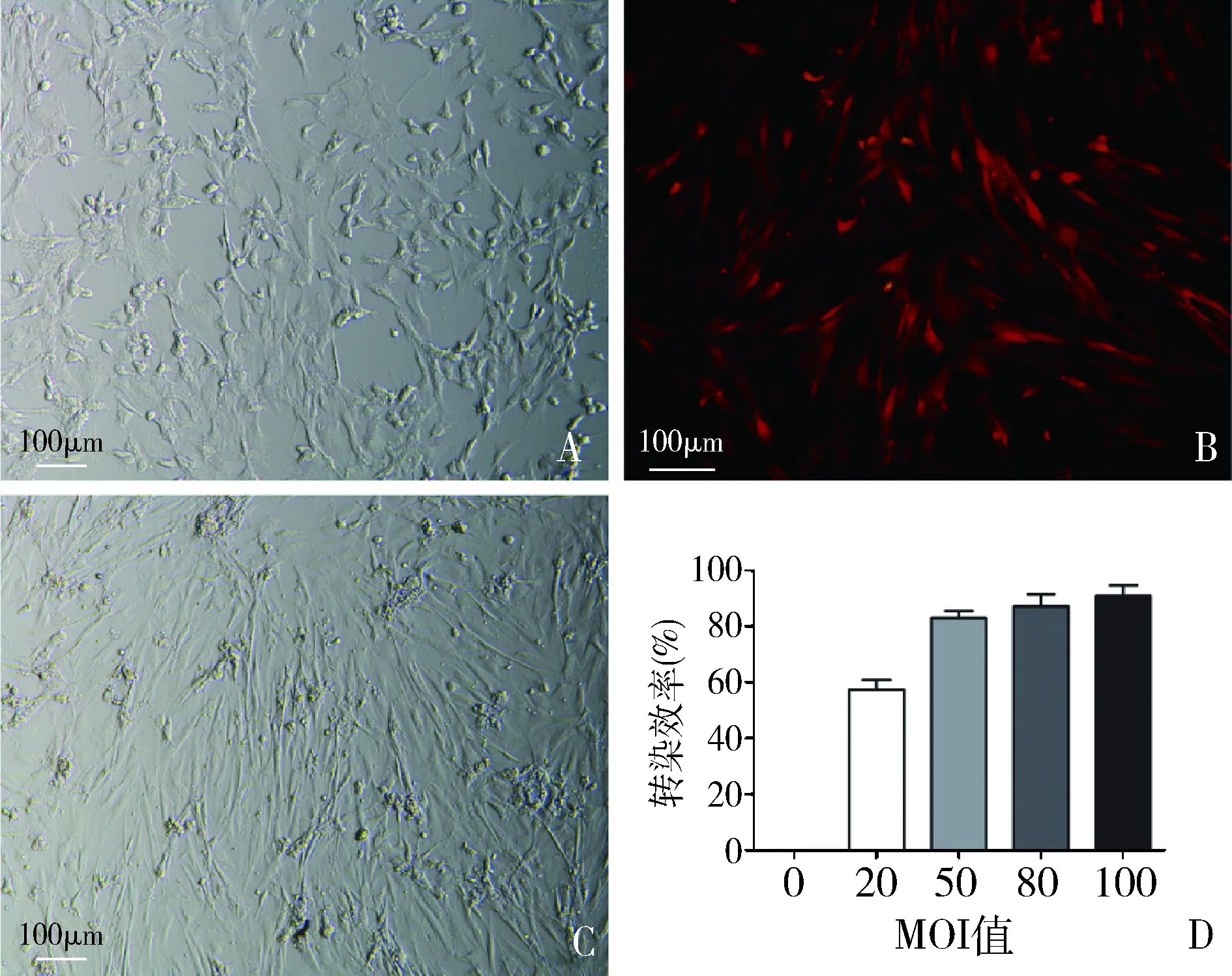
图1 ADSCs细胞形态和转染效率
3.细胞形态观察和免疫荧光检测HCN4的表达:共培养系统中光镜下观察,2天后可见转染成功的ADSCs与NRVMs开始产生连接,形成少量的细胞簇,同簇中细胞同步搏动,5天后多数细胞连接成网状,细胞成片搏动,7天后几乎全部细胞形成连接并呈整体搏动。超高分辨率共聚焦荧光显微镜显示,mCherry组细胞未见明显HCN4表达,形态大多以梭形为主,横纹肌不明显(图2A),而ISL-1组多数细胞可检测到HCN4表达,主要分布在细胞膜和胞质中,表现为大小不一,连续的荧光团或荧光点,表达HCN4的ADSCs形态发生改变,伸出似心肌细胞样伪足,主要为梭形、三角形和不规则形,其中以梭形最为常见,横纹肌明显(图2B)。
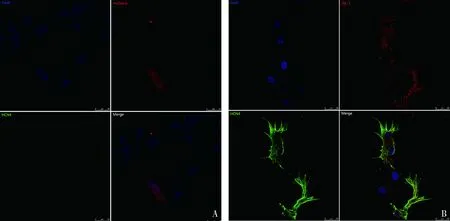
图2 激光共聚焦显微镜观察ADSCs免疫荧光HCN4的表达
4.心脏相关基因的mRNA表达水平:qRT-PCR结果显示,mCherry组和Blank组各基因的mRNA水平相差无统计学意义(P>0.05,图3),而ISL-1组的窦房结特异基因HCN4、Cx45和Tbx3的mRNA水平明显高于mCherry组,工作心肌特异基因Nkx2.5的mRNA水平明显低于mCherry组,差异有统计学意义(n=3,P<0.05)。

图3 心脏相关基因的mRNA表达水平
5.起搏离子通道电流的测定:选取细胞膜光滑、细胞体饱满并表达红色荧光的的梭形细胞进行检测(图4A)。全细胞膜片钳结果显示,Blank组和mCherry组均未记录到超极化激活的内向电流,ISL-1组ADSCs可以记录到超极化激活的内向电流(图4B),且对Cs+敏感,当细胞外液中加入CsCl(4mmol/L) 阻断剂后,该内向电流被阻断,当细胞外液中的CsCl被洗脱后,内向电流又迅速恢复,该电流具有明显的时间及电压依赖特性(图4C)。
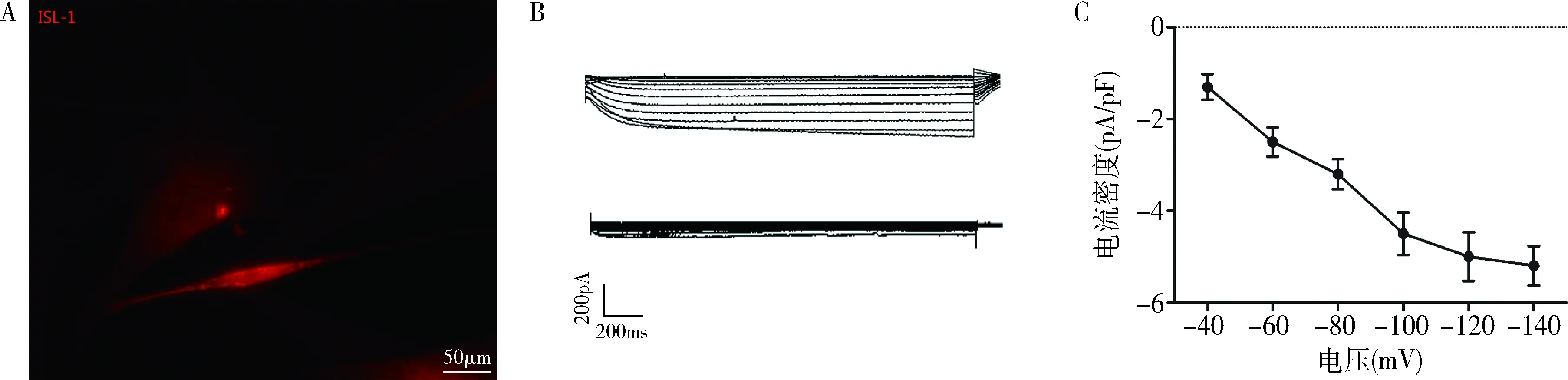
图4 ADSCs膜片钳记录
讨 论
关于生物起搏的研究,以前研究者多倾向于研究基因转染,通过导入受损的自律性节律点或传导系统的组织中,使目的基因表达相应蛋白质或抑制体内某基因的表达,从而达到恢复心脏起搏或传导功能的目的。随着干细胞的发现和分子生物学的进展,研究者后期研究致力于诱导干细胞生成起搏样细胞,移植到受损自律性节律点或传导系统组织中,进行细胞修复或替代,或将干细胞作为基因载体与周围心肌细胞形成电偶联,重建心脏传导系统[13]。每种方法都有其局限性:基因治疗可能引起基因突变且依赖于基因载体的功能;细胞治疗具有置入部位的免疫抑制和肿瘤形成的风险,因此联合基因疗法和细胞疗法既能结合彼此的优势又能弥补彼此的缺点,是构建生物起搏器的大势所趋。
间充质干细胞诱导为心肌细胞的方法主要有生化诱导、心肌微环境诱导和基因修饰3个方面[14]。其中心肌微环境主要通过细胞因子、化学物质、电活性和机械牵张等方面影响诱导结果,而相关研究发现直接接触比间接接触更有利于成体干细胞分化为心肌细胞,并且以成体干细胞∶NRVMs=1∶10的比例共培养,更有利于诱导成体干细胞的分化[15,16]。本实验通过慢病毒携带在SAN发育中起上游调控作用的转录因子ISL-1,并与NRVMs共培养模拟心肌生理微环境共同起到诱导ADSCs向起搏样细胞分化的作用。本研究发现与NRVMs共培养后的ADSCs形态不规则,心肌样伪足明显增多。超极化激活的环核苷酸门控阳离子(hyperpolarization-activated cyclic nucleotide-gated,HCN)通道共有4种亚型(HCN1~4)表达,其中HCN4在SAN中表达量最高并且与SAN的电生理活动紧密相关,因此HCN4可以被认为是SAN的特异性标志物[17]。在本实验中也发现过表达ISL-1组细胞中HCN4的mRNA水平都明显上调,并且通过膜片钳技术记录到由HCN通道产生的超极化内向离子流(If电流)。心脏中发现共有4种主要的连接蛋白,包括连接蛋白40(Cx40)、连接蛋白30.2(Cx30.2)、连接蛋白43(Cx43)和连接蛋白45(Cx45)。传导性强的Cx43在工作心肌细胞中是主要的连接蛋白,而传导性较低的Cx45主要在SAN中心表达,窦房结周围与界嵴的过渡带共同表达Cx43和Cx45[18, 19]。正是缝隙连接蛋白的这种分布特点,使得位于SAN中心的起搏细胞由于低传导性的Cx45的保护而不受心房肌的抑制,最早完成除极成为最早起搏点,并且随着外围传导性逐渐升高,除极电流迅速向外传播并使心房肌除极,从而保证了SAN正常的起搏功能。本实验也证实了过表达ISL-1能促使Cx45显著上调。
窦房结的形成是一个复杂的过程,E9.5天可在形态上鉴别SAN结构,在E12.5天SAN有初步的形态和功能,约在E14.5天具备典型的SAN结构和动作电位[20]。SAN的胚胎发育过程中有着众多转录因子参与调控,在E8.5天,ISL-1在原始心管的心背系膜及前肠腹侧、心包腔背侧壁脏壁中胚层间充质均有表达,在E9.5天,ISL-1集中表达在静脉窦,即早期胚胎的原始起搏区,数量随发育明显增加,在E11~12天达顶峰,在前肠腹侧形成连续的ISL-1阳性细胞带,将流出道远端和心房心背系膜相连,E13天后,表达强度逐渐下降[21]。小鼠窦房结中的ISL-1阳性细胞在1~18个月保持不变,这与在人窦房结中检测到ISL-1的mRNA表达结果一致[22]。足以可见ISL-1和SAN的胚胎发育有着明显的时空重合,表明ISL-1在SAN的形成过程中起着非常关键的作用。而Tbx3基因主要参与心脏传导系统发育的调控,Wiese等[23]发现转录因子Tbx3在SAN头部和尾部均有表达,启动起搏基因程序,调节起搏细胞分化形成,对SAN的起搏功能有着重要的作用。并且 Tbx3 可以抑制心房特异性基因如Cx40、Cx43、Nppa 在窦房结的表达,维持窦房结起搏基因HCN4表达的稳定性,确保窦房结细胞不向心房肌分化[24]。而Nkx2.5是心肌细胞表达的最主要的早期转录因子之一,主要在工作心肌中表达,在SAN中不表达或低表达。ISL-1和Nkx2.5阳性祖细胞在心脏分化过程中均呈持续表达,Nkx2.5能有助于工作心肌分化,导致HCN4和Tbx3的下调[21,25]。相反,本实验证明ISL-1过表达可上调SAN特异性基因HCN4和Tbx3,下调工作心肌基因Nkx2.5,诱导窦房结分化,表明ISL-1和Nkx2.5是一种相互拮抗的关系,共同调控着心脏的胚胎发育的不同方面。
本研究联合生物起搏基因治疗和细胞治疗,通过转基因技术将携带ISL-1的慢病毒转染至ADSCs,并与NRVMs共培养,诱导ADSCs向起搏样细胞分化,成功构建了体外生物起搏点。但本研究仍存在以下不足:(1)慢病毒是可以有效整合至宿主染色体的基因载体,但并未进行稳定细胞系的筛选和长期观察。(2)由于慢病毒转染效率低,没有进行下一步的动物实验。(3)本实验中相关基因的mRNA表达水平,推测可能是由于存在物种种属的差异。笔者将总结经验和教训,在体内和体外进行更多的研究,包括在体内是否能产生稳定的生物起搏器活性,评估其安全性和有效性,寻求更好的稳定起博点等。另外,诱导多能干细胞(induced pluripotent stem cells,iPSCs)具有分化成心室、心房和结样细胞细胞的巨大潜能并且可避免免疫抑制和肿瘤形成[26]。这些特性使iPSCs与成体干细胞移植比较,能够更好地整合到宿主心脏组织中。因此,笔者也正尝试利用iPSCs构建生物起搏点,生物起搏虽然现今取得一定进展,但仍需开展深入的实验研究。