外周血sPD-L1在预测侵袭性非霍奇金淋巴瘤患者预后中的临床价值
2019-03-05徐玉秀
徐玉秀
非霍奇金淋巴瘤(NHL)属起源于淋巴结及淋巴组织的强异质性恶性肿瘤类型,以弥漫大B细胞淋巴瘤(DLBCL)常见,约占所有NHL的40%[1],其中进展速度快、恶性程度较高的侵袭性NHL所占比例高达60%[2]。虽以阿霉素、利妥昔单抗为主的免疫化疗方案在一定程度上提高了侵袭性NHL患者的生存率,但仍有40%左右的患者因对治疗反应性低或疾病复发导致治疗失败[3]。近年来肿瘤微环境在淋巴瘤发病、进展、耐药及复发过程中起着关键作用[4]。程序性细胞死亡配体1(PD-L1)系机体免疫负调控的重要蛋白,PD-L1/程序性细胞死亡受体1(PD-1)通路则为机体重要免疫检查点,对免疫反应有负调控作用,PD1与其配体PD-L1结合后可抑制活化免疫细胞功能。但研究发现,肿瘤细胞可通过影响PD-L1/PD-1通路,获得免疫逃逸,阻断其所唤醒的抗肿瘤免疫反应[5]。目前已证实在黑色素瘤、肾癌、非小细胞肺癌中阻断PD-L1/PD-1通路均可强化机体抗肿瘤免疫反应[6-7]。但对PD-L1在侵袭性DLBCL中的作用尚少见报道。基于此,为探讨外周血可溶性PD-L1与DLBCL预后的关系,现对医院收治的112例患者的临床资料展开了回顾性分析,报告如下。
1 资料与方法
1.1 临床资料
收集2013年1月至2017年1月医院收治的112例侵袭性NHL患者的临床资料,作为病例组。纳入标准:年龄>18岁;均满足世界卫生组织血液淋巴瘤分类标准[8],且经病理确诊,均为DLBCL;伴淋巴结肿大;肿瘤呈弥漫性生长,肿瘤细胞核与正常组织细胞核相近或超过正常组织细胞核,体积不低于正常淋巴细胞的两倍;采血前4周内未应用免疫抑制剂或糖皮质激素治疗;病例及随访资料完整。排除标准:合并其他恶性肿瘤者;合并免疫功能缺陷者;合并心肝肾肺器质性功能障碍者;合并严重精神疾病者;合并人类免疫缺陷病毒感染者;原发性纵膈大B细胞淋巴瘤者;活动性乙型肝炎病毒感染者;既往接受联合化疗者;病例及随访资料不完整者。112例中男性62例,女性50例;年龄19~79岁,平均(58.6±5.7)岁;Ann Arbor分期Ⅰ~Ⅱ期28例,Ⅲ~Ⅳ期84例;NHL国际预后指数(IPI)低危38例,高危74例。并选择同期来我院体检中心查体的40例健康人作为对照组,均经体格检查心肝肾肺功能正常,其中男性22例,女性18例;年龄20~78岁,平均(57.9±6.5)岁。
1.2 方法
病例组入院次日均采集空腹外周静脉血2 mL,对照组于体检当日采集外周空腹静脉血2 mL,30 min内梯度离心(1 000 g×15 min)后获得血浆1 mL,采用双抗体夹心-酶联免疫吸附法(ABC-ELISA)测定外周血sPD-L1水平,PD-L1 ELISA试剂盒购自中国Usen life Science公司,将PD-L1抗体包被于96孔微孔板中,并向微孔内加入标准品,将PD-L1与抗体结合,加入生物素化PD-L1抗体,洗净未结合抗体,加辣根标记过氧化物酶亲和素,洗涤后加3,3,5,5-四甲基联苯胺(TMB)底物显色,过氧化物酶催化,加入终止溶液终止反应,酶标板无水滴、气泡后,采用美国Bio-Rad 680型全自动酶标仪(450 nm波长)测定吸光度值作为PD-L1浓度。并收集所有病例组患者临床资料,包括性别、年龄、症状、IPI指数、临床分期、血清乳酸脱氢酶水平、肿块大小、结外病变情况、病理类型等资料,比较不同临床特点患者sPD-L1水平的差异。
1.3 治疗方法
病例组所有患者均参照侵袭性NHL治疗指南[9]给予4~6个疗程化疗。并采用实体瘤疗效标准[10]评估治疗反应性,包括完全缓解(CR)、部分缓解(PR)、稳定(SD)与进展(PD)。
1.4 随访
病例组所有患者均完成1年随访调查,以总生存时间(OS,疾病诊断至末次随访或患者死亡时间)作为观察终点,记录患者OS。
1.5 统计学方法
2 结果
2.1 入院时病例组与对照组外周血sPD-L1水平比较
病例组外周血sPD-L1水平为(5.16±0.76)ng/ml,高于对照组(1.35±0.44)ng/ml,比较差异有统计学意义(t=29.925,P=0.000)。
2.2 病例组外周血sPD-L1水平与临床病理各参数的关系
不同性别、年龄、B症状、乳酸脱氢酶水平、结外病变数目DLBCL患者血清sPD-L1水平比较差异无统计学意义(P>0.05),IPI指数为高危、Ann Arbor分期为Ⅲ~Ⅳ期、肿块大小≥10 cm、病理类型为T细胞型、治疗反应为SD+PD的患者血清sPD-L1水平高于IPI指数为低危、Ann Arbor分期为Ⅰ~Ⅱ期、肿块大小<10 cm、病理类型为B细胞型、治疗反应为CR+PR的患者,比较差异有统计学意义(P<0.05),见表1。
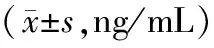
表1 病例组外周血sPD-L1水平与临床、病理各参数的关系
2.3 不同水平sPD-L1患者生存分析
以4.57 ng/mL作为cut-off值将DLBCL患者分为高sPD-L1组与低sPD-L1组,并进行生存分析。2组OS比较差异有统计学意义(P<0.05),高sPD-L1患者OS明显低于低sPD-L1患者(P<0.05),见图1。
2.4 DLBCL患者预后影响因素Cox回归分析
单因素及多因素Cox回归分析均证实高sPD-L1、Ann Arbor为Ⅲ~Ⅳ期、病理类型为T细胞型均为导致DLBCL患者预后不良的独立危险因素(P<0.05),见表2。
3 讨论
PD-L1为重要免疫负调节分子,在调节肿瘤微环境免疫中有重要作用,其可通过与PD-1结合抑制T细胞功能,限制免疫系统对癌细胞的杀伤作用,目前已被证实在多种癌细胞及免疫细胞表面均可检出PD-L1[11]。Chong等[12]指出,不同类型淋巴瘤病理组织均可检出PD-L1高表达,其认为PD-1/PD-L1在肿瘤微环境内所介导的免疫逃逸反应是引起淋巴瘤发病的重要原因。且陈泽等[13]发现阻断PD-L1/PD-1通路可提高DLBCL患者对化疗的反应性。有国外研究者指出DLBCL患者存在血sPD-L1高表达现象,且以1.52 ng/ml作为cut-off值发现患者预后不良发生率高达30%,认为sPD-L1可能为预后不良的有效预测因子[14]。但目前国内对淋巴瘤患者外周血sPD-L1水平与预后的关系尚少见报道。
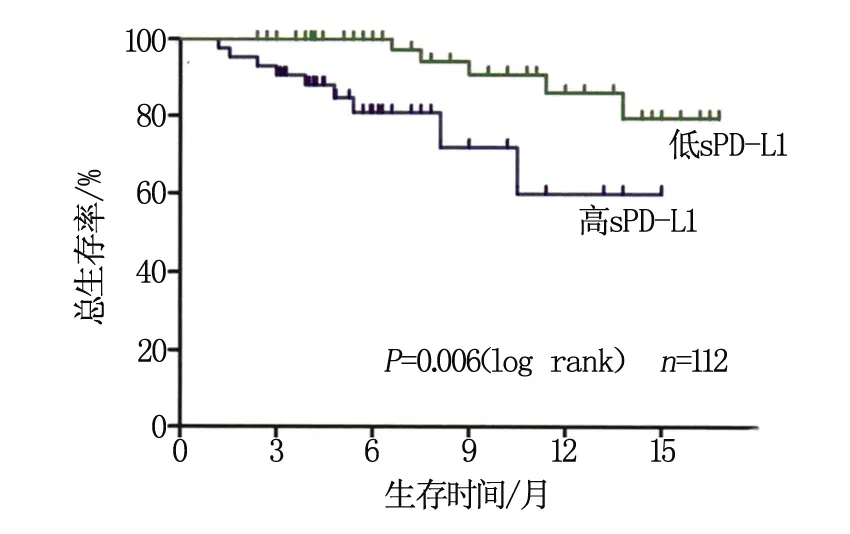
图1 高sPD-L1患者与低sPD-L1患者OS比较
本研究发现DLBCL患者外周血sPD-L1水平明显高于正常健康人,提示DLBCL患者外周血sPD-L1呈明显高表达;进一步研究发现,IPI指数为高危、Ann Arbor分期为Ⅲ~Ⅳ期、肿块大小≥10 cm、病理类型为T细胞型、治疗反应为SD+PD的患者血清sPD-L1水平较高,表明外周血sPD-L1水平与患者疾病发生、进展及治疗反应性均存在一定的联系。目前对DLBCL患者血sPD-L1来源尚未明确,部分认为DLBCL患者sPD-L1主要来源于肿瘤细胞,其与病理组织PD-L1表达一致性较高[15]。也有学者表示,淋巴瘤细胞可通过染色体扩增、基因融合、感染、炎症反应等多种途径表达sPD-L1[16]。而本研究发现,DLBCL外周血sPD-L1水平与临床分期、肿块大小、病理类型均有关,因此更倾向于认为DLBCL患者为外周血sPD-L1与淋巴瘤侵袭性病理状态有关,同时与肿瘤负荷情况存在密切联系,与Villasboas等[17]得出结论相近。同时本研究还发现对化疗治疗反应性较高的DLBCL患者sPD-L1水平较低,表明血浆sPD-L1水平与患者治疗反应有关,可作为病情监测的重要依据。
此外,本研究还发现,外周血高sPD-L1水平是导致DLBCL患者不良预后的影响因素,且以4.57 ng/ml为截断值发现高sPD-L1水平患者随访总OS明显低于低sPD-L1水平患者。同时进行Cox回归分析发现,高sPD-L1水平、临床分期为Ⅲ~Ⅳ期、病理类型为T细胞型均为影响DLBCL患者预后的独立危险因素,分析其机制可能为:PD-L1活化后可与淋巴细胞表面PD-1结合,抑制T细胞增殖及抗体分泌,影响机体细胞免疫及体液免疫功能,且持续高表达sPD-L1可促使肿瘤细胞获得免疫逃逸,逃避宿主监控,抑制或导致效应性T细胞表达减少或耗竭,传递T细胞抑制信号,导致癌细胞浸润,促进疾病进展,导致不良预后。

表2 DLBCL患者预后影响因素Cox回归分析
综上所述,DLBCL患者外周血sPD-L1水平呈明显高表达,且其表达水平与患者IPI指数、Ann Arbor分期、肿块大小、病理类型、治疗反应均存在密切联系,同时高水平sPD-L1是导致患者不良预后的危险因素。
