肿瘤标记物对原发性及继发性肝癌患者的诊疗价值
2019-03-05徐海煜
徐海煜 鱼 军 葛 鹏
常见肿瘤标记物为AFP、CEA、CA19-9和CA125。临床上肿瘤标记物被用于发现肿瘤患者、筛选肿瘤高危人群、判断肿瘤发展程度、鉴别肿瘤的良恶性和对术后肿瘤复发的检测[1]。既往研究表明各肿瘤标记物单独检测效果远不及联合检测敏感度高,特异性强,且存在难以消除的局限性[2-4]。本研究通过回顾分析542例肝脏和胆道系统恶性肿瘤患者资料,在考虑到患者年龄、性别和有无乙肝病史的情况下,探讨发现四种肿瘤标记物(AFP、CEA、CA19-9和CA-125)单独和结合检测恶性肿瘤的差距,从而为临床提供实验依据。
1 资料与方法
1.1 一般资料
随机选取2014年3月至2016年3月入我院接受肝脏良性肿瘤(肝细胞腺瘤、肝管细胞腺瘤),原发性及继发性肝癌,肝内结石,化脓性胆管炎,胆总管结石治疗的患者和接受常规体检者共542例,非小细胞癌(鳞状细胞癌198例、腺癌107例、未分化的大细胞癌121例)和小细胞癌116例,根据临床诊断病情的良恶性共分为三组:①良性肿瘤组(肝脏良性肿瘤,胆道系统良性肿瘤)患者182例,男性92例,女性90例,性别比1.02/1,其中15例有乙肝病史;②原发性及继发性肝癌组患者251例,男性142例,女性109例,性别比1.30/1,其中45例有乙肝病史;③正常组组患者109例,其中男性55例,女性54例,仅12例有乙肝病史。本研究获我院伦理委员会批准,患者或近亲属对研究方案签署知情同意书。
1.2 纳入和排除标准
纳入标准[5]:①不限男女,年龄18~90岁;②有肝脏和胆道系统疾病病症者;③手术检测发现有肝癌或胆道系统癌细胞。排除标准:①患者状况极差,无法接受手术治疗者;②患有肝硬化、糖尿病、胰腺炎等。
1.3 研究方法
对所有患者(空腹状态)抽血,血液样本抗凝剂,低温冷藏。通过样品浓度和对应的软件配置所需的标本浓度。抗原抗体特异性识别原理检测肿瘤标记物(AFP、CEA、CA19-9和CA-125),通过将各标本血样和放光物质标记的生物抗体控温培育[6-8],反应充分后除去标记抗体,用特定的生物测光仪测结合物的发光值,记录数据。具体操作如下:将各血液样本从冷藏箱取出后置于室温10 min后加入9倍的蒸馏水稀释待用。待测样本,标准样品分别置于不同的微型反应器中,分别加入标记不同肿瘤标记物(AFP、CEA、CA19-9和CA-125)的发光性生物抗体40 μl,混合均匀。37 ℃恒温箱反应1 h。洗液:除去微型反应器的多余液体,分别加入200 μl洗液除去未反应完全的发光性生物抗体,静止1 min;重复操作3次,使多余抗体洗净。测定:将发光底物液置于测光仪测量发光底物发光值RLU,将数据传入连接测光仪控制计算机中。
判断标准:肿瘤标记物AFP、CEA、CA19-9和CA-125的临界值分别为25 U/ml、4.8 U/ml、38 U/ml、34 U/ml,若测量值大于临界值,结果显示为阳性;多肿瘤标记物结合检测时,以正常者的RLU值判断是否为阳性率,若高于,则呈阳性。
1.4 仪器及试剂
仪器:生物芯片检测仪、电热恒温水温箱、光化学分析仪等;试剂:罗氏2010型电化学发光免疫分析仪及测定AFP、CEA、CA-125及CA19-9化学发光免疫试剂盒。
1.5 统计学处理
2 结果
2.1 肿瘤标记物AFP、CEA、CA19-9和CA-125检测结果
良性肿瘤组和原发性及继发性肝癌组AFP、CEA、CA19-9和CA-125检测值均明显高于正常组,差异具有统计学意义(P<0.05),见表1。
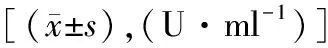
表1 良恶性肿瘤组及正常组中肿瘤标记物AFP、CEA、CA19-9和CA-125检测结果
2.2 肿瘤指标的诊断价值
在AFP、CEA、CA19-9和CA-125联合检测中,原发性及继发性肝癌组敏感度达64.5%,良性肿瘤组敏感度为61.1%,正常组的敏感度为40.9%,见表2。
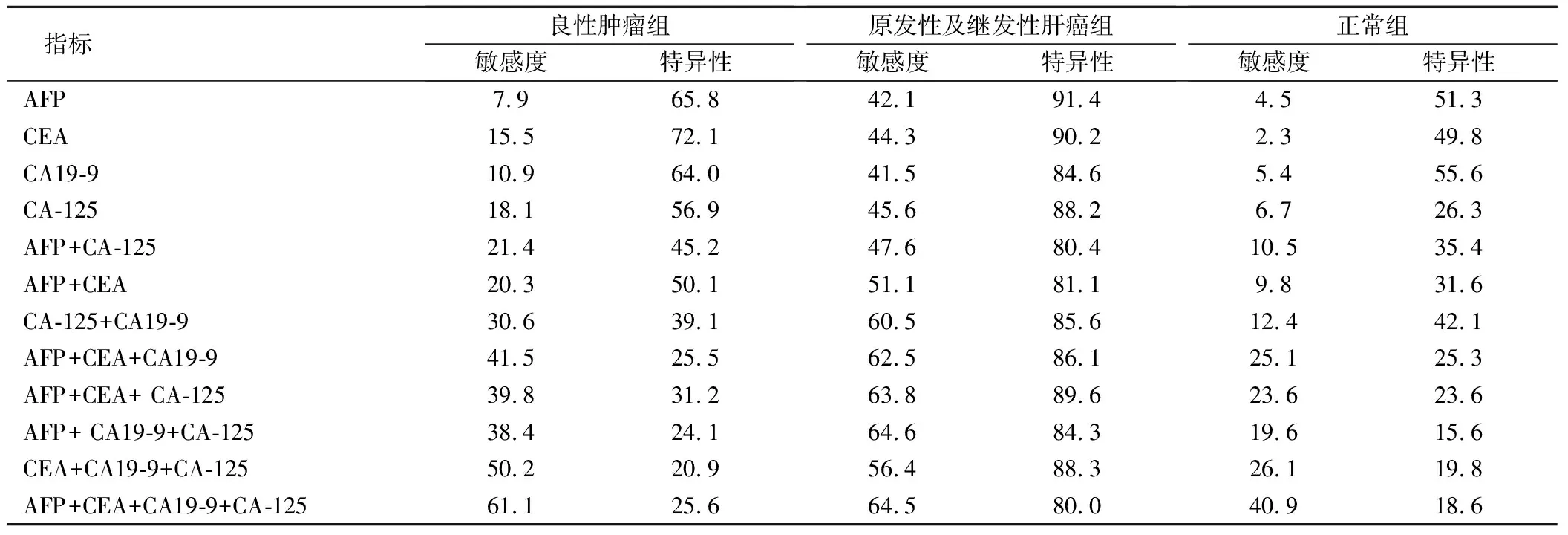
表2 肿瘤指标的诊断结果的敏感度和特异性/%
2.3 乙肝病史对肿瘤指标的影响
65例有乙肝患者的AFP值为(400.0±100.1)U/ml,无乙肝患者的AFP值为(324.6±154.9)U/ml,前者显著更高,差异具有统计学意义(P=0.008);而CEA、CA19-9和CA-125检测值未见明显差异(P>0.05),见表3。
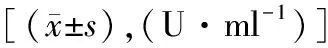
表3 乙肝与各肿瘤标记物指标的关系
3 讨论
肿瘤标记物是肿瘤细胞侵染宿主细胞后分泌的1种物质,多为抗原,酶,激素等,一般来说,宿主细胞出现过激反应而分泌的物质也属于标记物,这一类物质是肿瘤细胞良恶性病变或转变过程细胞特征、肿瘤扩散速率和发展的反映[9-11]。据世界卫生组织在《全球癌症报告》的报道显示,原发性及继发性肝癌在中国新增病例已居世界第一,治疗此类癌症刻不容缓[12]。由于致癌因子的累积作用,原发性及继发性肝癌发病年龄一般在40岁后,因此如何提前检测和诊断肝癌是治疗最好方法之一[13]。影像学技术定位肝癌患者早期发现率极低,即使中晚期发现肝癌,治疗也会对患者及其家人造成身心上的巨大压力。肿瘤标记物成为早期发现和诊断消化系统癌性疾病首选,本研究探讨的肿瘤标记物联合检测针对于肝脏肿瘤的诊断,极大降低漏检率[14-15]。
本研究表明,各组患者单一肿瘤标记物指标不具有代表性,单独检测时指标会出现阴性,所以单独检测带有一定局限性。各肿瘤标记物单独检测时意义差别不大,虽然AFP致力于肝癌早期发现,而CA-125和CA19-9则更倾向检测胆道系统恶性肿瘤,但是多种恶性肿瘤均会有各肿瘤标记物的变化。本研究进行了肿瘤标记物单独检测,两两联合检测和多种联合实验,实验发现联合多种肿瘤标记物(AFP、CEA、CA19-9和CA-125)检测有效提高了检测敏感度,这对原发性及继发性肝癌早期诊断意义重大,能有效降低漏诊率。研究发现同一种肿瘤标记物可由多种肿瘤细胞或同种肿瘤细胞不同组织和器官分泌,而不同标记物又可以仅有1种肿瘤细胞分泌,因此结合多种肿瘤标记物检测更具全面性,能弥补单一的不足,并且联合检测能提高各肿瘤标记物的敏感度。临床资料分析表示,乙肝患者体内肝功能异常,体内AFP较非乙肝患者高,会干扰对肝脏恶性肿瘤检测,检测时应考虑这一因素。同时,实验发现患有乙肝的患者患上肝癌的几率大于无乙肝患者的,也就是说乙肝与肝癌的发生有一定联系,在肝癌患者中乙肝病毒携带者和乙肝患者的AFP较无乙肝病史的高,因此也要考虑乙肝对联合检测的影响。
综上所述,临床检测原发性及继发性肝癌要结合多种肿瘤标记物,可提高检测准确率,同时要将患者有无乙肝病史情况加以考虑,进一步提高检测准确率。
