Cyclin D1及TNFR1在腺瘤性息肉与胃癌中的表达意义
2019-03-05周洪涛李山林刘学进
周洪涛 李山林 刘学进
胃癌是当前常见的消化系统恶性肿瘤,我国胃癌发病率的增速是世界平均水平的2倍左右,当前每年新发病例接近50万,严重威胁着居民的健康[1-2]。腺瘤性息肉是指胃黏膜局限性良性上皮或间质成分增生形成的病变,通常被认为是胃癌的癌前病变。流行病学调查显示腺瘤性息肉的癌变率比较高,在胃组织的癌变率在50.0%以上[3-4]。腺瘤性息肉与胃癌患者的早期诊断率较低,患者确诊时大多数已经属于中晚期,预后比较差[5]。腺瘤性息肉与胃癌的影像学检查有一定的误差性,病理学检查也存在检查的创伤性、取样部位的误差大、阅片者自身偏倚等不足[6]。随着现代分子生物学技术、现代免疫组织化学的不断发展,通过检测肿瘤细胞特异抗原等来诊断蛋白水平的变化已成为了可能。cyclin D1的扩增和过表达与人体多种肿瘤有关,cyclin D1的过度表达促使细胞过度增殖继而发生恶变[7-8]。TNFR在多种肿瘤的发生、发展中起到了重要作用,TNFR1可促进IL-6的表达、激活NF-KB信号通路,促进成纤维细胞增殖以及细胞程序化死亡,从而参与调控多种肿瘤血管发生相关基因的转录[9-10]。本研究收集相关胃癌病例,对患者的临床特征进行了回顾性研究,并用免疫组织化学法检测Cyclin D1及TNFR1的表达水平,探讨Cyclin D1及TNFR1在腺瘤性息肉与胃癌中的表达意义。
1 材料与方法
1.1 研究对象
采用回顾性、随机抽样研究方法,选择2011年12月到2016年8月在我院进行诊治的120例胃癌患者与120例腺瘤性息肉患者的组织标本作为研究对象,纳入标准:患者临床病例资料齐全;原发于胃部疾病,非其他部位转移或复发的胃部疾病病例;所有病例均为初次治疗或外院术后治疗不彻底3个月以内;研究得到了医院伦理委员会的批准。排除标准:组织病理学不明确的病例;未行手术或活检病例;妊娠孕妇与哺乳期妇女;精神疾病患者。
1.2 免疫组化分析
所有标本都给予免疫组化分析,采用 Envision法染色两步法,严格按照试剂盒说明书进行操作。兔抗人Cyclin D1、TNFR1多克隆抗体都由英国Abcam公司提供,工作浓度为1∶100。快速免疫组化检测试剂盒由福州迈新生物技术开发有限公司提供,严格按照试剂盒说明书进行操作;英国Abcam公司提供Breast carcinoma作为阳性质控片。95%乙醇、85%乙醇、苏木精、PBS 缓冲液、二甲苯、无水乙醇、蒸馏水、内源性过氧化物酶阻断剂、中性树胶等由本院保存。
由两名高年资病理医师采用双盲法进行染色结果判断,TNFR1阳性表达为细胞膜和细胞质出现棕黄色或棕褐色颗粒,cyclin D1阳性染色为肿瘤细胞的胞核出现棕黄色颗粒。双盲法随机抽取有代表性的10个连续的高倍视野(×400倍),每个视野计数100个细胞,TNFR1、cyclin D1阳性染色的肿瘤细胞占所有肿瘤细胞的比例≥20%被视为阳性表达。
1.3 调查分析
选择Microsoft Excel 2010软件收集2组的临床资料信息,进一步调阅胃癌患者的病史,通过查阅随访资料和电话等方式对患者进行随访,记录内容包括患者患病年龄、联系人及联系电话、性别、通讯地址、病理诊断、临床诊断等。
1.4 统计方法
选择SPSS 20.00软件进行分析,TNFR1、cyclin D1腺瘤性息肉与胃癌组织间表达差异的比较采用卡方分析检验,TNFR1、cyclin D1和患者临床病理资料间的关系采用卡方分析检验,相关性分析采用Spearman等级相关分析,检验水准为α=0.05。
2 结果
2.1 一般资料对比
在120例胃癌患者中,男性68例,女性52例;年龄35~83岁,平均年龄(54.22±12.49)岁;Dukes分期:A期+B期48例,C期+D期72例;淋巴结转移:有60例,无60例;分化程度:高分化60例,中分化40例,低分化20例;黏液癌:有20例,无100例;浸润深度:<肌层40例,≥肌层80例。
在120例腺瘤性息肉患者中,男性65例,女性55例;年龄32~84岁,平均年龄(54.11±9.78)岁。2组性别、年龄对比无显著差异(P>0.05)。
2.2 Cyclin D1及TNFR1表达对比
胃癌组织的Cyclin D1及TNFR1阳性表达率分别为75.0%和65.0%,腺瘤性息肉组织分别为3.3%和15.0%,差异有统计学意义(P<0.05)。见表1。
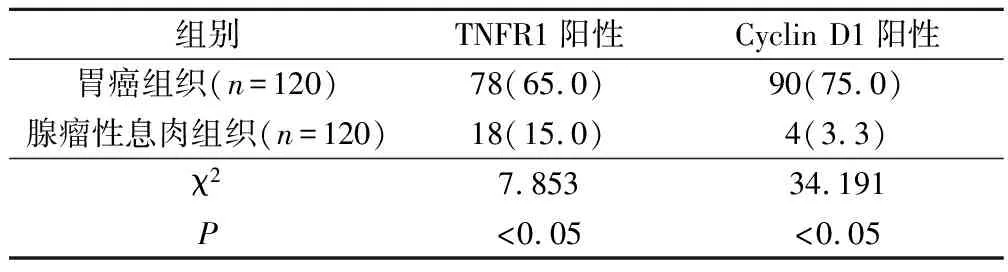
表1 胃癌与腺瘤性息肉组织的Cyclin D1及TNFR1阳性表达率对比(例,%)
2.3 Cyclin D1及TNFR1表达的相关性
120例胃癌组织中有75例Cyclin D1及TNFR1蛋白的表达同时呈阳性,腺瘤性息肉组织中只有3例同时呈阳性,Spearman等级相关分析显示Cyclin D1及TNFR1蛋白在胃癌中的表达呈正相关(γ=0.563,P=0.002)。
2.4 胃癌组织Cyclin D1及TNFR1表达与临床特征的相关性
Cyclin D1及TNFR1在胃癌组织中的阳性率与胃癌的浸润深度、淋巴结转移、黏液癌、Dukes分期呈正相关(P<0.05),与肿瘤的分化程度呈负相关(P<0.05)。见表2。
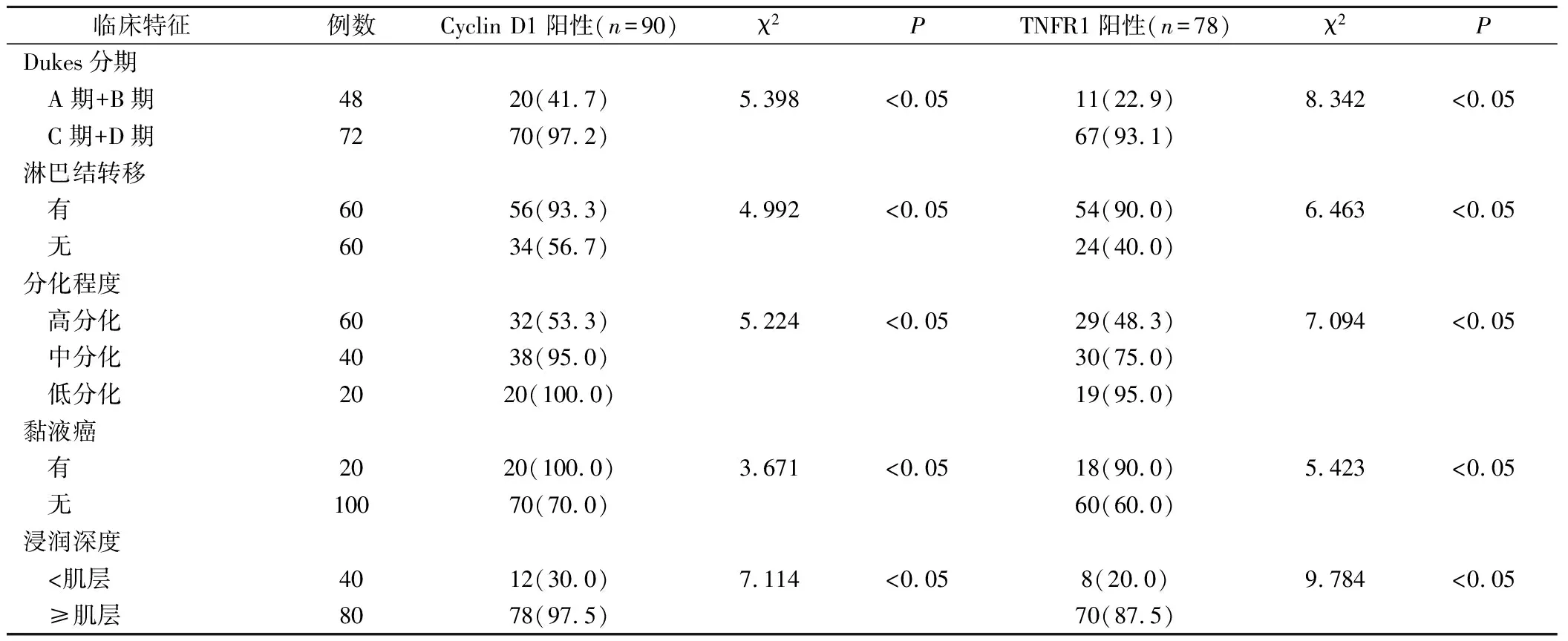
表2 胃癌组织Cyclin D1、TNFR1阳性表达率与临床特征的相关性(例,%)
3 讨论
胃癌的发生与发展是由多因子参与调控的复杂过程,早期症状不明显,多由腺瘤性息肉发展而来,病情发现时多为癌症中晚期,因此死亡率一直居高不下[11-12]。
目前胃癌与腺瘤性息肉发病机理尚未完全了解,与其它肿瘤一样,胃癌与腺瘤性息肉的发生归因于基因与环境的相互作用,正是这些基因多态影响或“修饰”不同个体对环境因素作用的敏感性[13]。不同基因的表达在息肉形成、癌变过程中的作用及其胃癌发生、发展之间的关系当前被广泛深入分析与研究[14]。
细胞周期调控紊乱是导致肿瘤发生的重要环节,Cyclin D1是细胞周期调控因子,是癌基因,有正性调节作用[15]。有研究表明cyclin D1随着胃黏膜病理变化加重,Cyclin D1阳性表达率显著增加[16]。TNFR1是分子量为55 kD的Ⅰ型跨膜糖蛋白,广泛分布于正常细胞膜与肿瘤细胞表面。TNFR1在引起细胞凋亡、抗肿瘤和抗病毒感染中发挥重要作用,也参与自身免疫性疾病[17]。本研究显示胃癌组织的Cyclin D1及TNFR1阳性表达率分别为75.0%和65.0%,腺瘤性息肉组织分别为3.3%和15.0%,对比有显著性差异(P<0.05);Spearman等级相关分析显示Cyclin D1及TNFR1蛋白在胃癌中的表达呈正相关(γ=0.563,P=0.002)。相关研究也表明TNFR1也可以介导细胞活化信号和增殖信号,诱导一氧化氮合成酶和白介素-8的活性,活化核转录因子和激活蛋白[18]。cyclin D1基因的扩增是重要的胃癌促发因素,可能发生在胃黏膜上皮癌变的早期阶段,可作为一个潜在的胃癌早期诊断分子标志物[19]。
生长在人体黏膜表面上的赘生物统称为息肉,也是指人体组织表面长出的多余肿物。腺瘤性息肉是胃癌的癌前状态之一,也决定着胃癌的发生与发展。cyclin D1基因既是细胞周期G1/S期转换的正向调节因子,也是G1期细胞增殖信号的关键蛋白[20]。临床研究表明在头颈部鳞状细胞癌、结直肠癌、肺癌、肝细胞癌、乳腺癌、食管癌等多种恶性肿瘤中存在cyclin D1基因扩增、重排及过表达[21-22]。
TNFR1引起的作用比较广,包括杀细胞活性、抗病毒活性等。本研究显示Cyclin D1及TNFR1在胃癌组织中的阳性率与胃癌的浸润深度、淋巴结转移、黏液癌、Dukes分期呈正相关(P<0.05),与肿瘤的分化程度呈负相关(P<0.05)。有研究表明在胃癌的不同分化程度上,Cyclin D1及TNFR1表达的差异均无统计学意义,但是Cyclin D1及TNFR1的表达呈正相关,提示两者在腺瘤性息肉与胃癌的发生中可能具有协同作用[23]。然而本研究也存在缺陷,没有在腺瘤性息肉与胃癌组织中针对Cyclin D1及TNFR1做动态的检测,将在下一步进行深入分析。
总之,Cyclin D1及TNFR1在腺瘤性息肉与胃癌中都呈现过表达状况,与腺瘤性息肉与胃癌的发生发展密切相关,两者的早期检测可为进一步提高胃癌的诊治水平提供思路。
