根施水杨酸对铅胁迫下小麦根系生长发育的影响
2019-03-05巴青松宋瑜龙张兰兰李桂萍傅兆麟
巴青松,宋瑜龙,张兰兰,李桂萍,刘 远,陈 楚,傅兆麟
(1.淮北师范大学生命科学学院,资源植物生物学安徽省重点实验室,安徽 淮北 235000;2.西北农林科技大学,旱区作物逆境生物学国家重点实验室, 陕西 杨凌 712100)
土壤重金属污染与防治已经成为国内外普遍关注的环境问题之一,2014 年 4 月 17 日国家环境保护部和国土资源部联合发布的《全国土壤污染状况调查公报》[1]显示,铅是土壤污染最严重、对作物危害最大的重金属元素之一。铅离子(Pb2+)进入土壤后直接被植物根系吸收,当其在植物体内累积到一定水平时,植物就会受到伤害。Pb2+胁迫导致内源激素紊乱[2],改变了很多代谢途径[3],限制了光合作用[4],显著抑制了植物地上和地下部的生长[5]。而且,Pb2+胁迫下植物在萌发期和出苗阶段死亡率较高,苗期也是植物对Pb2+胁迫反应的耐受性和敏感性的重要时期。因此,研究植物苗期对Pb2+胁迫的响应机理以及如何缓解Pb2+胁迫对植物的影响具有重要意义。
通过添加外源物质调控植物体内代谢是应对Pb2+胁迫对植物伤害的有效方法。水杨酸(SA)是信号传递分子,能够诱导植物对非生物胁迫产生一定的抗性[6],如提高植物的抗盐性[7]、抗旱性[8]、抗寒性[9]和抗热性[10];对重金属的抗性研究主要集中在镉[11]、镍[12]和铜胁迫[13],Pb2+胁迫下,根施SA对小麦幼苗根系生长发育的研究还少见报道。因此,本试验研究根施SA对Pb2+胁迫下小麦幼苗理化的生理影响,探究SA对提高小麦耐铅的生理机理,为SA应用于提高小麦耐铅性提供理论参考。
1 材料与方法
1.1 材料与试验设计
选取均匀、饱满的小麦品种‘轮选988’种子,0.1% HgCl2消毒后,蒸馏水浸泡24 h,平铺在放有滤纸的直径90 mm培养皿上,每个培养皿上30株。培养皿置于200 μmol·m-2·s-1光照强度、昼夜交替时间12 h/12 h 、25℃的培养箱中,每天加入适量蒸馏水进行培养。
培养7 d后进行第一轮试验,用50 mg·L-1Pb2+(在预试验中,此处理浓度是与蒸馏水对照相比幼苗根系长度大约减少一半的浓度;Pb 离子由Pb(NO3)2提供)分别与不同浓度(1,5,10,20,40,80,120,160,200 mg·L-1)SA混合液共20 mL处理小麦幼苗,以蒸馏水处理作为对照(CK),处理5 d后,每个重复选取30株测定小麦幼苗形态指标。根据试验结果,筛选出80 mg·L-1SA对50 mg·L-1Pb2+胁迫下小麦的生长恢复效果最好,被确定为最适的SA浓度。在第二轮实验中,分别以CK、Pb、SA和Pb+SA代表蒸馏水处理、50 mg·L-1Pb2+处理、80 mg·L-1SA和50 mg·L-1Pb2++80 mg·L-1SA,相同条件培养小麦幼苗,培养7 d后,设置CK、Pb、SA和Pb+SA处理,3次重复,处理9 d后,每个重复选取30株测定小麦幼苗形态与生理指标。
1.2 测定项目与方法
1.2.1 生长指标 随机取30株小麦幼苗,测定其株高、根长、单株根鲜重和单株根干重,重复3次。

1.3 数据分析
采用SPASS 19.0进行数据的单因素方差分析(one-way ANOVA)和显著性检验,利用Sigmaplot 10.0软件作图。
2 结果与分析
2.1 根施SA对Pb2+胁迫下小麦幼苗形态指标的影响
在Pb2+胁迫下,小麦幼苗形态指标发生了明显变化,植株和根系的生长受到了明显的抑制;然而,根施SA后,其形态指标得到了缓解,其株高,根长,株鲜重,株干重,根鲜重和根干重依次增加了17.67%,24.85%,23.46%,18.95%,18.69%和25.41%(表 1)。
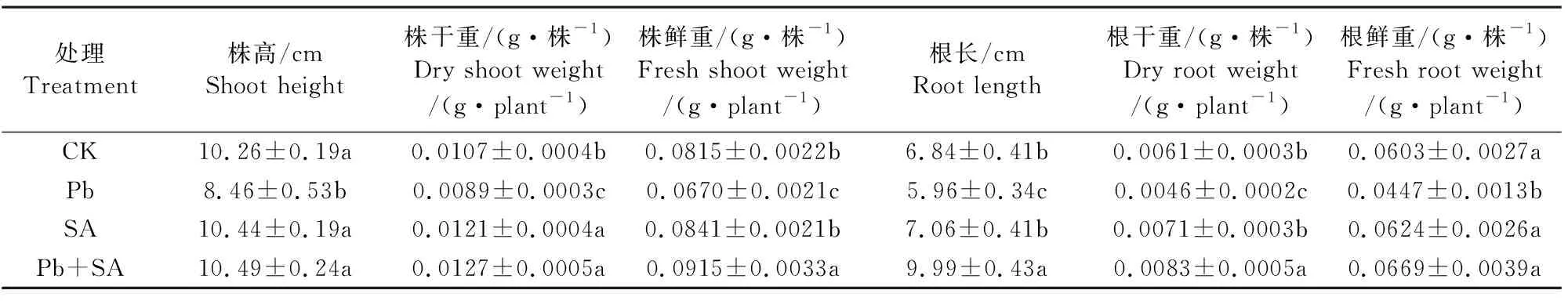
表1 根施SA对Pb2+胁迫下小麦幼苗形态指标的影响
注:不同字母表示处理间差异达显著水平(P<0.05),下同。
Note: Different letters indicate significant differences between treatments atP<0.05. The same below.
2.2 根施SA对 Pb2+胁迫下小麦根系保护酶SOD、POD、CAT和APX活性的影响

图2表明,与对照组(CK)相比,Pb处理组的POD活性降低了31.74%,SA处理组POD活性增加了34.37%;与 Pb处理组相比,SA+Pb处理组小麦幼苗根系POD活性上升了98.92%。因此,根施SA增强了Pb2+胁迫下小麦幼苗根系分解H2O2的能力。
图3表明, 与对照组(CK)相比,Pb处理组小麦根系的CAT活性降低了34.46%,而SA组小麦根系的CAT活性仅仅上升了0.34%;与 Pb处理组相比,SA+Pb处理组的小麦根系CAT活性上升了137.45%。

图1 外源SA对Pb2+胁迫下小麦根系SOD活性的影响 Fig.1 Effects of exogenous SA on SOD activities of wheat seedlings under Pb2+ stress
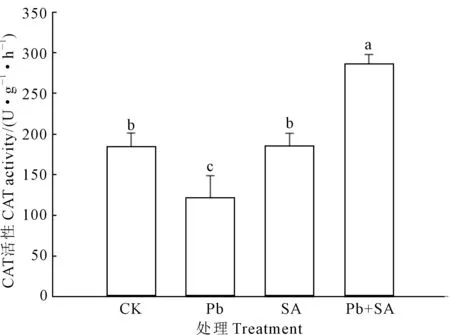
图3 根施SA对Pb2+胁迫下小麦根系CAT活性的影响 Fig.3 Effects of root applying SA on CAT activities of wheat seedlings under Pb2+ stress
图4表明,与对照组(CK)相比, Pb处理组小麦根系APX活性降低了29.07%,SA处理组小麦根系APX活性上升了311.63%;与Pb处理组比,SA+Pb处理组小麦根系APX活性提高了111.47%。
2.3 根施SA对Pb2+胁迫下小麦根系脯氨酸和可溶性糖含量的影响
图5表明,与对照组(CK)相比,Pb处理组Pro含量升高了31.25%,SA处理组小麦根系Pro含量升高了12.85%;与 Pb处理组相比,SA+Pb处理组Pro含量降低了40.11%。因此,根施SA通过增强小麦幼苗根系的渗透能力以缓解Pb2+胁迫的毒害。
植物细胞内的可溶性糖用来降低植物的细胞液凝固点,防止细胞液凝结成冰晶对植物造成伤害,起到保水作用。图6表明,与对照组(CK)相比Pb处理组可溶性糖含量降低了8.72%,而SA组可溶性糖含量却升高了18.59%;而与Pb处理组相比,SA+Pb处理组小麦根系的可溶性糖含量提高了13.59%。因此,根施SA提高了 Pb2+胁迫下小麦根系中可溶性糖含量,增强了渗透势,增加了保水能力,降低了Pb2+对小麦根系的毒害。

图2 外源SA对Pb2+胁迫下小麦根系POD活性的影响 Fig.2 Effects of exogenous SA on POD activities of wheat seedlings under Pb2+ stress

图4 根施SA对Pb2+胁迫下小麦根系APX活性的影响Fig.4 Effects of root applying SA on APX activities of wheat seedlings under Pb2+ stress
2.4 根施SA对Pb2+胁迫下小麦根系和MDA 含量的影响

图5 根施SA对Pb2+胁迫下小麦根系游离脯氨酸(Pro)含量的影响Fig.5 Effects of root applying SA on the contents of proline of wheat seedlings roots under Pb2+ stress

图6 根施SA对 Pb2+胁迫下小麦根系可溶性糖含量的影响Fig.6 Effects of root applying SA on the contents of soluble sugar of wheat seedlings roots under Pb2+ stress

图7 根施SA对 Pb2+胁迫下小麦幼苗根系超氧根阴离子的影响Fig.7 Effects of root applying SA on the contents of in roots of wheat seedlings under Pb2+ stress
H2O2具有很强的氧化性,其含量过多,对植物细胞造成危害。与对照组(CK)相比,Pb处理组的过氧化氢含量增加了43.73%;与Pb处理组相比,SA+Pb处理组根系的过氧化氢含量降低了28.99%(图 8)。
由图9可知,与对照组(CK)相比,Pb处理组丙二醛含量提高了13.81%,而SA处理组的MDA含量却降低了26.88%;与Pb处理组相比,SA+Pb处理组 MDA含量降低了16.78%。由此可见,根施SA降低了丙二醛含量,有效地缓解了 Pb2+胁迫造成的膜脂氧化作用。
2.5 根施SA对 Pb2+胁迫下小麦根系活力的影响
图10表明,与对照组(CK)相比,Pb处理组根系活力降低了53.63%,而SA处理组的根系活力却上升了17.79%;与 Pb处理组相比,SA+Pb处理组的根系活力提高了694.52%。由此可见,根施SA对 Pb2+胁迫的小麦根系具有促进作用。

图8 根施SA对 Pb2+胁迫下小麦幼苗根系过氧化氢含量的影响Fig.8 Effects of root applying SA on the contents of H2O2 in roots of wheat seedlings under Pb2+ stress
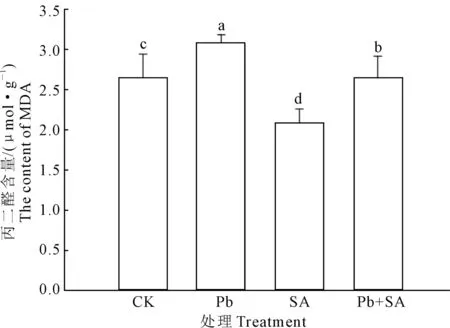
图9 根施SA 对Pb2+ 胁迫下小麦根系丙二醛的影响Fig.9 Effects of root applying SA on the contents of MDA in roots of wheat seedlings under Pb2+ stress

图10 根施SA对Pb2+胁迫下小麦幼苗根系活力的影响Fig.10 Effects of root applying SA on the root activity of wheat seedlings under Pb2+ stress
3 讨 论

细胞内脯氨酸变化是植物应对环境变化的一种适应性机制,脯氨酸在植物组织中可以作为酶保护剂从而减轻逆境胁迫对植物的不利影响。施用外源物质调控脯氨酸的生物合成, 能够增强植物在不利环境中的生存能力;同时,植物不同的信号分子互相影响调控逆境胁迫下的脯氨酸合成[26]。外源Ca2+能够诱导逆境胁迫植物组织脯氨酸积累[27],而且,Ca2+信号和SA信号存在偶联机制[28],SA、Ca2+单独作用或者共同作用都能明显提高植物组织脯氨酸的含量[29]。因此, SA可以通过增加脯氨酸含量来提高植物抗逆境胁迫的能力。研究发现, 外源 SA 能显著提高高温胁迫下葡萄幼苗脯氨酸的积累量,并降低丙二醛 MDA含量,提高葡萄的耐热性[30]。SA增强了氮和硫的同化作用,并提高了脯氨酸合成酶活性,促进了脯氨酸合成[31]。而且,外源SA增强了脯氨酸代谢中的Δ1-吡咯啉-5-羧酸还原酶(P5CR)活性及基因表达, 并抑制了其脯氨酸脱氢酶(ProDH)的活性,来促进脯氨酸的积累[32]。
可溶性糖也是植物细胞渗透调节的重要物质之一。当植物处于逆境时,植物通过增加可溶性糖的含量,增大其渗透势,增强其保水能力,保持酶分子的活性构象,以便维持正常生理代谢,增强植物的抗逆能力[33]。本试验表明,根施SA提高了Pb2+胁迫下小麦幼苗根系的脯氨酸和可溶性糖含量,增强了小麦幼苗的抗逆能力。因此,外源SA会增加细胞可溶性糖和游离氨基酸含量,继而发挥对植物细胞的渗透调节作用,通过这种方式,保持小麦幼苗在Pb2+逆境中的继续生长。
综上,Pb2+胁迫在一定程度上抑制了小麦幼苗根系的生长,而根施SA能在一定程度上缓解Pb2+胁迫,同时提高了抗氧化酶活性,有效地降低了活性氧水平,减少了膜脂过氧化程度,从而缓解了Pb2+胁迫对小麦幼苗的毒害,促进小麦幼苗正常的生理代谢功能。
