美国国家家禽改良计划标准程序(2014版)—细菌学检查程序(1)
2019-03-05译校顾小雪张倩张淼洁中国动物疫病预防控制中心
译校│顾小雪 张倩 张淼洁(中国动物疫病预防控制中心)
1 对环境中肠炎沙门氏菌呈阳性的蛋鸡和肉鸡种群进行细菌学检查的实验室推荐程序
环境监测后,从肠炎沙门氏菌阳性的蛋鸡和肉鸡种群中抽样进行细菌学检查,应按照本“方案标准”第2(a)节所述方法进行。

2 对家禽进行沙门氏菌细菌学检查的实验室推荐程序
(a)蛋鸡、肉鸡、火鸡、水禽、观赏用家禽和野禽。所有对鸡白痢-鸡伤寒试验有反应的禽类(至多25只)和来自于肠炎沙门氏菌阳性环境的禽类应根据本节第(a)(1)段的方法进行直接增菌培养和第(a)(2)段的方法进行选择性增菌培养,如果该鸡群中对鸡白痢-鸡伤寒试验有反应的鸡的数量超过四只,如《联邦法规汇编》所规定的,至少要将四只鸡提交给授权实验室做细菌学检查。采集所有组织样本时应采用严格的无菌操作技术。
(1)直接培养(参见图1)。对于大体正常或患病的肝脏、心脏、心包囊、脾脏、肺、肾、腹膜、胆囊、输卵管,畸形卵细胞或睾丸,发炎或未吸收的卵黄囊和其他肉眼可见的脓性、坏死性或增殖性病变的病理组织(包括囊肿、脓肿、眼前房积脓和发炎的浆膜表层),可用加热后的金属接种环或灭菌拭子取样做直接培养。由于某些菌株在某些选择性培养基中不一定能存活或生长,因此接种非选择性培养皿(如血液或营养琼脂)和选择性培养皿【如用于检测可疑鸡白痢沙门氏菌或鸡沙门氏菌的麦康凯琼脂平皿(MAC)和煌绿新生霉素平皿(BGN)以及用于检测肠炎沙门氏菌的MAC平皿、BGN平皿和木糖赖氨酸Tergitol 4平皿】。推荐的细菌学复苏和鉴定程序请参考图1。采集器官和组织后应立即进行选择性增菌培养。

◎图1 对肠炎沙门氏菌阳性环境的禽类和鸡白痢-鸡伤寒有反应的禽类的分离培养程序
(2)选择性增菌培养(参考图1)。器官样本的采集与培养应与肠道样本分别进行,最后采集肠组织防止交叉感染。应从如下器官或位置采集样本用于选择性增菌液培养: (i)心脏(如果存在的话,心尖、心包囊及内含物);(ii)肝脏(病变部位,或在大致正常的器官中,排空的胆囊和相邻肝脏组织);(iii)卵巢-睾丸(整个无活性的卵巢或睾丸,但如果卵巢有活性,则包括任何非典型卵细胞);(iv)输卵管(如果有活性,则包括任何碎屑和脱水的卵细胞);(v)肾脏和脾脏;(vi)其他肉眼可见的脓性、坏死性或增生性病变的病理部位。
(3)在无菌的环境下,从每一只家禽身上,采集10至15克本节第(a)(2)段中列出的任何器官或部位。绞碎、磨碎或混合并置于无菌自封袋中。从同一只家禽身上采集的本节第(a)(2)中列出的任何器官或部位样本可放在一个自封袋中。不要将不同家禽的样本混在一起。加入足量的四硫酸盐增菌液进行增菌,稀释比例为1∶10。在37℃~42℃下,将样本孵育20至24小时。按照图1中叙述的步骤分离和鉴定沙门氏菌。
(4)在无菌的环境下,从每一只家禽身上,采集10至15克消化道的不同部位,具体如下:嗉囊壁、十二指肠空肠(包括卵黄囊残余部分)、盲肠、盲肠扁桃体、直肠泄殖腔。绞碎、磨碎或混合各种组织,并将它们放在一个无菌自封袋中。不要将不同家禽的组织样本混在一起。加入足量的四硫酸盐增菌液进行增菌,稀释比例为1∶10。按照图1中叙述的步骤分离和鉴定沙门氏菌。
(5)选择性增菌后,接种选择性平皿(如用于检测鸡白痢沙门氏菌或鸡伤寒沙门氏菌的麦康凯琼脂平皿和煌绿新生霉素平皿,以及用于检测肠炎沙门氏菌的麦康凯琼脂平皿、煌绿新生霉素平皿和木糖赖氨酸Tergitol 4平皿)。将平皿置于37℃下孵育20至24小时。从该平皿中选择3至5个可疑沙门氏菌菌落接种三糖铁(TSI)和赖氨酸铁琼脂(LIA)斜面。如果经过24小时培养没有发现可疑菌落,则继续孵育平皿24小时,再判断其是否为阴性。按照图1中的流程,对菌落进行血清学(即血清群)和生物化学(例如,肠杆菌科鉴别系统[API])鉴定。
(6)如果初始的选择性增菌后,沙门氏菌呈阴性,则需采用延迟第二次增菌(DSE)程序。将富含四硫酸盐的样本在室温下放置5至7天。将1毫升培养液转移到含有10毫升新鲜四硫酸盐增菌液的试管中,并在37℃下孵育20~24小时。
(7)对所有分离菌株进行沙门氏菌血清群鉴定,并对所有D1群沙门氏菌进行血清型鉴定。对所有肠炎沙门氏菌分离菌进行噬菌体型鉴定。
3 从鸡舍环境样本、泄殖腔拭子和孵化室样本中采集、分离和鉴定沙门氏菌的程序
从养殖者那里获得与鸡舍布局和每个鸡舍中鸡只数量相关的信息,以确定应从每个鸡舍和每个鸡群采集的样本数量。应根据鸡舍来源提供每个样本的鉴定方法。运送采样人员的车辆应尽可能地远离禽舍。应遵循生物安全措施,包括使用已消毒的采样设备、无菌采样用品和做好个人清洁。采样前,工作人员应小心地用消毒皂清洗双手。前往不同的养殖场时,应更换包括手套在内的外衣,确保每次都穿着干净的衣物进入每个养殖场。无菌纱布的最小尺寸应为3×3英寸。
使用过的干净衣服和采样材料应分开放置。在进入不同养殖场前,应对靴子或鞋子进行清洁和消毒。每个养殖场都应提供一次性帽子或发网,且在使用后当场丢弃。采集好样本后,应避免干燥、光照和温度过高,并在一天内送往实验室。若递送延迟,应将样本放在冷藏环境中。
(a)蛋鸡和肉鸡、火鸡、水禽、观赏用禽和野禽。 本段所描述的所有样本和拭子均应按照图2进行培养。所有采集到的沙门氏菌均应按血清群或血清型进行分类。
(1)鸡舍环境样本。(i)粪便、垃圾或灰尘。用佩戴干净手套的手或无菌收集装置从代表鸡舍所有区域的几个位置收集粪便、垃圾或灰尘到无菌袋或容器中。在不超过500只鸡的鸡舍中,建议采集5个样本;在500至2500只鸡的鸡舍中,建议采集10个样本;在超过2500只鸡的鸡舍中,建议采集15个样本。
(ii)拖曳拭子(DS)。拖曳拭子由纱布垫或市售海绵组成,能够保证对鸡舍进行大面积的取样。
制备。用户既可以通过商业途径购买拖曳拭子,也可以自己制备。推荐一个制备拖曳拭子的方法:将无菌纱布片对折,用回形针、订书钉或类似的装置将一根2英尺(60厘米)长的麻绳牢牢地系在对折的纱布片上。用类似的方法将第二个无菌纱布片固定到一根5英尺(150厘米)长的麻绳上。然后将较短的麻绳和较长的麻绳系在一起,制成一个由两个拭子呈Y字形布置的拖曳拭子。或者,用户也可以制备两个独立的拖曳拭子取样器。将麻绳缠绕在拭子周围,拭子用双倍脱脂牛奶(DSSM)沾湿。将沾湿的拭子放在仪器箱中。装在该仪器箱中的无菌拭子在使用前都可进行冷冻保存,以防变干。
步骤。在养殖场解开解冻后的拖曳拭子,佩戴手套握紧麻绳末端。在鸡舍环境表面拖曳拭子15分钟或在整个鸡舍内(来回)拖曳。一组拭子(两片独立的纱布)从鸡舍内部的地板中央拖过,另一组拭子(两片独立的纱布)从鸡舍内部的地板周边拖过。四片纱布分别放在贴有标签的无菌袋中。如果需要防止干燥的话,可向袋内加入额外的双倍脱脂牛奶(浓缩的脱脂乳)。袋子应避免高温,尽快提交至授权实验室进行检测。如果样本不能在当天送至实验室,则在培养前,应将其保存在2至4℃,或放入装有冰块或冰袋的冷藏箱中,保存时间不得超过5天。
(iii)鞋套拭子。采用可吸收的布鞋套的原理,使鞋套的底部与地板垃圾和板条区域接触。戴上干净的手套,将鞋套套在仅在鸡舍内穿着的鞋子上。鞋子可以是鸡场专用鞋,也可以是一次性套鞋。工作人员穿着鞋套应以正常速度步行超过1000英尺(305米)。当鸡群中少于500只鸡时,在养鸡区域地板上取样时应至少准备1双鞋套。当鸡群中有500或更多只鸡时,在养鸡区域的地板上取样时应至少准备2双鞋套。采样后,将鞋套分别放进装有30毫升双倍脱脂牛奶的无菌容器中,若使用的是提前浸润的拭子则不用额外添加。封闭无菌容器,立即将它们放在2~4℃下冷藏,或放入装有冰块或冰袋的冷藏箱中。不要冷冻。培养前,样本在2~4℃冷藏不得超过5天。
(iv)产蛋箱或集蛋带拭子可作为替代样本。用两个无菌且提前浸湿(例如,用双倍脱脂牛奶)的纱布或海绵在产蛋箱内大约10%的区域进行擦拭。将每一个拭子或海绵放入单独的无菌袋中,并提交至授权实验室。
用两个无菌且提前浸湿(例如,用双倍脱脂牛奶)的纱布或海绵擦拭集蛋带。每一个拭子至少擦拭30英尺的集蛋带材料。将拭子分别放入单独的无菌袋中,并提交至授权实验室。
(2)泄殖腔拭子。应按照本节中描述的步骤,从鸡群或至少500只鸡中采集用于细菌学检验的泄殖腔拭子。采用正确的方法,将无菌棉签或拭子插入禽类泄殖腔和直肠中,采集粪便物质。可将棉签折断放入到无菌试管中。泄殖腔拭子可以按照5的倍数或授权实验室指定的规格进行组合。
(3)孵化室样本。可通过检查孵化室相关的样本,如小鸡箱纸、胎粪和绒毛,来确定是否存在沙门氏菌,从而判断沙门氏菌由母体传给后代的可能性。
(i)小鸡箱纸。授权代理人可根据本节第(a)(3)(i)段介绍的方法采集小鸡箱纸样本或 按照本节第(a)(3)(ii)段中的方法,直接交给授权实验室进行检测。在将小鸡箱放入孵化室前,将纸从小鸡箱中取出这一步非常重要。
小鸡箱纸采样说明。一栋鸡舍中,每10箱小鸡需采集一个小鸡箱纸样本。用消毒后和佩戴手套的双手将纸放在干净、无菌的表面上。用双倍脱脂牛奶将无菌纱布或海绵浸透,然后擦拭5个小鸡箱纸的表面。用纱布擦拭每一个箱纸样本75%以上的面积,并使劲擦掉所有干燥的胎粪。加入更多的双倍脱脂牛奶更有助于采样。用第2个拭子在另外5个小鸡箱纸上重复这一步骤。将这两个拭子放入同一个无菌且贴有标签的塑料袋中,并提交至授权实验室。立即将含有样本的Whirl-Pak采样袋用冰袋或其他制冷设备进行冷藏并在采样后5天内送往实验室培养。
(ii)本计划参与者可将小鸡箱纸直接提交到实验室,实验室将按照本节第(a)(3)(i)段描述的方法收集样本。将小鸡箱纸直接提交到实验室需要:
从放置在一栋鸡舍的每10个小鸡箱中采集1个小鸡箱纸,立即将小鸡箱纸放入大的塑料袋中,贴上标签并密封包装。
将含有小鸡箱纸的塑料采样袋放入一个干净的盒子中,并在48小时内将其运往实验室。塑料采样袋无需冷藏保存。
(iii)小鸡胎粪。采样后,将容器中的胎粪进行混合,以获得均匀的稠度。实验室将取出25克样本用于细菌学检验。
(ⅳ)绒毛。可以从孵化室地板上或孵化后的托盘中收集绒毛样本。可以用提前浸透的纱布或海绵擦拭地板或托盘来收集绒毛样本,或将绒毛材料直接放入无菌采样袋中。
(b)沙门氏菌的分离鉴定 。如本节所述(见图2),可通过两种增菌程序进行沙门氏菌的分离。或者可以采用快速方法来检测沙门氏菌,并对阳性样本进行细菌分离。
(1)直接用四硫酸盐增菌液増菌后用微量半固体氯化镁孔雀绿(MSRV)增菌。
(i)按照1∶10的比例(样品∶增菌液),将新鲜的四硫酸盐增菌液加入到样本中。37或42℃孵育20至24小时。
(ii)孵育后,将大约100微升(3滴)的增菌液(表面以下的)加入到微量半固体氯化镁孔雀绿平皿中。正面朝上, 42℃孵育24小时。
(iii)观察微量半固体氯化镁孔雀绿平皿,看是否存在从接种端转移过来的生长带。如果存在的话,将无菌接种环插入生长带的外缘,接种选择性琼脂平皿,如煌绿新生霉素平皿和XLT4平皿。
(iv)如果没有出现生长带,则将微量半固体氯化镁孔雀绿平皿放置在42℃环境下再孵育24小时。观察微量半固体氯化镁孔雀绿平皿,看是否存在从接种端转移过来的生长带。如果存在的话,将无菌接种环插入生长带的外缘,接种选择性琼脂平皿,如煌绿新生霉素平皿和XLT4平皿。如果还是没有出现生长带,将该接种环插入到接种端,并接种选择性琼脂平皿。这样以确保不漏检虚弱或无运动性的沙门氏菌菌株。
(v)将选择性琼脂平皿在37℃孵育20至24小时。观察平皿是否出现沙门氏菌疑似菌落。挑取3至5个菌落,分别接种三糖铁(TSI)和赖氨酸铁(LIA)琼脂斜面或其他类似的方法。37℃孵育20至24小时。按照图2中的血清学(即血清群)或生化(如API)程序筛选菌落。
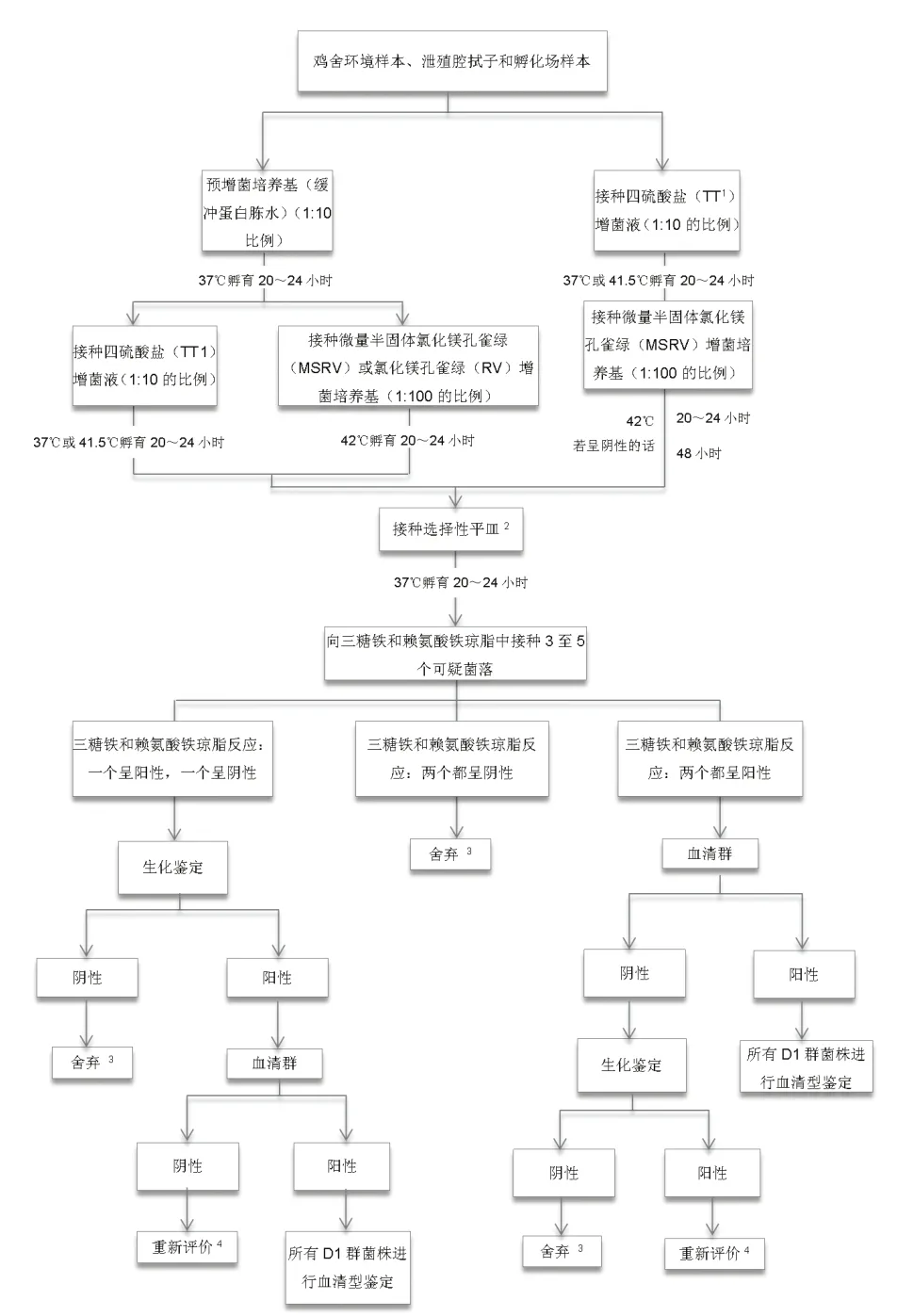
◎图2 鸡舍环境样本、泄殖腔拭子和孵化室样本培养流程
(vi)将所有鉴定为沙门氏菌的分离株按血清群进行分群,并将所有D群分离株进行血清型鉴定。对每个鸡群每次鉴定出的肠炎沙门氏菌进行噬菌体分型。
(2)预增菌后进行选择性增菌。(i)将预增菌液(如缓冲蛋白胨水,BPW)按1∶10的比例(样本∶增菌液)加入到样本中。37℃孵育20至24小时。(ii)将1毫升预增菌样本转移到含有10毫升四硫酸盐增菌液的培养管中,然后将0.1毫升转移到含有10毫升氯化镁孔雀绿增菌液的培养管或微量半固体氯化镁孔雀绿平皿中。42℃孵育20至24小时。(iii)孵育后,将四硫酸盐和氯化镁孔雀绿增菌液接种到不同的选择性琼脂平皿上,如煌绿新生霉素平皿和XLT4平皿。微量半固体氯化镁孔雀绿培养基接种后,按照(I)(iii)和(1)(iv)中的步骤进行。(iv)按照(I)(v)和(I)(vi)所述的方法,用选择性琼脂培养基筛选沙门氏菌。
(3)经认可的沙门氏菌快速检测方法。(i)根据《联邦法规汇编》规定,《美国国家家禽改良计划》可批准用沙门氏菌的快速检测方法。(ii)各种快速检测方法所用到的增菌和检测程序是经制造商推荐并由《国家家禽改良计划》批准。(iii)“分子检查程序”部分列出了批准的分子检查程序。(iv)经快速检测方法确定为阳性的样品,必须通过接种选择性培养基,如煌绿新生霉素平皿和XLT4平皿确证是否为沙门氏菌,接种液为鉴定过程中的增菌液。(v)遵循本节第(b)(1)(v)中的分离程序。
