长薄鳅恶臭假单胞菌的分离鉴定及其感染的病理损伤
2019-03-05白明焕邓龙君甘维熊黄小丽陈德芳欧阳萍赵若璇谌冰洁
白明焕,耿 毅,*,邓龙君,甘维熊,周 剑,黄小丽,陈德芳,欧阳萍,赵若璇,谌冰洁
(1.四川农业大学 动物医学院,四川 成都 611130; 2.雅砻江流域水电开发有限公司,四川 成都 610056; 3.四川省农业科学院 水产研究所,四川 成都 611731)
恶臭假单胞菌(Pseudomonasputida)属假单胞菌科(Pseudomonadaceae)、假单胞菌属(Pseudomonas),革兰阴性杆菌,广泛分布于土壤、水体中,是一种条件致病菌,可感染两栖类、鱼类和甲壳类等多种水生动物。现已有大鲵(Andriasdavidianus)[1]、欧洲鳗鲡(Anguillaanguilla)[2]、中华绒螯蟹(Eriocheirsinensis)[3]、条石鲷(Japaneseparrotfish)[4]、三疣梭子蟹(Portunustrituberculatus)[5]、罗氏沼虾(Macrobrachiumrosenbergiideman)[6]、黑鲷(Sparusmacrocephlus)[7]、杂交鲟(hybrid sturgeon)[8]、杂交鲇(hybrid catfish)[9]、大黄鱼(Larimichthyscrocea)[10]及虹鳟(Oncorhynchusmykiss)[11]等感染,并引起全身多器官出血、坏死,甚至死亡的报道。
长薄鳅(Leptobotiaelongata)为鲤形目(Cypriniformes)、鳅科(Cobitidae)、薄鳅属(Leptobotia)鱼类,俗名花鳅、红沙鳅钻等,是中国的特有物种,主要分布于长江宜宾江段及其临近水域。鱼体两侧有鲜艳的花斑,具有极高的观赏价值,同时其肉富含蛋白质、脂肪、必需氨基酸以及人体所需的钙磷等常量元素[12],是观赏和食用价值兼备的名贵鱼类。随着长江流域的过度捕捞以及大量水利工程的修建,导致长薄鳅的栖息地环境遭到破坏,其资源量和渔获量不断下降,已被列入《中国濒危动物红皮书》和《中国物种红色名录》。近年来,随着长薄鳅人工繁殖的成功,其养殖逐渐兴起,并被列为重要的增殖放流对象。2017年8月,四川省西昌市某养殖场的长薄鳅陆续出现发病死亡,主要表现为体表溃烂、出血等症状,为明确其病因,本研究从自然发病鱼体内进行了病原菌的分离,并通过表型特性测定、16S rRNA和gyrB基因序列分析确定其病原为恶臭假单胞菌(Pseudomonasputida),同时进行了病理损伤观察,以期为长薄鳅疾病的诊断和防控提供参考。
1 材料与方法
1.1 材料
患病鱼,体质量355.3~426.8 g,采自四川省西昌市某养殖场;健康鱼,体质量112.7~131.6 g,购于四川省宜宾市某养殖场。
1.2 主要试剂
LB培养基、细菌基因组提取试剂盒、药敏纸片、细菌生化微量鉴定管、PCR Master Mix、DL2000 DNA Marker、细菌基因组DNA提取试剂盒、PCR产物纯化试剂盒。
1.3 剖检变化与组织病理学观察
对病鱼进行系统解剖,对各组织、器官的病理损伤观察,并取鳃丝、鳍条以及体表黏液进行寄生虫检查。同时取患病鱼的心、肝、脾、肾等组织,4%的甲醛固定,脱水、透明、石蜡包埋、切片、HE染色,光学显微镜观察其组织学损伤。
1.4 病原菌分离及形态观察
无菌条件下,从病鱼的肝、脾与肾等取样,LB平板上画线,于28 ℃恒温培养24~48 h。挑取形状、大小、颜色均匀一致的优势单个菌落再次接种LB平板进行纯化培养,并观察菌落与细菌形态特征。获得纯化后的菌株4 ℃保存备用。
1.5 生理生化测定及药敏试验
生理生化特性采用微量生化法参照《常见细菌系统鉴定手册》[13]进行。药敏试验采用K-B法进行,将新鲜菌液用无菌棉签均匀涂布于MH平板,28 ℃培养24 h测定抑菌圈的直径并判定结果,敏感度根据杭州微生物试剂有限公司提供的标准进行判定。
1.6 人工感染试验
将分离菌接种于LB肉汤,28 ℃振荡培养24 h后用麦氏比浊法将菌液浓度调至3.0×108、3.0×107、3.0×106和3.0×105CFU·mL-1,健康长薄鳅于水温(20±1)℃中暂养7 d后,腹腔注射菌液0.2 mL·尾-1,每组20尾;对照组注射等量的生理盐水。接种后每天观察鱼的临床表现及死亡情况,试验期14 d。对感染后的病死鱼及时进行解剖,并进行细菌的分离鉴定。
1.7 16S rRNA和gyrB基因序列测定及系统进化分析
取对数生长期新鲜菌液,按照细菌基因组DNA提取试剂盒提取DNA。采用16S rRNA的通用引物[14]与gyrB基因的通用引物[15](表1)分别进行PCR扩增。PCR反应程序:95 ℃ 10 min;94 ℃ 2 min,55 ℃ 1 min,72 ℃ 1 min 30 s,共35次循环;最后,72 ℃延伸10 min。PCR扩增产物经1.5%的琼脂糖凝胶电泳检测,将纯化回收的PCR产物送成都擎科梓熙生物技术有限公司测序。将获得的分离菌16S rRNA与gyrB基因序列和已知GenBank数据库中进行Blast比对,使用MEGA 7.1用Neighbor-Joining法构建系统进化树。
表1细菌16S rRNA和gyrB基因引物序列
Table1Primer sequence of bacterial 16S rRNA andgyrBgene
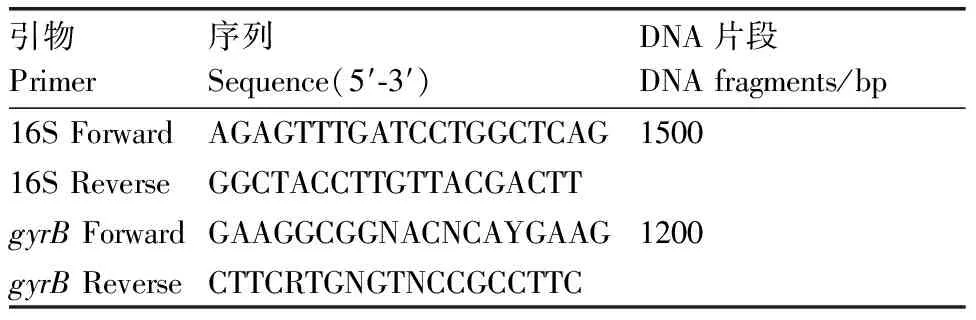
引物Primer序列Sequence(5′-3′)DNA片段DNA fragments/bp16S ForwardAGAGTTTGATCCTGGCTCAG150016S ReverseGGCTACCTTGTTACGACTTgyrB ForwardGAAGGCGGNACNCAYGAAG1200gyrB ReverseCTTCRTGNGTNCCGCCTTC
2 结果与分析
2.1 临床症状与剖检变化
发病长薄鳅表现为食欲不振,游动缓慢,常浮于水面。病鱼的鳃盖边缘及胸鳍基部出血及溃疡灶,胸腹部点状出血,体表尤其是尾部见大小不等的溃烂,病程长的病例在溃疡灶可见水霉着生(图1-A)。剖检见鳃丝充血、肿胀,呈深红色;肝淤血、肿大,质脆,呈花斑状(图1-B),脾与肾肿大,呈暗红色;胃肠道空虚,肠腔内充有较多的黏液。鳃丝压片与体表黏液涂片镜检,未发现寄生虫。
2.2 病原菌分离及形态观察
从发病长薄鳅肝、肾与脾内分离获得3株优势菌(BMH170819、BMH170820、BMH170821),28 ℃培养24 h后,在LB培养基上形成表面湿润光滑,微隆起,边缘整齐,直径1.5~2.5 mm的淡黄色半透明的菌落。3株菌经革兰氏染色均呈G-杆菌,大小为0.5~1.0 μm×1.5~4.0 μm(图2)。
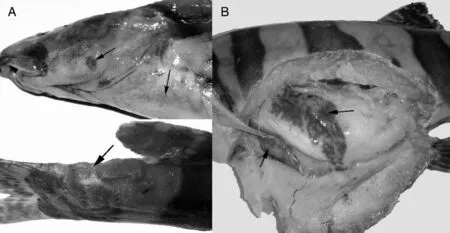
A,鳃盖边缘溃疡,胸鳍基部与胸部出血;B,肝淤血,肿大。A, Ulcers were on the edge of the operculum and punctate hemorrhage were at the base of the pectoral fin and the breast; B, Congestion and swelling of liver.图1 患病长薄鳅的剖检变化Fig.1 Gross lesions of diseased Leptobotia elongate
2.3 分离菌生理生化特性及药敏试验
分离菌的主要生理生化特性见表2,3株分离菌的主要生化特性相同且与恶臭假单胞菌(Pseudomonasputida)的生理生化特性基本一致,初步判定其为P.putida。药敏试验发现,3株菌均对新霉素、庆大霉素、四环素、诺氟沙星、强力霉素等敏感,对氨苄西林、阿莫西林、林可霉素、氟苯尼考、克林霉素等耐药,详见表3。

图2 分离株革兰氏染色形态Fig.2 Micrograph of strain in Gram staining
2.4 分离菌人工感染试验
由于3株分离菌的生理生化特性及药物敏感性完全一致,故选其中一株(BMH170820)进行人工感染试验。攻毒24 h后,细菌浓度为3.0×108、3.0×107CFU·mL-1试验组的长薄鳅出现采食量下降、游动无力等临床症状,浓度为3.0×106、3.0×105CFU·mL-1的长薄鳅陆续从注射后的3~4 d开始出现临床症状。随着病情的发展,发病长薄鳅的体表开始出现出血点、溃疡、烂斑、鳍条出血等。浓度为3.0×108CFU·mL-1的试验组,从第3天开始出现死亡,其余组则在感染后4~5 d开始出现死亡,到试验结束时,各感染组的死亡率分别为85%、65%、30%和10%;而对照组的长薄鳅在试验期间无异常。从人工感染发病死亡的长薄鳅体内再次分离细菌,获得与感染接种菌形态、理化特性及16S rRNA基因序列一致的菌株。
2.5 16S rRNA和gyrB基因序列测定及系统进化分析
采用扩增16S rRNA基因和gyrB基因的通用引物,分别扩增得到1 500、1 200 bp的片段,纯化测序后将序列提交NCBI获得GenBank登录号分别为MH155971和MH396435。将获得的16S rRNA和gyrB基因序列与GenBank中已有的序列进行Blast比对,结果显示,菌株BMH170820与数据库中的恶臭假单胞菌同源性最高。在基于分离菌的16S rRNA和gyrB序列与GenBank中已有的假单胞菌属细菌16S rRNA及gyrB基因序列建立的系统进化树上(图3),该分离菌株与P.putida聚为一族。
表2分离株BMH170819-BMH170821生理生化特性
Table2Biochemical and physiological characteristics of isolated strain BMH170819-BMH170821

试验项目ItemsBMH170819-BMH170821P. putida[13]P. putida[9]运动性 Motility++N/A精氨酸双水解酶 Arginine dihydrolase+++鸟氨酸脱羧酶 Ornithine decarboxyla---赖氨酸脱羧酶 Lysin decarboxylase---接触酶 Catalase++N/A脲酶 Urease--+氧化酶 Oxidase+++H2S 产生 H2S production---柠檬酸盐 Citrate+++吲哚反应 Indole test---甘露醇Mannitol---明胶 Gelatin---硝酸盐还原 Nitrate reduction+++V-P 试验 V-P test---半乳糖ONPG-N/A-葡萄糖产气 Glucose gas--N/A甲基红 Methyl red---麦芽糖 Maltose---木糖 Xylose--+果糖 Fructose++N/A
+,阳性反应;-,阴性反应;N/A,未测定。
+, Positive; -, Negative; N/A, No determination.
表3分离株BMH170819-BMH170821的药敏试验结果
Table3Antibiotics sensitivities of the isolated strain BMH170819-BMH170821
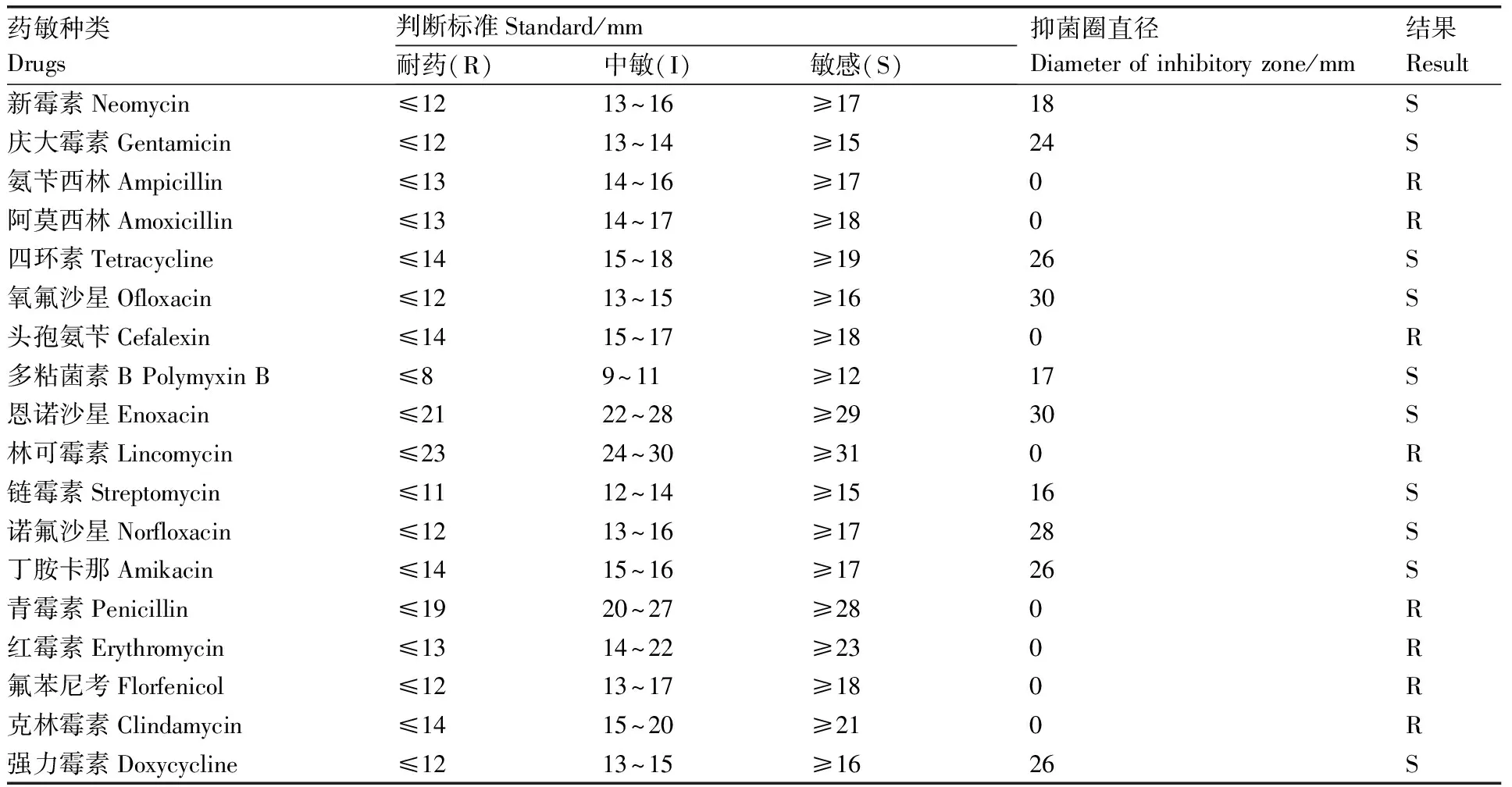
药敏种类Drugs判断标准Standard/mm耐药(R)中敏(I)敏感(S)抑菌圈直径Diameter of inhibitory zone/mm结果Result新霉素Neomycin≤1213~16≥1718S庆大霉素Gentamicin≤1213~14≥1524S氨苄西林Ampicillin≤1314~16≥170R阿莫西林Amoxicillin≤1314~17≥180R四环素Tetracycline≤1415~18≥1926S氧氟沙星Ofloxacin≤1213~15≥1630S头孢氨苄Cefalexin≤1415~17≥180R多粘菌素B Polymyxin B≤89~11≥1217S恩诺沙星Enoxacin≤2122~28≥2930S林可霉素Lincomycin≤2324~30≥310R链霉素Streptomycin≤1112~14≥1516S诺氟沙星Norfloxacin≤1213~16≥1728S丁胺卡那Amikacin≤1415~16≥1726S青霉素Penicillin≤1920~27≥280R红霉素Erythromycin≤1314~22≥230R氟苯尼考Florfenicol≤1213~17≥180R克林霉素Clindamycin≤1415~20≥210R强力霉素Doxycycline≤1213~15≥1626S
S,敏感;I,中度敏感;R,耐药。
S, Sensitive; I, Moderately sensitive; R, Resistant.
2.6 组织病理损伤观察
肝窦淤血,肝细胞索排列紊乱,肝细胞颗粒变性,细胞体积显著增大,胞浆淡染,局部肝细胞空泡变性(图4-A);鳃小片上皮细胞坏死并脱落,鳃小片间有大量淡红染的渗出物与炎症细胞(图4-B);肠道黏膜上皮细胞坏死脱落,碎片散落于肠腔(图4-C),固有膜内炎症细胞浸润;心肌纤维排列紊乱,横纹消失,颗粒变性,甚至溶解坏死,肌间隙内炎症细胞浸润(图4-D);脾脏明显淤血、出血,黑色素巨噬细胞中心扩大,数量增多,淋巴细胞显著减少,大量黄铁血黄素沉着(图4-E);肾小管上皮细胞颗粒变性,甚至坏死,管腔内见均质红染的蛋白或脱落的上皮细胞形成的管型,肾间质大量淋巴细胞、巨噬细胞与中性白细胞浸润(图4-F)。
3 讨论
假单胞菌属(Pseudomonas)细菌广泛分布于土壤、淡水、海水中,其中的部分种类对水生动物的致病性逐步被发现,已有荧光假单胞菌(Pseudomonasfluorescens)感染锦鲤[16]、鳜[17],铜绿假单胞菌(Pseudomonasaeruginosa)感染河豚[18],恶臭假单胞菌感染杂交鲟[8]、杂交鲇[9]、大黄鱼[10, 19]以及三疣梭子蟹[5]等的报道,尤其是恶臭假单胞菌具有较为广泛的感染宿主,已受到人们的高度关注。长薄鳅作为我国特有的濒危物种,其保护与开发受到了社会的高度重视,相继开展了驯化、人工繁殖与养殖等研究与实践工作,但对于其疾病的研究还相当缺乏。本研究从患病长薄鳅体内分离出菌株BMH170820,经人工感染确定该分离菌的病原性,并通过16S rRNA和gyrB基因测序分析,结合菌落和细菌形态以及生理生化特性鉴定其为恶臭假单胞菌。由此可见,恶臭假单胞菌自然情况下也可感染长薄鳅致死亡,因此,在长薄鳅的养殖中应重视该病的危害。
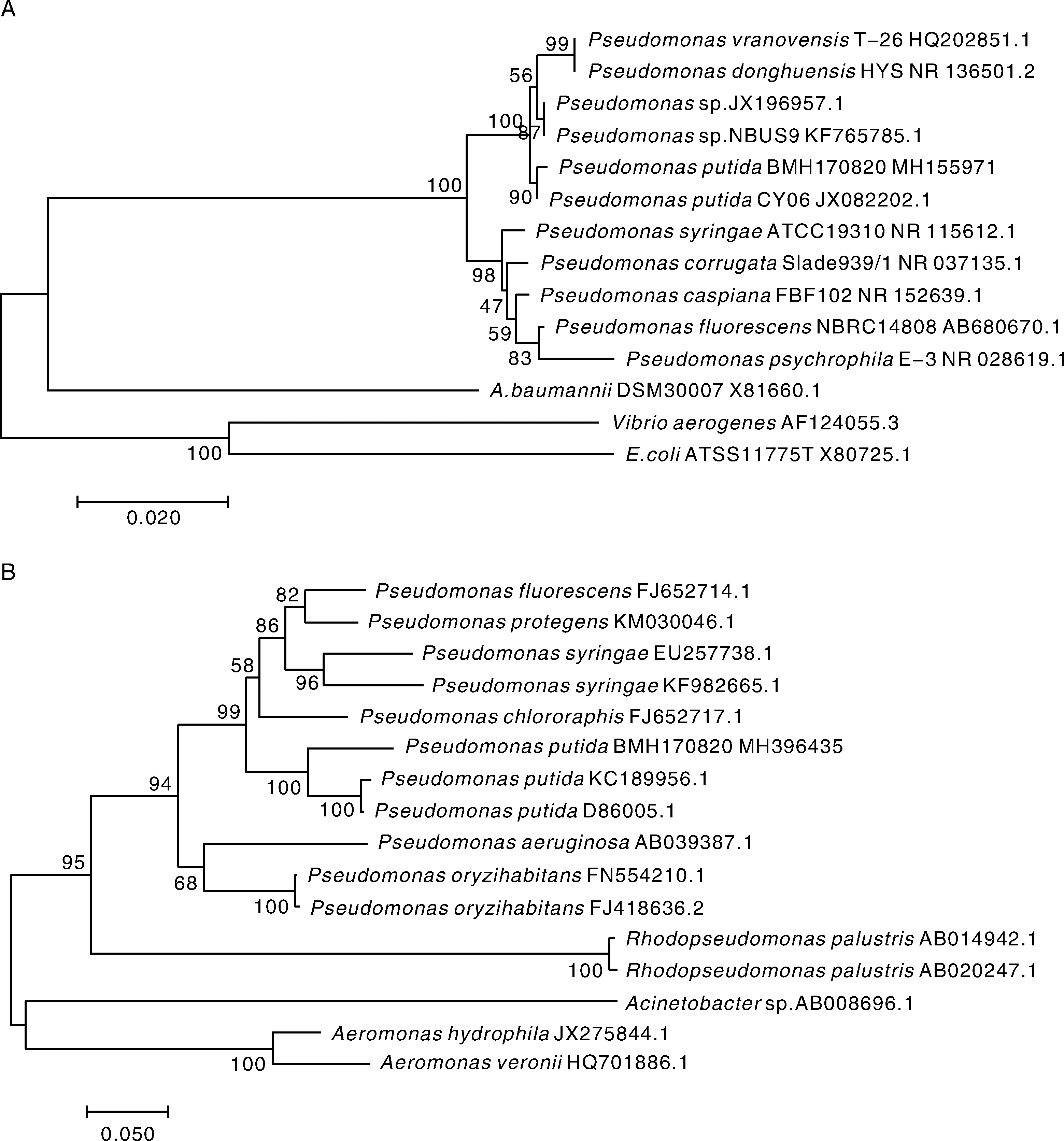
图3 基于16S rRNA基因序列(A)与gyrB基因序列(B)构建的菌株BMH170820与相关菌株的系统发育树Fig.3 Phylogenetic trees based on 16S rRNA (A) and gyrB gene (B) sequence of the isolated strain BMH170820 and other related species in Pseudomonas genus
据报道,欧洲鳗鲡[2]和罗氏沼虾[6]感染时病变主要集中在鳃,表现为鳃丝溃烂;中华绒螯蟹[3]感染时主要表现为脚爪无力,容易脱落;而三疣梭子蟹[5]感染时表现为内脏和肌肉组织溶解为乳白色的液体;以及黑鲷[7]和杂交鲟[8]主要表现为肠炎等。本研究中恶臭假单胞菌感染长薄鳅主要表现为体表溃疡、出血,以及对肝、脾、肾,鳃和心等多组织器官的损伤。可见,恶臭假单胞菌感染不同的宿主可能具有不同的临床特征与病理损伤特点,造成这种差异的原因是与宿主种属特性有关,还是与菌株的差异有关值得进一步研究。此外,该菌对人体的感染率也呈上升趋势,能引起葡萄球菌样烫伤性皮肤综合征[20]、败血症[21]、食物中毒[22-23]、伤口感染[24-25]等。因此,恶臭假单胞菌不仅对水产养殖危害严重,而且对人类健康也构成威胁,应给予高度重视。
随着抗生素的广泛应用,恶臭假单胞菌的耐药率也有上升的趋势,耐药菌株感染也越来越多,给治疗带来困难[26-27]。本研究中发现,从长薄鳅分离到的恶臭假单胞菌(BMH170820)对四环素、氧氟沙星、恩诺沙星以及强力霉素等10种抗生素敏感,对氟苯尼考、阿莫西林、头孢氨苄、林可霉素等8种抗生素耐药。这与杨圆圆等[8]报道杂交鲟源恶臭假单胞菌对氟苯尼考敏感;毛芝娟等[7]报道黑鲷源恶臭假单胞菌对氧氟沙星耐药;Holmgaard等[28]报道人源恶臭假单胞菌对强力霉素耐药的结果存在较大的差异。此外,Holmgaard等[28]还报道,从丹麦分离的人源恶臭假单胞菌具有包括β-内酰胺类、氨基糖苷类、四环素类等6种耐药基因,Peter等[29]也证实韩国分离的不同菌株间的耐药基因存在差异,这表明不同菌株间存在耐药性差异。因此,临床用药应根据药物敏感性试验结果选择用药,以避免药物的滥用。另外,由于疾病发生除了病原因素之外,还与环境、机体等因素有关,因此,有必要开展恶臭假单胞菌感染相关的环境风险因素的研究,以明确不同环境因子在发病风险中的作用,为养殖过程通过环境调控降低该病的发生风险提供依据。人类医学已发现,恶臭假单胞菌的感染往往与机体的免疫力低下相关,因此,在长薄鳅的养殖过程适时使用微生态制剂与免疫增强剂,改善正常菌群[30],调节免疫系统,增强动物抵抗力[31]也可能是防控该菌感染的重要策略。
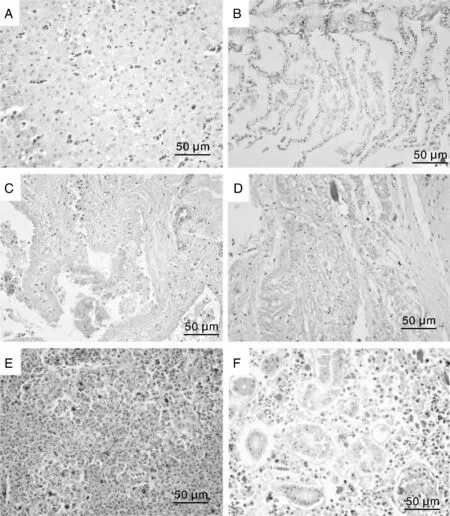
A,肝细胞颗粒变性,空泡变性;B,鳃小片上皮细胞坏死、脱落,炎症细胞浸润;C,肠黏膜上皮细胞坏死,脱落;D,心肌纤维变性,坏死,溶解;E,脾出血,淋巴细胞减少;F,肾小管上皮细胞变性,坏死,间质炎症细胞浸润。A, Granular and vacuolar degeneration in hepatocytes; B, Epithelial necrosis and abscission of the lamellae along with infiltration of inflammatory cells; C, Epithelial necrosis and abscission in intestinal mucosa; D, Degeneration, necrosis and myolysis of myocardial fiber; E, Hemorrhage and lymphocytopenia in spleen; F, Degeneration and necrosis in renal tubular epithelia and inflammatory cell infiltration of renal interstitium.图4 感染恶臭假单胞菌长薄鳅的组织病理学损伤(HE)Fig.4 Histopathological lesions of Leptobotia elongate infected by P. putida(HE)
