多菌种联合发酵饲料对肉鸡抗沙门氏菌感染能力的影响
2019-03-05刘江英朱建津刘子微
刘江英,朱建津,*,蒋 蓉,刘子微
(1.江南大学 食品学院,江苏 无锡 214122; 2.无锡三智生物科技有限公司,江苏 无锡 214115)
沙门氏菌是一种常见的人畜共患病原菌,其传播的主要媒介为家禽及其肉蛋类,并随着食物链进入人体,给人类及畜禽养殖带来巨大损失[1-2]。目前,主要应用药物来控制和预防家禽沙门氏菌感染,随着抗生素的滥用,沙门氏菌的耐药性逐渐增强[3],寻找新的预防沙门氏菌感染、增强动物防御能力的物质迫在眉睫。已有研究表明,多菌种联合发酵饲料能够提高动物肠道健康水平,饲料经益生菌发酵后,含有的益生菌和代谢产物短链脂肪酸(SCFA)被证实能够有效阻止革兰氏阴性菌在肠道定植[4-5]。本试验预先给肉鸡饲喂发酵饲料,随后进行沙门氏菌感染试验,旨在研究多菌种联合发酵饲料对肉鸡抗沙门氏菌感染能力的影响。
1 材料与方法
1.1 材料
1.1.1 仪器
BioTek Epoch全波长酶标仪(美国BioTek公司);7900HT Fast RT-PCR仪(美国ABI公司);石蜡组织切片机(德国Leica公司)。
1.1.2 试剂
乳酸菌菌液(由植物乳杆菌、嗜酸乳杆菌、粪肠球菌组成,菌落总数≥5×108CFU·mL-1)、芽孢杆菌和酵母菌混合菌粉(由地衣芽孢杆菌、枯草芽孢杆菌、酿酒酵母菌组成,芽孢杆菌菌落总数≥5×108CFU·g-1,酿酒酵母菌菌落总数≥5×107CFU·g-1),无锡三智生物科技有限公司;酸性蛋白酶(酶活≥50 000 U·g-1),杭州保安康生物技术有限公司;肠炎沙门氏菌24119,中国工业微生物菌种保藏管理中心;白细胞介素-1β(IL-1β)白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)、内毒素(lipopolysaccharide,LPS)及D-乳酸(D-LA)Elisa试剂盒,厦门慧嘉生物科技有限公司;RT-PCR相关试剂,美国Thermo Scientific公司;SYBR Green Master Mix,南京诺唯赞生物科技有限公司;基因引物,上海睿迪生物科技有限公司。
1.1.3 试验动物
1日龄中速黄羽肉鸡(35.78±4.03)g 50只,购自丽水市绿园种鸡场,经动物卫生监督所检验合格。
1.2 试验设计
1.2.1 多菌种联合发酵饲料的制备
使用密封袋进行小包饲料的简易发酵。将发酵底物玉米、麸皮、豆粕经粉碎,过40目筛,按4∶3∶3比例混合,取1 kg混合物加1 g芽孢杆菌和酵母菌混合菌粉、30 mL乳酸菌菌液、0.4 g酸性蛋白酶及经暴晒后的自来水1 000 mL,混合均匀装袋,挤压排气后置于35 ℃恒温培养箱中,发酵9 d后取样备用。
1.2.2 动物试验
将50只1日龄中速黄羽肉鸡随机分为5个处理组,对照组、模型对照组饲喂基础饲粮(基础日粮+10%未发酵饲料),抗生素对照组在基础饲粮中添加20 mg·kg-1硫酸粘杆菌素,5%发酵组、10%发酵组分别用5%、10%发酵饲料替代基础饲粮中的未发酵饲料。肉鸡13日龄时,对照组连续2 d口腔灌服400 μL无菌水,其他组连续2 d口腔灌服400 μL沙门氏菌液(1×109CFU·mL-1)。肉鸡15日龄时进行屠宰取样。试验肉鸡以处理为单位进行圈养,采用群饲,自由采食和饮水,不接种疫苗。基础日粮配方见表1。
1.3 样本采集
饲养结束时,颈静脉取血,4 ℃放置30 min后离心,移取上层血清,分装后保存于-80 ℃冰箱中待测。取结肠黏膜组织匀浆后,离心取上清液,分装后保存于-80 ℃冰箱中。取2 cm左右肉鸡结肠组织,用0.1 mol·L-1、pH 7.3的磷酸缓冲液洗净内容物后,放入4%甲醛固定液,4 ℃保存。刮取结肠黏膜组织0.1 g迅速浸入已放有Trizol的灭酶EP管中,匀浆后-80 ℃冻存备用。
1.4 测定指标及方法
1.4.1 结肠形态
制作结肠组织切片,苏木素伊红(HE)染色后封片,用光学显微镜由低倍到高倍观察。
1.4.2 血清炎症因子、LPS、D-LA的测定
按照试剂盒说明书测定血清炎症因子(IL-1β、IL-6、TNF-α)、血清LPS及D-LA水平。
1.4.3 结肠黏膜组织总RNA的提取
采用Trizol法提取结肠黏膜组织的总RNA,用1%琼脂糖凝胶电泳检测总RNA质量,参考文献[6]进行RNA反转录。
1.4.4 TLR4信号通路中关键信号分子
采用RT-PCR法测定TLR4信号通路的关键信号分子TLR4、MyD88、TRAF6、NF-κB的基因表达。反应体系为10 μL: SYBR Green Master Mix 5 μL,上下游引物各0.4 μL,cDNA 0.5 μL,DEPC水3.7 μL。PCR反应程序为:95 ℃预变性5 min;95 ℃ 20 s、60 ℃ 30 s,40个循环;72 ℃延伸2 min。引物序列见表2。以β-actin为内参,2-△△Ct法计算基因的相对表达量。
2 结果与分析
2.1 多菌种联合发酵饲料对沙门氏菌感染肉鸡血清促炎性细胞因子水平的影响
如图1所示,沙门氏菌感染显著(P<0.05)提高了肉鸡血清中IL-1β、IL-6和TNF-α水平,饲粮中添加20 mg·kg-1硫酸粘杆菌素或发酵饲料,与模型对照组相比,血清中IL-1β、IL-6和TNF-α水平均显著降低(P<0.05)。饲粮中添加10%发酵饲料,肉鸡血清中IL-1β水平显著(P<0.05)低于添加5%发酵饲料组和抗生素组,IL-6、TNF-α水平与这2个处理差异(P>0.05)不显著。饲粮中添加多菌种联合发酵饲料能有效降低血清中促炎因子水平,添加10%发酵饲料的改善效果与添加20 mg·kg-1硫酸粘杆菌素的效果接近。
表1基础饲量组成及营养水平(风干基础)
Table1Composition and nutrition level of basal diet(air-dry basis)

原料 Ingredients含量 Content/%营养水平 Nutrient levels含量Content2)玉米 Corn60.2代谢能Metabolism energy/(MJ·kg-1)12.13 鱼粉 Fish meal2.0粗蛋白质 Crude protein/%20.00 干酒糟及其可溶物 DDGS2.0赖氨酸 Lys/%1.25豆粕 Soybean meal30.0蛋氨酸+胱氨酸 Met+Cys/%0.87豆油 Soybean1.5苏氨酸 Thr/%0.83磷酸氢钙 CaHPO41.5色氨酸 Trp/%0.26碳酸钙 CaCO31.5钙 Ca/%1.02食盐 Salt0.3有效磷Virtual phosphorus/%0.45预混料 Premix1)1.0合计 Total100.0
1)预混料为每kg饲量提供Fe 66.5 mg(FeSO4·H2O),Zn 88 mg(Zn SO4·7 H2O),Mn 110 mg(MnSO4· H2O),I 0.7 mg(CaI2),Se 0.288 mg(Na2SeO3),Cu: 8.8 mg(CuSO4·5H2O),VA11 500 IU,VB13.38 mg,VB29 mg,VD33 500 IU,VE30 mg,VK35 mg,泛酸钙 13 mg,VB68.96 mg,氯化胆碱 800 mg,VB120.025 mg,烟酸 45 mg,生物素 0.08 mg,叶酸 1.20 mg。2)以上均为计算值。
1)The premix provided the following for per kg of diets: Fe 66.5 mg(FeSO4·H2O),Zn 88 mg(Zn SO4·7 H2O),Mn 110 mg(MnSO4· H2O),I 0.7 mg(CaI2),Se 0.288 mg(Na2SeO3),Cu: 8.8 mg(CuSO4·5H2O),VA11 500 IU,VB13.38 mg,VB29 mg,VD33 500 IU,VE30 mg,VK35 mg,Calcium pantothenate 13 mg,VB68.96 mg,choline chloride 800 mg,VB120.025 mg,niacin 45 mg,biotin 0.08 mg,folic acid 1.20 mg. 2)These are all calculated values.
表2基因序列(16s rRNA)
Table2Sequences of primers (16s rRNA)
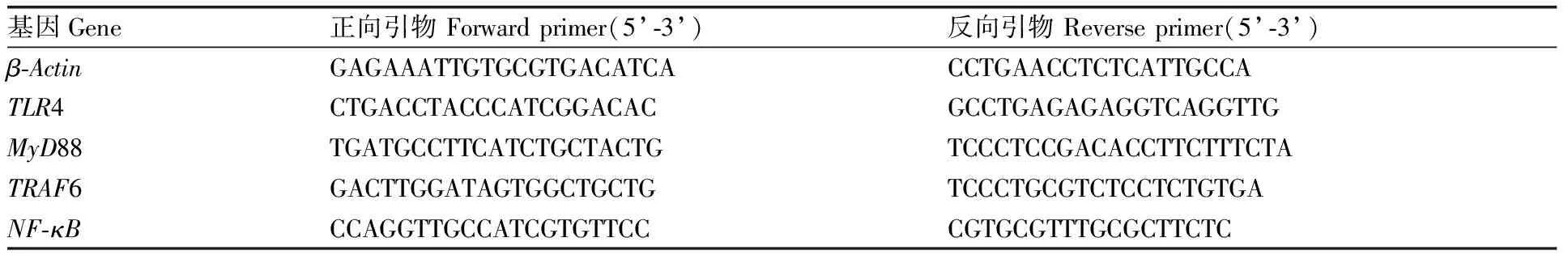
基因Gene正向引物 Forward primer(5’-3’)反向引物 Reverse primer(5’-3’)β-ActinGAGAAATTGTGCGTGACATCACCTGAACCTCTCATTGCCATLR4CTGACCTACCCATCGGACACGCCTGAGAGAGGTCAGGTTGMyD88TGATGCCTTCATCTGCTACTGTCCCTCCGACACCTTCTTTCTATRAF6GACTTGGATAGTGGCTGCTGTCCCTGCGTCTCCTCTGTGANF-κBCCAGGTTGCCATCGTGTTCCCGTGCGTTTGCGCTTCTC
2.2 TLR4信号通路关键信号分子的基因表达
如图2所示,模型对照组的TLR4、MyB88、TRAF6、NF-κB mRNA相对表达量均较对照组显著上升(P<0.05)。抗生素组MyD88、NF-κB mRNA表达显著(P<0.05)低于模型对照组;5%发酵组和10%发酵组TLR4、MyB88mRNA表达量显著(P<0.05)低于模型对照组和抗生素对照组。饲粮中添加多菌种联合发酵饲料能够下调TLR4信号通路关键分子mRNA表达,且效果总体上优于硫酸粘杆菌素。
2.3 多菌种联合发酵饲料对沙门氏菌感染肉鸡结肠形态的影响
如图3所示,肉鸡感染沙门氏菌后,结肠肠道绒毛排列稀疏,肿胀明显,空泡数量较对照组明显增多。抗生素和多菌种联合发酵饲料可缓解沙门氏菌对结肠肠道形态的损伤。
2.4 多菌种联合发酵饲料对沙门氏菌感染肉鸡肠道屏障功能的影响
如图4所示,肉鸡感染沙门氏菌后,血清中LPS、D-LA水平显著(P<0.05)上升,表明沙门氏菌的入侵导致肉鸡肠道屏障功能受损。饲料中添加硫酸粘杆菌素、10%发酵饲料后,与模型对照组相比,LPS、D-LA水平显著(P<0.05)降低。与模型对照组相比,添加5%发酵饲料可显著(P<0.05)降低血清中LPS水平。
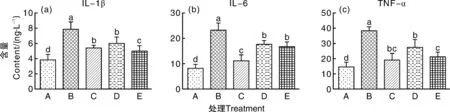
A,对照组;B,模型对照组;C抗生素对照组;D,5%发酵组;E,10%发酵组。柱上无相同字母表示存在显著性差异(P<0.05),下同。A, control group;B, model control group;C, antibiotic control group;D, 5% fermented group;E, 10% fermented group. Bars marked without the same letters indicated significant difference at P<0.05. The same as below.图1 饲料对肉鸡血清促炎性细胞因子水平的影响Fig.1 Influence of multi-strain co-fermented feed on the serum pro-inflammatory cytokines level of broilers
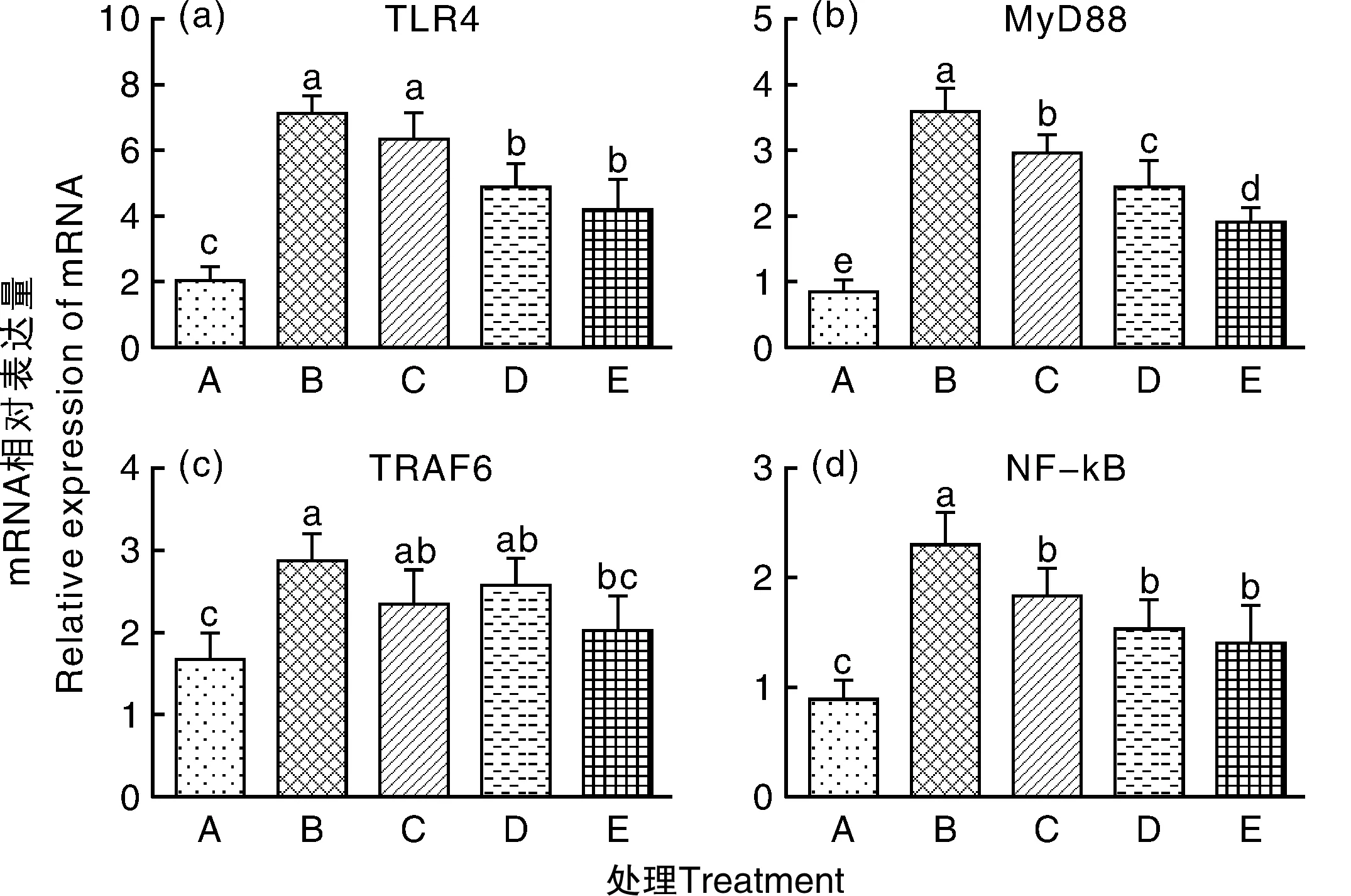
图2 多菌种联合发酵饲料对TLR4路径信号分子mRNA表达的影响Fig.2 Influence of multi-strain co-fermented feed on mRNA expression of key signal molece of TLR4 pathway of broilers
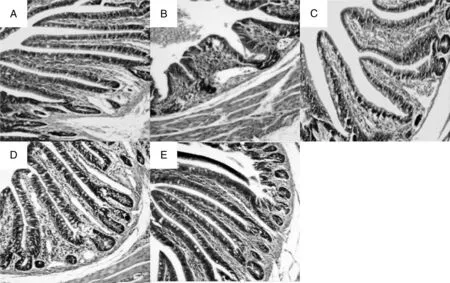
A, 对照组;B,模型对照组;C抗生素对照组;D,5%发酵组;E,10%发酵组。A, control group;B, model control group;C, antibiotic control group;D, 5% fermented group;E, 10% fermented group.图3 多菌种联合发酵饲料对结肠形态的影响(200×)Fig.3 Influence multi-strain co-fermented feed on the colon morphology of broilers (200×)
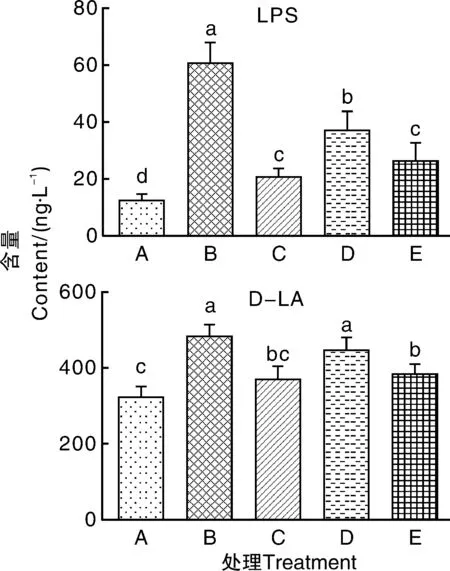
图4 多菌种联合发酵饲料对肉鸡肠道屏障功能的影响Fig.4 Influence of multi-strain co-fermented feed on serum LPS level of gut barrier functions of broilers
3 讨论
肠道是动物体抵御致病菌入侵的重要防线[7],沙门氏菌能够通过炎症反应与肠道菌群竞争,克服定植抵抗从而在肠道中大量繁殖并引发更严重的炎症反应,直至破坏肠道屏障,引起全身疾病[8]。
本研究结果显示,肉鸡遭受沙门氏菌感染后,IL-6、TNF-α等促炎因子水平显著上升,表明沙门氏菌的入侵引起了肉鸡的炎症反应。而炎症反应的发生依赖于模式识别受体对病原保守分子的识别,TLR4可通过识别细性菌细胞壁中的LPS来介导肠上皮细胞产生免疫应答[9]。本研究结果表明,沙门氏菌的入侵导致TLR4路径的关键信号分子mRNA表达量均显著上升,提示TLR4在沙门氏菌诱导肠道炎症的发病机制中发挥了重要作用。
在本试验中,饲喂多菌种联合发酵饲料组肉鸡肠道TLR4、MyD88、TRAF6 mRNA相对表达量均显著低于模型对照组,血清TNF-α、IL-1β、IL-6水平显著下降,提示多菌种联合发酵饲料能够通过抑制沙门氏菌诱导的TLR4信号通路的激活,下调炎症因子的释放,以减轻沙门氏菌感染带来的损伤,该结果与前人的研究结果相类似[10]。
肠道炎症会破坏肠道屏障功能。血清LPS、D-LA是衡量肠黏膜功能是否完整的敏感性指标。当肠黏膜屏障功能正常时,LPS、D-LA均难以跨越肠黏膜屏障进入血液,一旦肠黏膜屏障功能遭到破坏,其在外周血中的含量将明显升高。本研究结果显示,沙门氏菌的入侵导致血清LPS、D-LA的含量显著上升,表明沙门氏菌的入侵导致肠黏膜通透性增加,肠黏膜屏障功能遭受破坏,而多菌种联合发酵饲料能够显著降低血清LPS、D-LA含量,但效果略低于硫酸粘杆菌素,表明多菌种联合发酵饲料能够减轻沙门氏菌入侵导致的肠道屏障功能受损的情况,该结果与结肠形态结果相对应,但究竟是益生菌起的作用还是代谢产物,亦或是两者协同作用,还有待进一步研究。
综上所述,多菌种联合发酵饲料能够通过抑制由沙门氏菌感染导致的TLR4-MyD88-TRAF6-NF-κB信号的激活,从而降低促炎因子IL-1β、IL-6、TNF-α水平,减缓沙门氏菌感染导致的炎症反应,此外其还能减轻沙门氏菌感染导致的肠道屏障受损。
