黄芪多糖的免疫调节作用对治疗口腔扁平苔藓的探讨
2019-03-04马田田综述王秀梅审校
马田田 综述 王秀梅 审校
口腔扁平苔藓(oral lichen planus,OLP)是口腔黏膜的一种慢性非特异性炎性疾病,多数学者认为该疾病是T淋巴细胞介导的一种免疫相关性疾病,在口腔黏膜病中其复发程度仅次于复发性阿弗他溃疡。OLP发展的特征为大多数情况下是由Th1/Th2免疫平衡与其他的CD4+T细胞亚群共同调节。
中药黄芪根据中医的理论其具有扶正补气,利水退肿、托毒排脓、生肌等功效。而现代药学的研究也已经证实,黄芪有增强机体免疫功能、保肝、利尿、抗衰老、抗氧化、降压和较广泛的抗菌作用。黄芪多糖(Astragalus polysaccharide,APS)作为从黄芪中提取的一种主要生物活性成分,是目前临床应用比较广泛、研究较为深入的中药成分之一。本文特综述APS的免疫调节活性及其他药理作用的研究新进展及可能应用于口腔扁平苔藓的调节机制。
1 APS的组成及免疫活性
APS作为从传统中药黄芪中提取的一种有效成分是一类生物大分子,其成分包括葡聚糖和多种单糖。其中葡聚糖又有水溶性葡聚糖和非水溶性葡聚糖,分别是 α -(1→4)(1→6)葡聚糖和 α - (1→4)葡聚糖。其单糖种类主要包括 L-鼠李糖、 L-阿拉伯糖、 D-木糖、 L-木糖、 D-核糖、 L-核糖、 D-半乳糖、D-葡萄糖和 D-甘露糖等。Jiang等[1]从黄芪水中提取4 种黄芪多糖(APS1-APS4),提取后对每种多糖用20%、 40%、 60%、 80%的乙醇沉淀法进行纯化,用硫酸-苯酚法测定所有糖含量,用用高效凝胶渗透色谱法(HPGPC)确定它们的分子量,用反相高效液相色谱分析柱前衍生色谱法测定其单糖组成,然后通过体外脾淋巴细胞增殖实验评估APS的免疫生物活性。APS的4 种分子量分别为257.7 kDa、40.1 kDa,15.3 kDa和3.2 kDa。单糖组成分析表明,APS1仅包括葡萄糖,APS2包括所有阿拉伯糖,APS3包括鼠李糖、葡萄糖、半乳糖、阿拉伯糖,APS4包括半乳糖、阿拉伯糖。体外脾淋巴细胞增殖实验证实APS2和APS3能有效刺激正常脾淋巴细胞在体外增殖。且APS2的浓度在6.25~800 μg/ml之间呈剂量依赖性。由此可证明分子量在15.2 kDa和40.1kDa之间组份为阿拉伯糖的APS有明显的免疫活性。
2 APS对免疫细胞的调节作用
2.1 对树突状细胞的调节
耐受性树突状细胞(DCs)包含两种细胞,一种是具有稳定表型的CD11clowCD45RBhigh,另一种是CD11chighDCs,而后者位于脾脏和淋巴结,特征是可以表达高水平的MHC-Ⅱ类分子和共刺激分子,并且CD11chighDC活化后可分泌大量的IL-12。APS可在体外诱导脾脏DCs转化成CD11chighCD45RBlowDCs,因此猜测可使Th2转化成Th1增强T淋巴细胞的免疫作用。为证明这一猜测Liu等[2]将小鼠脾脏制成单细胞悬液采用磁珠分选方法分离DCs, CD11chighCD45RBlowDCs,CD11clowCD45RBhighDCs和CD4+T细胞,采用ELISA和流式细胞术等实验方法,得出用APS诱导后CD11chighCD45RBlowDCs细胞百分率明显升高,且CD11clowCD45RBhighDCs与IL-12的产生和APS的刺激呈现剂量依赖关系。证明了APS可导致脾脏DCs分化成CD11chighCD45RBlowDCs继而使Th2转化成Th1,增强T淋巴细胞的免疫功能。
2.2 对T淋巴细胞的调节
CD4+CD25highTreg的平衡可通过抑制自身反应性T细胞和癌细胞免疫反应阻止自身免疫性疾病的发生。相关研究证实APS对CD4+CD25+Treg细胞的生长和增殖的抑制作用呈剂量和时间依赖性,而这种抑制作用可能是通过使失衡的细胞因子恢复和使局部肝癌微环境中的FOXp3减少来实现的,CXC类趋化因子SDF-1在募集Treg细胞到肝癌肿瘤微环境中发挥着重要催化作用,故猜测APS可能通过CXCR4/CXCL12通路阻断SDF-1及其受体抑制Treg细胞转移[3]。
APS可以降低系统性红斑狼疮患者血清中IFN-γ和 IL-10的水平,改善系统性红斑狼疮患者的Thl/Th2细胞比例失调[4]。而且APS没有激素长期治疗的副作用,这为自身免疫性疾病的治疗提供了新的思路。
Th17细胞是一种以分泌 IL-17为特征的CD4+T辅助细胞亚群[5],主要产生IL-17A和 IL-17F,以及少量的肿瘤坏死因子(TNF)和IL-6,其中IL-17A是Th17细胞发挥免疫调节作用的主要效应因子。IL-23作为一种重要的促炎因子可以促进激活的记忆细胞产生IL-17,使Th17细胞得生存。郭艳等[6]通过制备大鼠溃疡性结肠炎模型,于造模后第3 天给予APS溶液和柳氮磺胺吡啶(SASP)混悬液的实验方法,发现APS组大鼠肠黏膜腺体增生修复明显,肌层增厚,炎性细胞浸润不明显,且APS组与SASP组大鼠血清中IL-23、IL-17、TGF-β含量均显著降低,其中APS组降低更明显,证明APS对IL-17有调节作用,并猜测APS可能通过调节大鼠血清中 IL- 23、TGF-β的表达来调节 Th17 细胞,以减轻肠黏膜炎症损伤。
2.3 对巨噬细胞的调节
APS能促进巨噬细胞内TNF-α,GM-CSF和NO的产生,从而提高巨噬细胞的免疫防御能力[8]。巨噬细胞作为免疫效应细胞,参与免疫系统的调节,是机体免疫系统中重要成分之一,且主要为非特异性免疫。这些细胞的功能正常关系到免疫应答的抗原呈递过程和抗原清除能力。因此,通过检测巨噬细胞对异物颗粒的吞噬能力可直接评价吞噬细胞自身的功能,也可以间接评价免疫应答能力。研究[7]发现免疫抑制模型小鼠给予APS后巨噬细胞对鸡红细胞的吞噬百分率和吞噬指数明显升高,说明APS可显著提高小鼠的免疫功能。由此可知,APS对免疫抑制模型小鼠巨噬细胞的吞噬功能具有明显增强作用。
亦有研究发现APS可明显增加巨噬细胞内蛋白激酶C(PKC)的活性和细胞内第二信使(NO,cAMP, DAG, IP3, Ca2+)的浓度,而且经APS作用后巨噬细胞内NF-κB的mRNA和蛋白水平明显增加,但经Ca2+抑制剂NiCl2作用后却明显降低,同时TNF-α和IL-6也显著降低[9]。证明Ca2+-cAMP 和 TLR4/NF-κB 信号通路参与了部分APS在巨噬细胞内的免疫调节。
3 抗炎作用
3.1 通过抑制NF-κB信号通路
APS可明显抑制NF-κB信号通路活性。Tao Luo等[10]将小胶质细胞BV2经LPS刺激后加入不同浓度的APS培养24h,结果发现TNF-α和IL-1βmRNA的表达水平呈剂量依赖性降低,IκB降低70%,磷酸化的NF-κBp65蛋白水平亦降低。NF-κB在胞浆中结合抑制剂IκB,IκB蛋白的降解是NF-κB激活的一个重要步骤。证明了APS可显著抑制LPS诱导的IκB的降解,从而抑制NF-κB的活化和转导。此外,亦有人通过在小鼠腹腔注射APS,检测到NF-κB通路的标志性因子NF-κBp65、p-NF-κB p65 及 p-IκBα表达明显降低[11],亦证明APS可明显抑制 NF-κB信号通路活性。
3.2 通过抑制MAPKs和PKB信号通路
丝裂原活化蛋白激酶(MAPKs)包括p38、JNK和ERK,已被证实参与了氧化应激和促炎信号级联放大。PI3K/PKB调节细胞的活化、炎症反应和细胞凋亡。PI3K通路激活后可通过抑制细胞凋亡保护心脏功能,抑制p38MAPK减轻细胞炎症反应[11]。先前研究证明,PI3K/PKB和MAPK通路是APS必不可少的靶点。最近研究发现ERK、JNK、p38和PKB激酶被LPS刺激后磷酸化,与它们在介导炎症中的关键作用一致;然而在APS作用后仅有pPKB被选择性抑制,故猜测这种差异的原因可能主要是由于个体的PKB基因表达与细胞类型和刺激的变化有关。 (MAPKs)信号通路可通过IκB的降解促进NF-κB的激活。Ye等[12]研究显示APS通过抑制基底样乳腺癌细胞株MDA-MB-468的增殖下调PKB的磷酸化表达。如图 1在BV2小胶质细胞中,LPS刺激激活TLR4作用于MAPKs、PI3K/PKB, 两者发送信号到NFκB-IκB复合物, NFκB-IκB复合物活化释放NFκB入核,NFκB在释放入核时即介导参与炎症反应的基因转导,APS选择性阻止LPS诱导的PKB磷酸化从而抑制IκB降解,抑制NFκB磷酸化,降低小胶质细胞中NO、PGE2、TNF-α和IL-1β的产生。
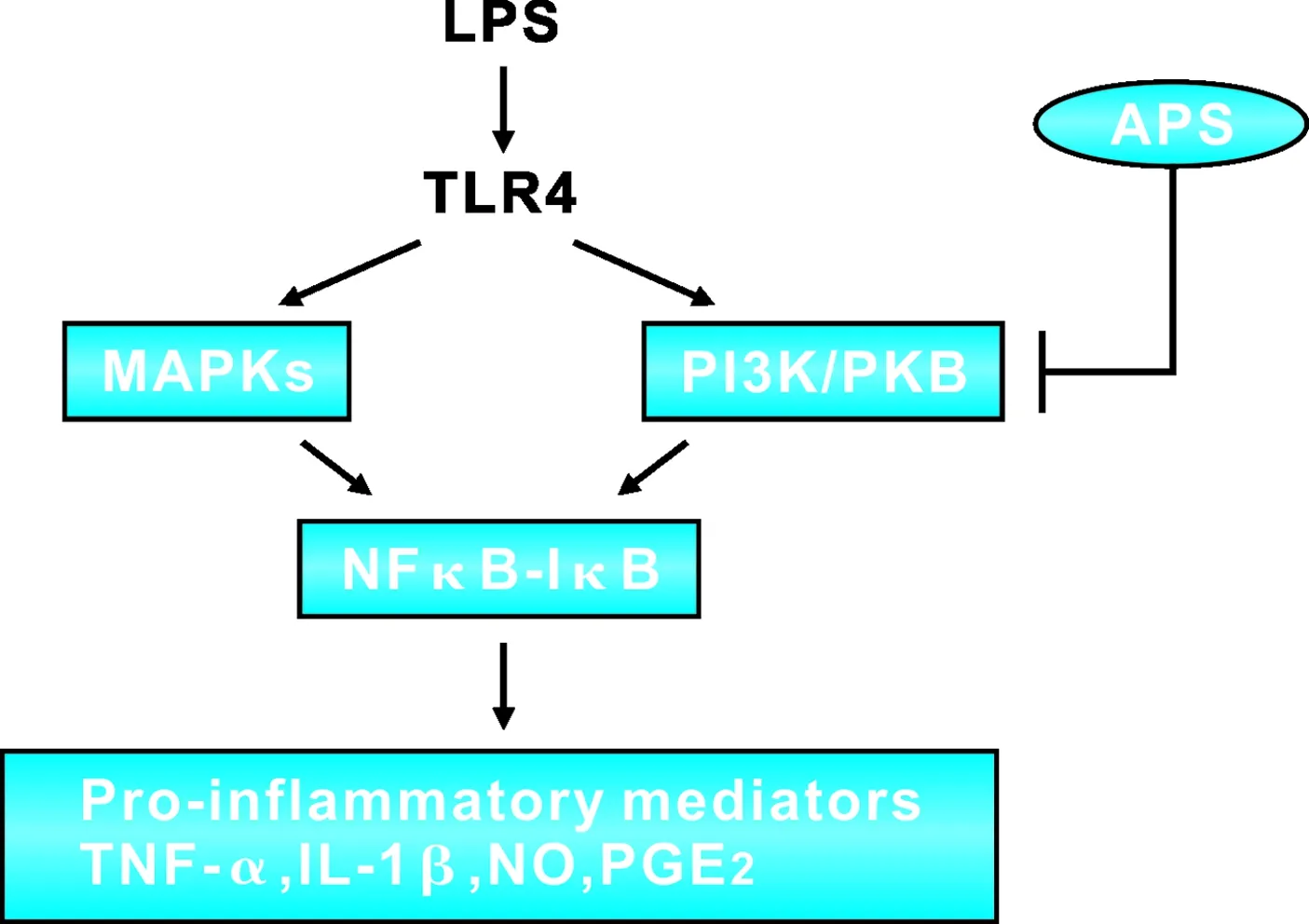
图 1 APS对LPS介导的BV2小神经胶质细胞炎症反应的影响
4 抗凋亡作用
活性氧(ROS)水平的增加在细胞凋亡的发展中起着关键的作用,由ROS引起的氧化应激通过氧化线粒体膜和线粒体的膜电位去极化产生大量ROS启动或促进细胞凋亡和衰老[13],ROS参与了铁过载诱导的细胞凋亡和器官老化,铁过载可通过细胞内ROS的增加引起骨髓间充质干细胞(BMSCs)的凋亡[14];APS可降低由沙苑子黄酮(FAC)引起的BMSCs线粒体中明显增加的ROS及细胞凋亡;提高干细胞调控因子Nanog,Sox2和Oct4的mRNA表达水平。因此APS通过阻止线粒体内ROS的聚集进而明显抑制由FAC诱导的因铁过载引起的BMSCs凋亡、衰老和多功能性降低。
5 其他作用
5.1 杀伤肿瘤细胞
Huang等[15]在肝癌(HCC)细胞系H22细胞中分别用CCK-8和流式细胞术等实验方法检测APS对其的潜在作用,结果与正常肝组织相比发现HCC组织中Notch1的mRNA和蛋白表达明显上调,且用APS作用后H22细胞Notch1的mRNA和蛋白表达水平的降低呈浓度依赖性,用siRNA敲击的Notch1可通过降低凋亡抑制基因Bcl-2的表达和增加促凋亡基因BAX的表达来降低H22细胞的活性,显著提高H22细胞的凋亡。因此,Notch1可调节HCC细胞的生存和转移能力,APS即通过抑制Notch1的表达诱导HCC细胞凋亡。
5.2 抗病毒
通过三偏磷酸钠、三聚磷酸钠(STMP-STPP)法和氯磺酸-吡啶方法来分别修饰APS可得到其磷酸(pAPS)和硫酸(sAPS)形式[16],通过观察APS、pAPS和sAPS在细胞和血液的病毒增殖过程的抗-DHAV增殖作用,证明了pAPS在整个病毒增值过程中抑制DHAV增值的作用显著强于APS和sAPS,并且能显著提高33.5%的生存率,降低血液和肝脏病变部分的DHAV颗粒效价。因此,pAPS可有较强的抗-DHAV活性。
6 OLP发病机制涉及的免疫细胞
与OLP的发病机制相关的细胞主要是:角质细胞、CD8+T淋巴细胞、CD4+T淋巴细胞、树突细胞(DC)、Treg细胞等。DC通过抗原反应激活T细胞,在免疫反应中,CD4+T淋巴细胞可激活B淋巴细胞、巨噬细胞及CD8+T淋巴细胞。这些细胞可分化为3 个不同的细胞系:Th1、Th2 以及Th17。Xie等[17]的研究显示,OLP患者Th1和Th17细胞的比例及血清中IL-17的含量较正常水平显著升高,提示Th17是OLP促炎症细胞因子,Th17系细胞及其相关细胞因子在OLP发病中发挥重要作用。在OLP患者中CD8+T细胞的渗透主要发生在表皮内、基底膜破坏区及毗邻基底角质细胞。抗原识别、表达的基础是通过角化细胞促进趋化因子激活,最终通过活化穿孔蛋白或颗粒酶,使Fas L受体表达,从而促进 TNF-α分泌,促进角质细胞发生凋亡。在OLP患者外周血中CD4+CD25highT 细胞、CD4+Foxp3+T细胞水平较正常对照组明显升高;CD4+CD25highT细胞与CD4+Foxp3+T细胞水平存在正相关性,CD4+CD25+Foxp3+T细胞与CD4+Foxp3+T细胞水平存在明显正相关性[18];Wang等[19]亦发现OLP患者外周血中CD4+CD25+Foxp3+Treg细胞的表达明显增加,猜测Treg细胞的表达升高可能是OLP的发病因素之一。
7 展 望
近年来,尽管OLP在治疗上取到了良好疗效,但OLP的复发率仍然很高,而且激素长期治疗的的副作用对患者的日后生活也造成了极大的困扰。APS作为一种研究较热的中药成分,有显著的免疫活性,其主要作用可使脾脏DCs分化成CD11chighCD45RBlowDCs,继而使Th2转化成Th1,增强T淋巴细胞的免疫功能;改善失衡的Th1/Th2细胞比例;调节Th17细胞及相关细胞因子;抑制Treg细胞的免疫抑制作用;提高巨噬细胞的吞噬功能;通过NF-κB及MAPKs和PKB信号通路发挥抗炎作用;亦可通过阻止ROS的聚集防止因铁过载引起的BMSCs凋亡、衰老、多功能降低。此外,APS还有抗肿瘤、抗病毒作用。TLRs/NF-κB信号通路的激活现已被本课题组证实参与了OLP的炎症反应及其病理过程;且TLRs/NF-κB信号通路中跨膜信号蛋白TLR4和胞内转录因子NF-κBP65基因的表达水平随OLP细胞模型炎症反应程度的加重而升高[20],TLR-4及NF-κBP65在OLP的病损形成中具有重要意义[21]。细胞凋亡异常及细胞免疫紊乱等在OLP的发病机制中亦具有非常关键的作用。因此,APS在OLP中的作用有待于研究证实。我们更应该对该中药进行深入的研究,以改善Th1/Th2细胞比例失衡,通过NF-κB信号通路抗炎,抑制细胞凋亡为治疗靶点,使之成为根治OLP的药物,造福人类。
