血小板浓缩物质在脂肪液化创面治疗中的研究进展
2019-03-04广东医科大学广东医科大学附属医院广东湛江524000
(广东医科大学,广东医科大学附属医院,广东 湛江,524000)
随着肥胖人群及糖尿病患者人数的增加,术后伤口脂肪液化在临床治疗中有明显增多趋势。据国内文献报道[1],腹部术后切口脂肪液化的发生率约为8.20%。脂肪液化目前已成为普外科、妇产科、骨科的常见术后并发症。吴阶平,裘法祖等在《黄家驷外科学》[2]中就指出:切口发生脂肪液化后如经久不愈则有利于细菌滋生导致感染,延长住院时间,加重患者心理及经济负担。在临床诊疗中,伤口脂肪液化应当引起医生的高度重视。然而我国对伤口脂肪液化的诊治尚无临床指南,目前常用治疗方式有:清创负压引流、光线治疗、高渗糖胰岛素治疗、湿性辅料治疗,血小板浓缩物质治疗,中药中医治疗等几大类[3]。血小浓缩物质作为新型创面修复材料,因其制备方法简便、成本低廉、具有较高的临床实用性,所以本文将围绕血小板浓缩物质及其在脂肪液化创面治疗领域的进展进行综述,以期待为脂肪液化创面的治疗带来新的思路。
1、血小板浓缩物质的发展
上世纪80年代,最初的血小板浓缩物质在浓缩提取后,可释放6-8倍生理计量生长因子[4-5]。在临床中用于促进外科手术的伤口及创面愈合。到上世纪90年代PRP的概念被提出,并由Whitman[9]和Marx[10]首先将其应用于临床治疗。随着PRP制备技术的提高,血小板浓缩纯度得到了大幅提升,PRP中血小板浓度可达到95%以上。近年来PRP已广泛应用于颌面外科、神经外科、骨科、整形美容外科等领域。但PRP的应用有其局限性,PRP制备耗时长,在第二次离心转移试剂时可能出现污染,制备时使用的抗凝剂、氯化钙、血凝酶等制剂,在创面修复过程中可对细胞增殖过程及纤维蛋白凝集作用产生负面影响。21世纪初法国医生Joseph Choukroun[11]及其团队提取出第二代血小板浓缩物质PRF,又称为Choukroun’s PRF,并应用于临床治疗。与PRP对比,PRF制备只需一次离心、耗时短、无添加任何试剂,可长效刺激组织修复并能调节炎症反应,能够覆盖修复小范围的组织缺损。
1. PRP及PRF的制备方法
2.1 PRP的制备及激活
取静脉血于含有枸橼酸钠抗凝剂的离心管中,第一次以低速900 r/min (100 × g,离心10 min)离心。由于血液中各成分比重不同,血浆、血小板、红细胞可出现分层。下层为红细胞层,中间层出现白色的薄层含有大量血小板和白细胞,上层为澄清淡黄色血浆层。取血浆和中间层进行第二次离心,以高速3000 r/min (400 × g,离心10 min)离心后,根据密度不同分为 3 层:上层为贫血小板血浆(PPP,Platelet-poor Plasma)层,中间层即为PRP,下层为少量红细胞,吸取中间层混匀即为 PRP,制备得到的PRP在抗凝状态下一般可保存8小时[12-13]。应用二次离心法制备 PRP需消耗大量血液,且容易污染,因此临床制备PRP通常采用血液成分分离自动化设备,在制备较大量PRP的同时,可将红细胞和血浆回输给患者。取制备好的PRP约5 ml,加入1ml激活剂(由1ml 10%的氯化钙与1000 U凝血酶混合制成),PRP激活后可迅速释放α颗粒及致密颗粒,这两种颗粒均可分泌大量生长因子。
2.2 PRF的制备
取静脉血至无添加剂的玻璃试管内,在血液凝固前应尽快离心,以3000 r/min (400 × g,离心10 min)离心后,试管内可见分为三层。上层为淡黄色PPP,中间层呈白色凝胶状PRF,下层为红细胞层。应用此方法制备的PRF所释放生长因子的量明显多于其他制备方法[14]。PRF的制膜及保存:取出离心得到的PRF凝胶,因PRF层与红细胞层交界处含有大量的血小板和白细胞,在去除红细胞层时应当保留少量红细胞层[15]。PRF凝胶在除去水分后即可得到PRF薄膜。制膜的方法很多,最常见方法有纱布挤压法和金属板重力压制法。相比较两种方法,金属板压制的PFR膜受力面均匀且可避免纱布上的纤维残留在PRF膜中,因此金属板重力压制法效果更加稳定可靠[16-17]。PRF可在短时间内保存于低温 4℃的条件下[18],如需长期保存则可使用冷冻干燥处理技术[19]。
2.3 PRF的几种亚类
随着PRF的应用推广,在标准的PRF制备技术基础上衍生出L-PRF(leukocyte-PRF)、A-PRF (advanced platelet-rich fibrin)、i-PRF(Injectable Platelet-Rich Fibrin)、T-PRF(titanium-prepared, platelet-rich fibrin) 等几种亚类。L-PRF在标准PRF制备方法基础上,将转速调至2700 r/min并离心12分钟,可得到富含白细胞的L-PRF。因其富含炎症细胞释放炎症因子,可具有更好炎症调节作用和抗菌效应[20-21]。将血液置入无菌塑料管中,以1500 r/min转速离心14分钟,可得到凝胶远端富含中性粒细胞的A-PRF[22],A-PRF更有利于促进单核细胞分化为巨噬细胞,从而分泌生长因子促进骨骼和软组织再生。Xuzhu Wang等[23]于2017年率先提出i-PRF概念,将血液以700r/min低转速离心3分钟可得到一种呈液体状的i-PRF,这是全新的PRF亚类。在与PRP的动物对比实验中[24],i-PRF因含有纤维蛋白和白细胞而更显著动员细胞迁移促进创面修复。应用钛合金离心管将血液在3500r/min转速下离心15分钟可得到T-PRF[25-26],T-PRF中的纤维蛋白结构更加稳定,能够在创面作用更长时间。且通过钛合金激活的血小板比二氧化硅激活的血小板具有更好的生物相容性。见表1.
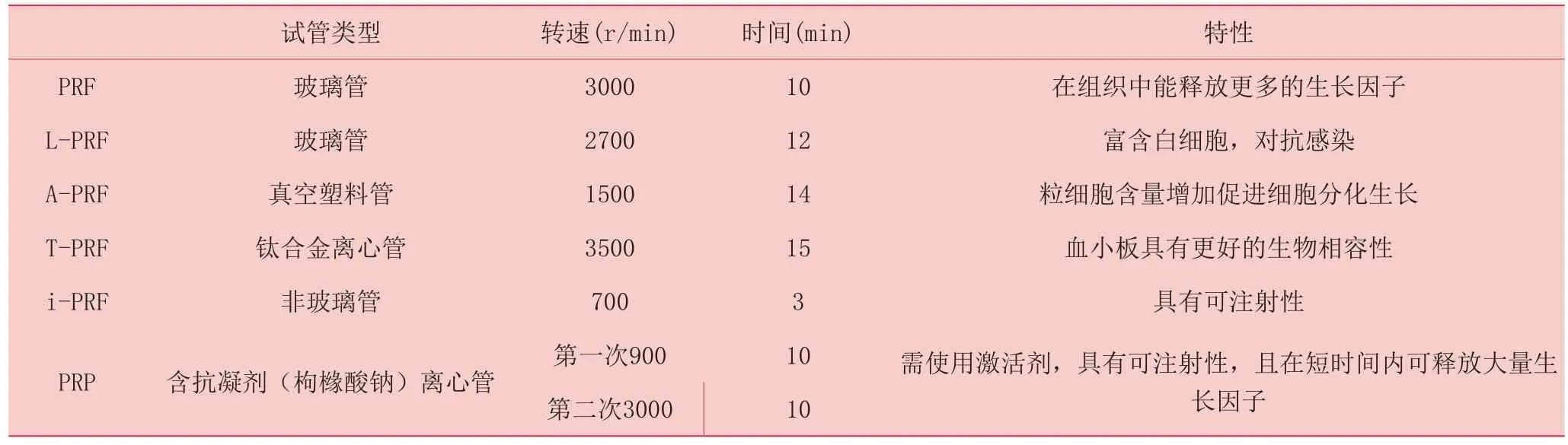
表1 PRF的几种亚型的制备方法及特性
3.血小板浓缩物质的作用机制:
3.1 血小板浓缩物质可释放大量生长因子
目前已知能够促进创面愈合的生长因子包括:血小板衍生因子(PDGF,Platelet-Derived Growth Factor)、表皮细胞生长因子(EGF,Epidermal Growth Factor)、成纤维细胞生长因子(FGF,Fibroblast Growth Factor)、胰岛素样生长因子(IGF,Insulin Growth Factor)、血管内皮生长因子(VEGF,Vascular Endothelial Growth Factor)、转化生长因子-β(TGFβ,Transforming Growth Factor-β)、肝细胞生长因子(HGF,Hepatocyte Growth Factor)等[27]。而血小板浓缩物质可释放的生长因子种类包括:PDGF、EGF、VEGF、FGF、IGF、TGF-β等,且这些生长因子按人体生物比例释放可大大提高其利用率及生物效应[28]。PDGF具有PDGF-AA、PDGF-AB、PDGF-BB 三种亚型,是创面形成时最早分泌的生长因子之一,并作用于创面修复全过程[29]。PDGF通过激活平滑肌细胞、成纤维细胞、血管内皮细胞的有丝分裂,可增加胶原蛋白细胞合成、激活纤维蛋白酶原、促进血管内皮细胞增殖和迁移、加快微血管网的重建及肉芽组织的形成[30-31],此外PDGF还可促进TGFβ、IGF-1的分泌[32]。EGF主要由血小板脱颗粒分泌,刺激上皮细胞和角质细胞的增殖、分化、迁移。VEGF是调节血管新生、淋巴管生成及血管通透性的关键调控因子[34],对血管内皮细胞具有强烈的旁分泌作用,加速创面肉芽中的血管生成[36-37]。FGF与VEGF具有协同效应,通过刺激成纤维细胞增殖,增加胶原蛋白合成,加速肉芽组织的形成[39]。FGF还可促进TGF-α的分泌,抑制Ⅰ、Ⅲ型胶原蛋白的局部分泌堆积,在促进组织上皮化的同时可减少增生性瘢痕[40-41]。IGF对细胞有自分泌作用,主要作用于创面的炎症反应阶段,可加强成纤维细胞的分泌功能[43]。TGF-β也有三个不同亚型:TGF-β1、TGF-β2、TGF-β3,在创面愈合过程中它们几乎同时出现,但作用却各不相同。TGF-β1往往以较高浓度存在于创面中,具有炎症细胞招募作用,可以增强巨噬细胞介导的细胞吞噬、清理功能[45]。TGF-β2几乎参与创面愈合的所有阶段,它通过对炎症细胞和成纤维细胞的招募作用,促进细胞增殖,诱导血管生成,形成新生肉芽组织[46-47]。TGF-β2通过调节增加I型和III型胶原蛋白分泌,促进疤痕形成。与TGF-β1、TGF-β2促进瘢痕生成不同,TGF-β3能减少胶原蛋白在组织中的堆积,抑制疤痕增生[48]。
3.2 PRF的空间结构作用
传统浓缩血小板及PRP缺少空间立体结构,血小板短时间内破裂释放出α颗粒并迅速分泌生长因子,但这种生长因子释放峰值呈一过性,随后逐渐减少[49],创面中血小板的寿命只有五天左右,因此难以长时间维持生长因子的有效浓度[50]。电镜下观察发现PRF中纤维蛋白、纤连蛋白和玻连蛋白成疏松立体结构,血小板及白细胞可同时与数条纤维蛋白形成类似半桥粒连接结构,使得血小板内的α颗粒结构稳定[51]。PRF纤维蛋白网状结构与人类天然组织结构相似,不仅可以延缓内源性纤维蛋白酶降解从而保障血小板长效提供生长因子[52-53],还可以作为物理结构支架诱导组织细胞爬行与迁移,其疏松的结构也有利于白细胞的滞纳及氧气与营养物质的弥散,更利于免疫细胞发挥抗感染作用[54]。
3.3 血小板浓缩物质的抗菌作用
血小板分泌的抗菌蛋白质包含至少四个家族:细胞因子源性肽、防御素、抗菌肽衍生物、蛋白水解衍生物[55],血小板α颗粒分泌的抗微生物源性肽、细胞因子源性肽、免疫细胞趋化因子等具有免疫细胞招募效应,通过招募巨噬细胞、中性粒细胞、T 细胞、B 细胞等均可增强创面抗感染能力[56]。血小板的表面及胞内还具有Toll 样受体、细胞因子IL-1-TLR 受体家族等多种传感器,并可通过模式识别受体(PRR,Pattern recognition receptor)快速应答创面炎症反应,在发挥凝血功能的同时可限制细菌扩散,具有直接抗菌作用[57-58]。PRF中高浓度的中性粒细胞、单核细胞、淋巴细胞在局部炎性和感染时释放白介素-1β、白介素-6、肿瘤坏死因子-α等,可增强组织抗感染能力[59-60]。PRF中的白细胞和血小板,可持续释放天然抗菌肽(HDP-Host Defense Peptides),HDP介导的人体免疫反应在发挥抗菌效应的同时可减少细胞毒性,并克服细菌的耐药性,且HDP对革兰氏阳性和革兰氏阴性细菌以及病毒和真菌均有抗菌活性[61-63]。
4.血小板浓缩物质在脂肪液化创面的治疗
4.1 脂肪液化的基本概念
术后切口脂肪液化是手术切口部位脂肪组织细胞受损破裂、坏死、液化的变化过程,其病理机制尚未完全明了,其病理表现为脂肪细胞破裂后脂滴溢出、聚集、伴有无菌性炎症反应,脂肪液化过程虽无细菌感染,但延长了切口愈合的时间,增加了切口感染的机会。目前我国对脂肪液化切口没有明确的诊断标准,参考苏明宝等[64]的诊断标准:①发生于手术后5-7天左右,多数患者切口出现较多渗液,于常规换药检查伤口时可见敷料上有淡黄色渗液,挤压切口周围皮下组织有较多渗液从切口溢出; ②切口愈合延迟,皮下组织游离,切口渗液中可见大量飘浮脂滴; ③切口及周围皮肤无明显红肿压痛,切口边缘及皮下组织无感染及坏死征象; ④取伤口渗出液涂片,镜下可见大量脂滴,连续3次培养无细菌生长。
4.2 脂肪液化的易患因素
术后切口脂肪液化的高危因素包括肥胖、高频电刀使用不当、糖尿病、手术切口保护欠妥、缝合方法和缝合技术经验不足、营养素的缺乏等[65]。而切口脂肪液化的发生往往是以上多个因素综合作用,造成切口局部血液循环差,血管再生速度减慢,组织修复障碍,从而导致局部脂肪细胞无菌性变性坏死,脂肪细胞破裂后脂滴溢出、聚集,伴有局部无菌性炎症反应发生。
4.3 脂肪液化创面的治疗现况
患者术后切口出现脂肪液化时,早期清除坏死组织及渗液是处理的关键,通畅的引流出积液可以避免伤口的感染。目前对于术后切口脂肪液化治疗的方法有: 创面局部拆线引流、中医药物外敷、光线照射疗法、细胞生物因子、负压创面疗法 (NPWT,NegativePressure Wound Therapy)、高渗糖胰岛素治疗、湿性敷料疗法、蝶形胶布牵拉等等。这些种类繁多的治疗均需要价格昂贵的医疗设备或耗材,在临床治疗中增加了医疗成本及患者的费用负担。应用血小板浓缩物质治疗脂肪液化切口,因取材均为患者本人血液,无严重医学伦理问题,避免了机体免疫排斥反应,价格低廉、操作简便安全,能明显缩伤口愈合时间及较少患者平均住院时间,可有效减轻患者心理与经济负担,是治疗手术切口脂肪液化的有效方法之一。据我国国内参考文献数据表明,高娟等[66]应用PRP治疗妇产科手术后切口脂肪液化,使患者伤口平均愈合时间缩短42.06%。刘晓韬等[67]应用PRP使胃肠外科、肝胆外科手术后切口脂肪液化的平均愈合时间缩短45.61%,且在治疗期间均未有不良事件发生,治疗过程安全性较高,具有极高的临床实用性。
虽然目前尚无PRF应用于临床脂肪液化创面治疗的相关报道,但目前已有离体脂肪组织实验结果证实利用PRF能够促进脂肪干细胞(ASCs,Adipose-derived Stem Cells)的增殖与分化[68],提高局部脂肪细胞和毛细血管的数量及密度,促进脂肪组织局部的血管再生,减少脂肪细胞的凋亡,减少脂肪组织纤维坏死的发生,增加脂肪组织的质量保持率[69]。在临床应用PRF的伤口治疗中,可以观察到PRF相对于传统治疗方法,可以提高伤口生长因子浓度、修复细胞过度凋亡的情况并促进血管生成及组织修复,同时还具有抗感染的作用,从而加速伤口愈合、缩短治疗周期[70]。PRF较PRP更易于获取,制备方法更简单,对于术后脂肪液化伤口治疗具有巨大研究价值和实用潜力。
