单中心应用抓捕器Snare拔除电极导线的临床经验
2019-03-02蔡景景乌仁陶古斯昃峰段江波李鼎王龙苑翠珍李学斌
蔡景景 乌仁陶古斯 昃峰 段江波 李鼎 王龙 苑翠珍 李学斌
随着国内起搏器、埋藏式心脏转复除颤器(ICD)、心脏再同步化治疗(CRT)等心脏植入型电子器械植入量的增加,植入装置的感染、电极导线断裂、电极磨损等相关并发症也逐年增多。电极导线的拔除越来越受重视,而经静脉应用锁定钢丝、机械鞘、激光鞘以及抓捕器等工具拔除电极导线技术是目前处理相关并发症的主要手段[1]。笔者回顾性分析2017年1月至2018年1月北京大学人民医院应用抓捕器Snare作为拔除工具的病例资料,进一步探讨在下腔途径拔除导线技术成熟的基础上应用Snare拔除导线的安全性、有效性。
1 资料与方法
1.1 病例资料
2017年1月至2018年1月就诊于北京大学人民医院,应用下腔装置抓捕器Snare拔除电极导线的54例患者。所有患者均签署知情同意书,并且按照美国心律学会《经静脉电极导线拔除专家共识》中的电极拔除适应证的定义,所有患者均符合Ⅰ类或Ⅱa类指征[1]。患者的基本资料,植入装置类型及拔除手术相关情况和结果均记录分析。
1.2 Snare装置及电极拔除过程
1.2.1 Snare装置 Needle′s Eye Snare抓捕器即针眼圈套器,由套圈、鞘管、内鞘、接头盒手柄组成,用于经皮回收导管、电极及其他异物。Snare回收装置的抓捕钢丝有头端宽阔弯曲度较大的环形金属抓捕器(Needle′s Eye)和头端细长弯曲度小的金属环(Threader)组成[2]。见图1。
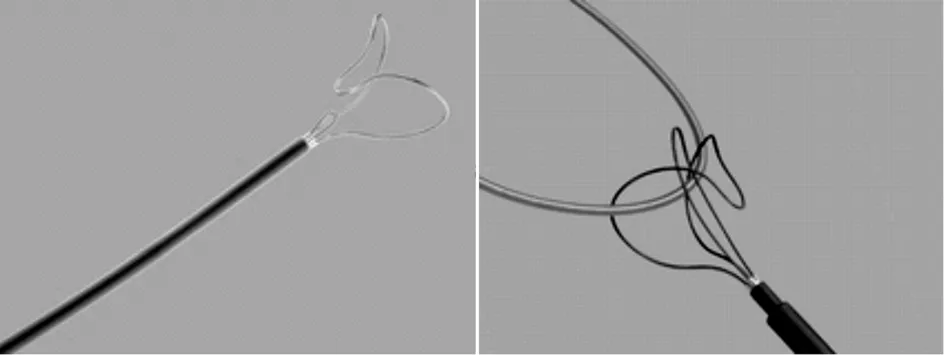
图1 Snare抓捕器组成及抓捕方式
1.2.2 手术过程 所有电极拔除患者均在杂交手术室进行手术,术前均进行风险评估。高风险者行全麻电极导线拔除,其余患者行局麻下电极导线拔除。高风险患者临床评估包括普通电极导线植入>10年,ICD电极导线植入>5年,电极穿孔>1个月,另外麻醉方式还要根据患者年龄及肺部情况综合评定。全麻患者术中食管超声监测,外科团队备用。
术前准备及手术步骤:①所有患者术前禁食8 h、禁水6 h,所有患者留血样及血型,血库备血;②全麻者均用经食管心脏超声监测;③术前常规行双侧经肘静脉造影,观察双侧入路静脉狭窄、闭塞情况,以此推断电极导线与沿途组织粘连程度,以及决定拔除后临时起搏及再植入入路选择;④常规穿刺右侧桡动脉,监测血流动力学,同时完善心电、血氧监测;⑤分离导线与皮下组织的粘连,游离电极导线至静脉入口处,齐根剪去;⑥穿刺股静脉,置入下腔辅助装置,首先用Snare抓捕器弯曲度大的金属环钩抓住电极导线的体部,然后推出小金属环绕过电极体部,穿越前者头端空隙固定,二者共同将导线捕捉固定,回撤牵拉两个金属环,将固定于两者间的电极导线体部纳入鞘管腔内,随后将导线拉出体外。⑦拔除电极导线后,通过血流动力学、影像学(X线影像、经食管心脏超声),评估是否存在心脏破裂、三尖瓣撕裂等并发症。
1.3 手术成功及并发症的定义
根据美国心律学会2009年《经静脉电极导线拔除专家共识》的描述[1],手术完全成功定义:拔除所有的电极导线,无手术相关的永久性并发症及死亡。临床成功的定义:拔除所有的电极导线,或残留部分电极导线但并不影响患者预后,比如电极头端,但不会引起穿孔、血栓形成及持续性的感染事件。失败定义:不能达到完全成功或临床成功,或造成永久性的并发症或存在手术相关的死亡。主要并发症定义为致命性并发症或死亡。次要并发症包括手术相关的事件需要药物或者介入干预。
1.4 统计学分析
采用SPSS17.0统计软件进行数据分析。用均数±标准差对计量资料进行描述,用n(%)对计数资料进行描述。
2 结果
54例患者,年龄(68±13.3)岁,其中男性44例(81.5%),平均植入时间9(2~27)年。其中囊袋感染44例(81.5%)、菌血症5例(9.3%)、感染性心内膜炎3例(5.5%)、电极故障2例(3.7%)。共拔除电极导线110根,其中心房电极45根(40.9%),右室电极57根(51.8%),除颤电极2根(1.8%),左室电极6根(5.5%)。
54例患者中,51例(94.4%)患者(其中1例经上腔途径拔除失败,转由下腔经Snare拔除)达到手术完全成功,1例心室电极头端残留(<4cm),1例心房电极残留(<4cm);1例术中出现心脏穿孔,1例心包压塞,经心包穿刺及多巴胺治疗后缓解。54例患者均达到临床成功,无失败病例。
电极导线植入时间与电极导线拔除成功率明显相关,54例患者中均无电极拔除手术相关的死亡病例。见表1。
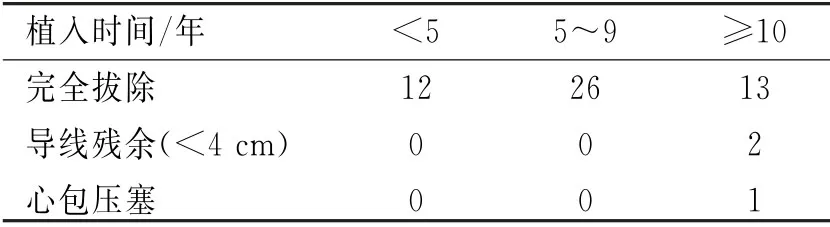
表1 植入时间与电极导线拔除之间的关系
3 讨论
起初经股静脉拔除电极导线主要用于导线脱落或经上腔途径拔除失败的困难病例,特别是电极导线断裂,无法进入锁定钢丝的患者。近年来随着针眼圈套器的出现,经股静脉拔除电极手术变得更为简便易行。1998年Bracke等[3]的研究显示当经上腔应用激光途径拔除电极导线失败时应用Snare拔除电极导线往往十分有效,并且并发症少,成功率高。一项纳入229例电极导线拔除的研究结果显示Snare作为一种安全、有效的电极拔除工具,其临床拔除成功率(电极残端保留小于4 cm)高达98.2%,完全电极拔出率为94.4%,相关并发症发生率为0.7%,无死亡病例[4]。与我中心的研究结果大致相符。
Wazni等[5]的研究表明植入时间与导线拔除的成功率明显相关,电极导线植入时间>10年,其电极拔除失败概率明显增加。本研究入选的病例相对复杂,平均年龄较大(68±13.3)岁,电极植入时间较长9(2~27)年。本研究中植入时间少于10年的患者共38例,均达到手术完全成功,而植入时间大于10年的患者共16例,其中1例电极导线植入20年的患者,心室电极拔除后头端残留,1例导线植入15年的心房电极头端残留,但均未引起患者栓塞、发热等症状。1例植入10年的患者出现电极磨损,在拔除心房电极时出现心脏穿孔及心包压塞,术中心包穿刺后患者逐渐缓解。3例感染性心内膜炎患者,经Snare拔除导线后无明显肺栓塞发生。本研究进一步说明电极导线的拔除与电极导线植入的时间密切相关,植入时间越长,导线在血管及心内膜的纤维化程度就越重,电极拔除风险也越大。术中在使用Snare拔除电极导线时,由于牵拉电极通过鞘管时的作用力主要集中在大小两个金属环的锁定点,牵拉入鞘管时电极导线折叠成双股,因此在拔除过程中可能出现电极导线断裂,尤其是粗大的除颤电极。
本中心电极导线拔除时,除以下三种情况外(第一,植入时间短,可尝试徒手拔除或锁定钢丝辅助下拔除。第二,当患者为起搏器依赖,并且造影显示静脉闭塞时,可选择激光鞘拔除,因其能边拔除边切割粘连组织,更方便桥接。第三,当患者需要保留对侧电极,仅拔除一侧电极时,选择下腔途径很难分离电极,此时可先尝试上腔途径拔除电极。当上腔途径拔除失败时,转为利用Snare可能成功拔除电极导线),所有患者均首选Snare作为拔除工具[2]。我中心在应用Snare拔除电极导线方面积累了丰富的临床经验,在此基础上应用Snare拔除电极导线的手术完全成功率为94.4%,临床成功率为100%,其作为电极导线拔除的首选工具是安全有效的。
但是电极植入时间过长时仍存在电极残留,心包压塞等风险。因此,在临床工作中,经静脉电极导线拔除作为一项高风险、操作复杂的技术,只有在对心脏破裂、肺栓塞、心脏压塞等并发症具有紧急处理能力、拔除工具齐全的前提下才能开展。对于缺乏充分专项培训的中心,应谨慎开展。对于电极导线的处理策略应根据植入时间长短,电极导线情况酌情考虑手术过程中的麻醉方式、拔除工具等,必要时直接选择外科手术拔除。
