心房间的传导径路
2019-03-02鲁菲菲向晋涛杨波
鲁菲菲 向晋涛 杨波
正常的心脏跳动受窦房结兴奋的脉冲控制,窦房结的兴奋经前、中、后结间束(窦房结与房室结的连接)传至房室结,经房室结延搁后激动心室肌;在心室肌激动之前,窦房结的激动直接激动了右心房,与此同时,激动经过房间传导和/或由前结间束发出的房间束(Bachmann束)将激动传导至左房,保证右房与左房、右房与右室、左房与左室、右室与左室的协调活动。可以肯定的说,心脏有四腔,各个腔室激动有先后,时间有长短。研究表明心房间的电传导有多条径路,传导径路的改变或变化或传导时间的延迟,为房性心律失常的发生提供了条件,深入了解心房间的电传导则有助于了解房性心律失常发生的机制。
从理论上讲,心脏的传导系统和心肌都可以进行电的传导,因此,房间传导径路应该包括两种类型的途径[1-4],第一,心脏传导系统途径,由前结间束发出的房间束传导,即由Bachmann束传导。第二,心肌传导径路,即由心房肌或特殊心肌组织或结构传导,研究表明主要为3条途径:①冠状窦(CS)-左房肌束;②卵圆窝周围的横行肌纤维;③心外膜下房间肌束。笔者分述如下。
1 心脏传导系统径路(Bachmann束)
在心血管教科书上,描述心脏的冲动从窦房结传导至房室结是通过3条结间束通路实现的,然而光镜和电镜检查都未发现右房壁有这种能被称之为传导组织通路的特殊管束。除了窦房结尾部偶尔出现的伸入终末嵴的连接,在组织学上未观察到其他可观察到的通路[5]。因此,冲动从窦房结传到房室结是否通过优先传导通路仍尚存争议,只是解剖学证据曾被解释为存在3条心房内通路。前结间束起自窦房结前缘,呈曲线向前绕上腔静脉而进入右房,被称为Bachmann束的前心房内带,该带继续向前走行而到达左房[2]。Bachmann束是一个大的肌束,它是将心脏冲动优先从右房传到左房的一条主要通路[6],其组织学形态见图1[7]。De Ponti等[4]对7例顺向型房室结折返性心动过速患者进行左侧旁道消融后,在患者知情下,通过三维电解剖标测(Carto系统,强生)观察正常人窦房结电兴奋在心房的传播过程,该7例患者无房性心律失常的记录或病史[年龄(37±11岁)]。结果表明,右房的激动向左房传导有2个突破点,一个是前突破(7例均有左房前上部预先激动),此突破点占主要地位,在Bachmann束上传导,显示出独特的“预激式”心内膜激活模式(图2)。另一个是后突破(只有5例有左房后壁预先激动),此与解剖学上的房间后中部位的传导连接相对应。后突破独立于前突破,有自己激动的波阵面,但激动的范围小于前突破。说明从三维电解剖标测激动可清楚显示左房至右房的传导的2条途径,Bachmann束的传导占主要方面,与Bachmann束插入左房的前上壁有关。Markides等[8]采用三维非接触标测系统(EnSite 3000)对19例阵发性心房颤动(简称房颤)患者[年龄(55±10岁)]在窦性心律期间,标测左房的激动电扩布的整体过程。结果发现左房最早激动突破点在左房前上壁者有7例(37%),与Bachmann束的位置相关;而最早激动突破点在后间隔者有10例(53%),此与右肺静脉口临近;突破点在卵圆窝或二尖瓣隔侧只有2例(10%)。肾上腺素和高位右房起搏不改变上述突破点传导所占病例的比例。说明在特定的人群中Bachmann束不是房间传导的主要途径,此可能与房性心律失常的发生相关。
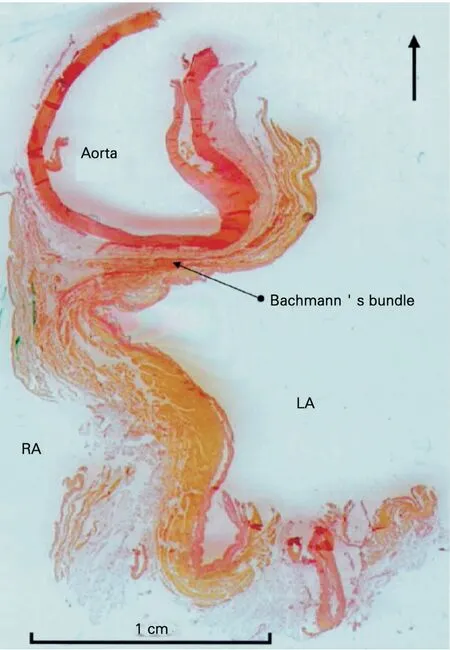
图1 房间隔组织学切片所见的Bachmann束形态特征(Gieson's染色)[7]
Platonov等[7]对27例尸检的心脏进行房间传导路径的形态学研究,观察了15例心脏(7例房颤和8例非房颤)房间肌束的组织学连接特征。结果发现,在15例心脏中,系列切片显示只有7例(房颤3例,非房颤4例)有被称作Bachmann束的前连接,并且有1例Bachmann束被脂肪组织分隔为2条,有2例由Bachmann束分出一支至房间隔;另8例在前壁峡部和主动脉壁之间未见横穿的肌束。研究提示,一半的患者缺少Bachmann束的前连接,而脆弱的后连接(见后述)可能是更易发展为房间传导阻滞和房颤的原因。
2 心肌传导径路
2.1 CS-左心房肌束 CS定义为心脏静脉系统的一部分,按血流方向,其起始于Marshall斜静脉的插入端,止于右房的开口部。口部为右房心内膜突然的转向部位,口部常覆盖有CS瓣(Thebesian瓣),当有Vievssens瓣存在时,此瓣附着于心脏静脉处即为CS起源与心大静脉的交界处。CS长度约32 mm左右,如图3所示[9]。Chauvin等[9]对非心脏性死亡的10例患者的尸检心脏进行组织学染色、切片,观察心脏CS与左房的肌肉连接。采用大切片机切片,截面可高达125 mm×85 mm,每个截面包括沿CS长轴方向上的整个CS,以及垂直于瓣环水平的心外膜,切片厚4 mm。结果发现,所有标本CS的静脉壁均被连续的横纹肌包绕,这种包绕从CS口一直延伸至CS内25~51mm[平均(40±8)mm],其终止点距Vievssens瓣平均(3.4±3.2)mm。这种沿长轴延伸的肌袖不直接与左房心肌相连。在CS肌袖与左房心肌之间有脂肪组织将其分隔开来,脂肪组织远离CS口之后越来越细,其间被横纹肌纤维穿越。所有心脏标本都存在CS心肌与左房心肌的连接,在所有观察的连续相邻的切片中,总有≥1个连接方式,其CS心肌总是以斜插或直接向左与左房肌相连(如图4)。
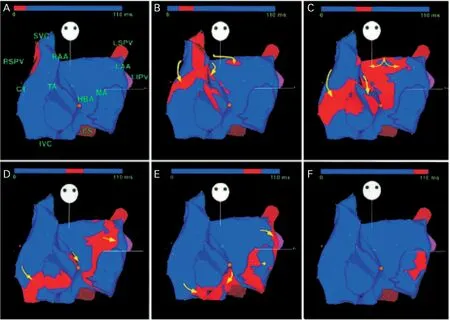
图2 窦性激动引起的右房和左房兴奋扩布顺序(前后观)[4]
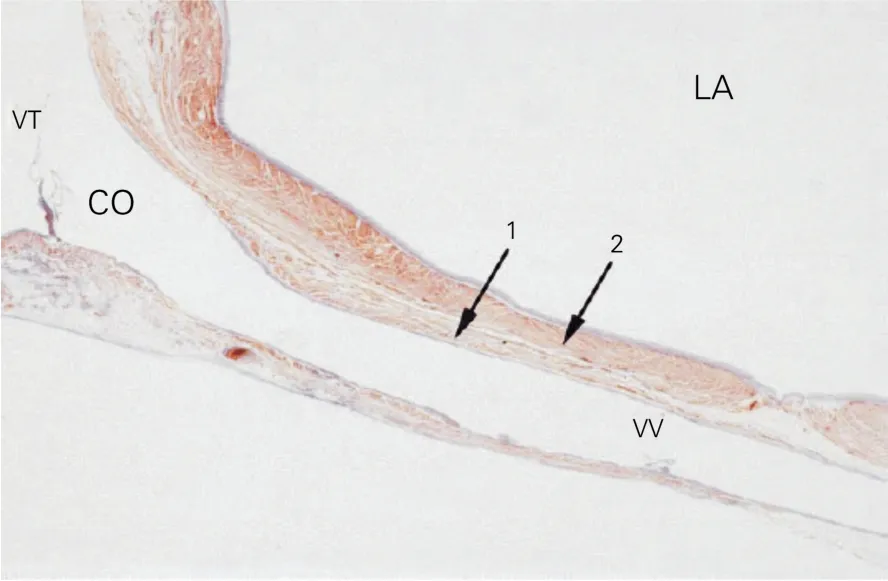
图3 CS的起止(长度)[CS长轴纵切面(低倍放大,Masson's染色)][9]
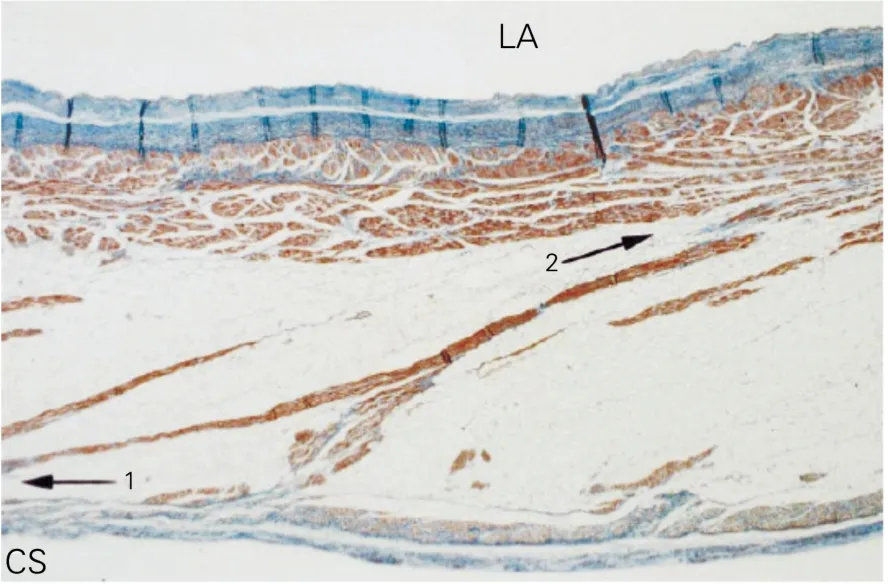
图4 CS肌袖与左房心肌的连接[CS长轴纵切面(高倍放大,Masson's三色染色)][9]
Mitrofanova等[2]研究人类的房间下部传导径路解剖学,获取了21例心脏尸检样本(其中7例死于急性心肌梗死,4例为不明原因的猝死),进行人类心脏的下房间传导途径的解剖学观察,房间隔切片标本包括房间隔、与房间隔相邻部分以及CS口部至右房的部分。结果表明,20例标本的心房横纹肌向CS近端部分延伸并覆盖,形成心肌袖,可见在CS与左房之间有心肌相连。作者认为这种类型的连接可以提供右房下部和左房下间隔区的电传导径路。
Lemery等[10]为了解房间连接和房间隔在双房电偶联中的作用,选择20例有症状的房颤患者,在房颤导管消融之前,采用非接触三维标测系统(Endocardial Silutions Inc)对双房同时进行激动标测,多极电极阵列导管分别放置于左房(穿间隔)和右房,等时标测,等电位图显示18例患者右房和左房的间隔部心内膜活动是彼此分离的、独立的和不同步的。所有病例房间传导与心房最初激动部位相关,显示在窦性心律,高右房起搏和左房起搏之下,其传导是通过Bachmann束传导的。所有的病人在CS远端起搏时,通过房间连接的传导发生在CS水平,而经过Bachmann束传导的仅占26%(5/19),只有2例(2%,116分段分析)房间传导是经过卵圆窝。研究提示CS与左房的肌性连接是仅次于Bachmann束的双房电偶联的通道。
Kasai等[11]为弄清人类CS肌肉和左房心肌的连接传导特性,选取了30例患者[(5例阵发性房颤,13例心房扑动(简称房扑),11例室上性心动过速)]作为研究对象,将极间距为2 mm的电极放入CS内,近端电极位于CS口,采用CS远端、近端起搏方法,观察剩下的4对双极电极记录的电图并进行分析,结果表明,进行CS远端起搏时,发现有3种类型的电图(远端出现双电位分离、碎裂电位及单电位),分别定义为远端CS-左房传导阻滞(n=9)、延迟(n=8)和正常(n=13)。而CS近端起搏时,22例则没有双电位出现,另8例出现双电位者,其双电位间距和振幅不恒定。远端阻滞和延迟者中结构性心脏病和房颤和房扑所占的比例大,而且房颤和房扑的病程长,CS远端的不应期短。作者认为CS和左房的电传导的分离提示CS和左房之间结构上松散的连接与房性心律失常的发生相关。
Ndrepepa等[12]选择9例房颤和房扑的患者,研究房颤和房扑时CS和左房的传导关系,左房放置64极网篮电极导管,CS内放置多极电极导管,右房放置24极电极导管进行电生理试验,结果显示8例患者在房颤发作时,CS记录出现稳定的双电位;在心律失常持续时,9例右房活动有序,而7例左房后壁电位不协调,2例是协调的,1例出现逆时针折返性房扑,涉及CS与右房后壁的激动分离,另1例大折返性房性心动过速累及CS肌肉。近端CS快速起搏和额外刺激会引发所有患者CS活动的纵向分离。结果提示自发的房性心律失常和CS近端刺激能引起CS和左房后壁的电分离。
2.2 卵圆窝周围的横行肌纤维 右房间隔和左房间隔的心内膜面的电活动是两个独立的、分离激动体系[10]。一些研究表明,房间传导径路的变化与房性心律失常的发生相关[7,11]。Schwartzman等[3]希望通过消融右房间隔面削弱房间传导,达到治疗房性心律失常的目的。其研究选择13只猪作为实验标本,消融右侧房间隔区域,6只猪首先消融1区(界嵴及周围组织),再接着消融2区(卵圆窝及CS口周围),见图5。另7只猪则行序贯相反的消融,结果,消融1区后,房间传导减弱,但未发生阻滞;消融2区后,没有影响房间传导;两个区域都消融后,4只出现了完全性阻滞并左房静止,剩下的9只,在窦性心律和起搏下,出现不完全性阻滞和明显的传导速度减慢,病理分析提示2区的消融是造成完全性房间传导阻滞的原因。其中卵圆窝在房间传导中有一定的作用和地位。
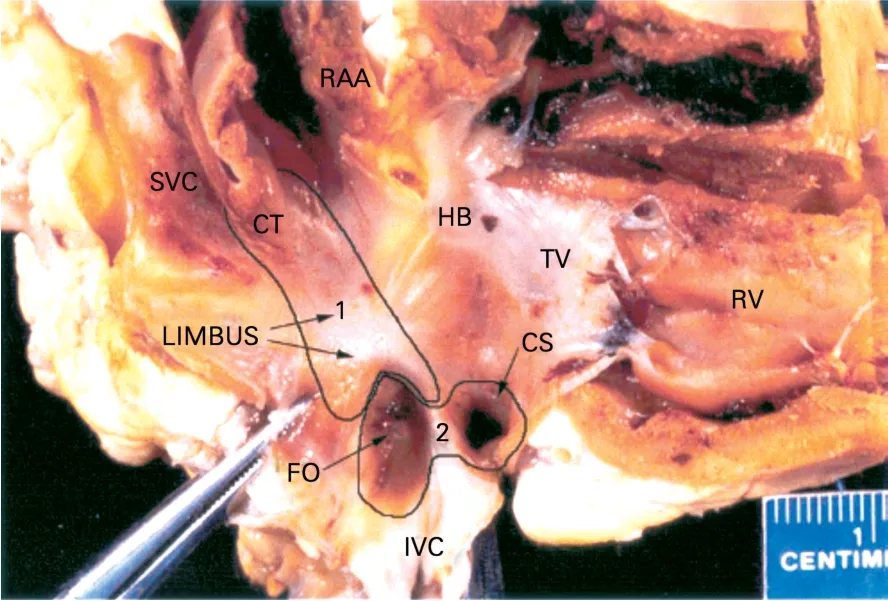
图5 心脏标本右房间隔心内膜面[2]
Markides等[8]通过不同条件下(窦性心律、高位右房起搏、右房房间隔起搏)观察房间传导途径的变化,结果显示,19例阵发性房颤患者在窦性心律时,只有1例(1%)房间传导经过卵圆窝途径,但在房间隔起搏时,经卵圆窝途径行房间传导者为66.7%(8/12例)。高位右房起搏时,只有2例经卵圆窝途径传导(2/14例)。说明心房起搏点的变化,尤其是间隔部的房性异位搏动易经卵圆窝途径完成房间传导,可能引发更复杂的房性心律失常。与Markides等研究的不同,Calo等[13]研究人类心脏在左房起搏时的经间隔部的电活动情况,即左房如何向右房传导电活动,因为大多数的房颤起源于左侧的肺静脉,此有助于揭示房颤发生的电机制。该研究选择12例患者(其中5例有阵发性房颤病史,7例无结构性心脏病证据),在进行左房不同部位起搏时,在右房安置非接触三维标测系统(EnSite 3000)标测心房间隔的最早激动部位。右房内的Bachmann束、卵圆窝、CS口的位置通过血管内超声确认。结果发现在左房间隔和右上肺静脉起搏时,有95%的患者最早激动处为卵圆窝;在左心耳、左房顶部和后上壁起搏时,有94%的患者最早激动处在Bachmann束区域;在所有的病例中,在右下肺静脉、右房下后壁和CS远端起搏时,最早激动处为CS口(单独或与卵圆窝一起),详见表1。起搏的周长不影响经间隔的传导。因此左房的兴奋大多数可或与其他途径一起经过卵圆窝传导至右房。因此,卵圆窝的左向右的电扩布可与房性心律失常的发生相关。
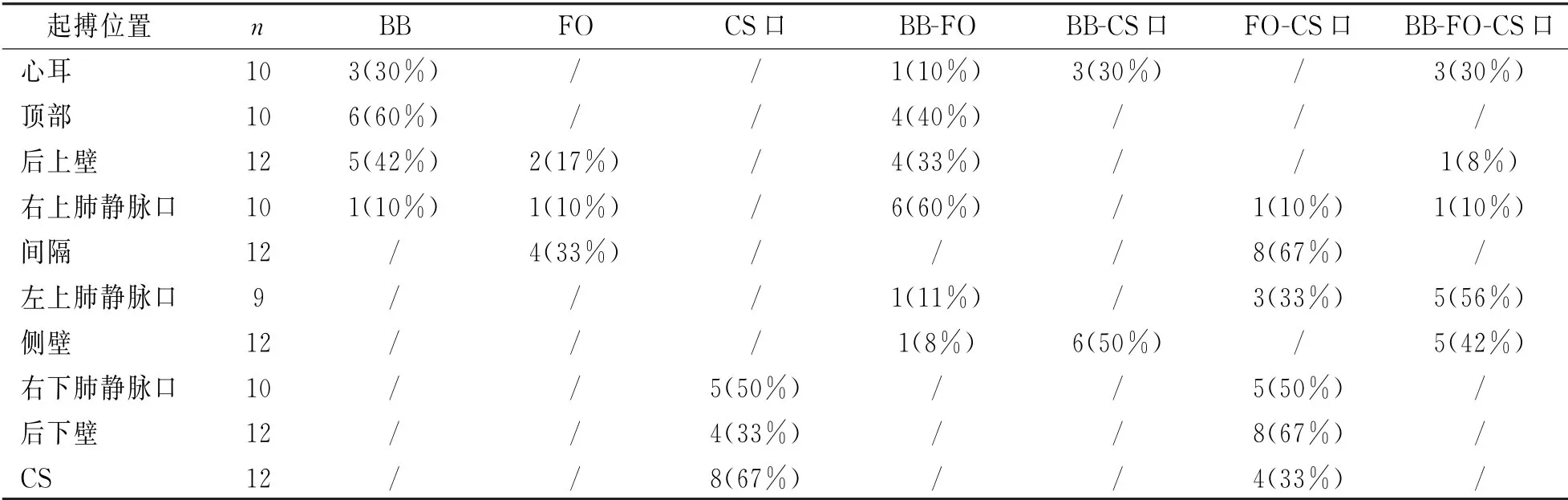
表1 采用500 ms周长起搏左房不同部位时房间隔最早电扩布的位置的例数分布
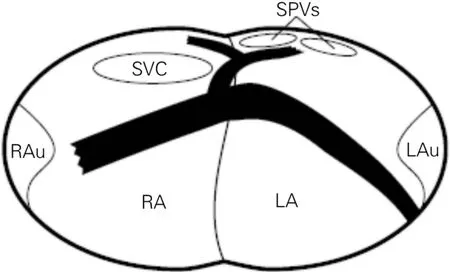
图6 心外膜下心房表面肌束连接(前连接)走向示意图(前上观)[14]
2.3 心外膜下房间肌束 心外膜下肌束是指在心脏外膜面凸起的肌束,连接左右心房的肌束称之为房间肌束。Kozłowski等[14]对房间肌束进行研究,选取15例心脏标本,且排除了病理性或先天性疾病的心脏,通过立体显微镜制备心房壁,为便于精确观察,剔除心包和脂肪组织,结果显示,在所有心脏中,都可观察到大的肌束,其从上腔静脉口的下方沿右房前壁逐渐下降,转向左房行走的肌束分为两支,其中一支加入心房后壁的上支;另生一支在房间隔上面走行,在上肺静脉之间融入左房上部表面的心房肌。前束的另一个分支穿过心房的前壁汇入左心耳出口下部区域中的左房心肌中(图6)。房间的优势传导Bachmann束始终与心房前壁分支相连。在心房面壁可辨识出三种类型的房间束(单、双和三束),所有的分支都是从上腔静脉的出口下部开始,并且在房间隔上斜向上走行,在左房的后上面融入左房心肌。其中最常见的为双束,其次为三束,最少见的为单束(分别有9、5、1例),其结构走行如图7。Platonov等[7]对7例正常的心脏标本,剔除房间沟后面的心外膜脂肪组织,观察大体心脏外的房间肌束,也发现了房间沟(后壁房间)不同类型的肌束连接,有多束,也有单束。该作者结合光镜对房间隔组织学切片观察,将心房后壁的肌束连接,按心房壁的连接方式分为两类:①一类是整条在心外膜脂肪之下与心房壁毗连并汇入心房壁心肌的肌束;②另一类是“桥”连接,连接心房后壁的两个部位(例如一边在右侧,而另一边在房间沟的左侧),而肌束与心房壁之间充满心外膜脂肪。研究表明,CS-左房肌束有一部分表现为心房下后壁的心外膜下连接[7,11-13]。
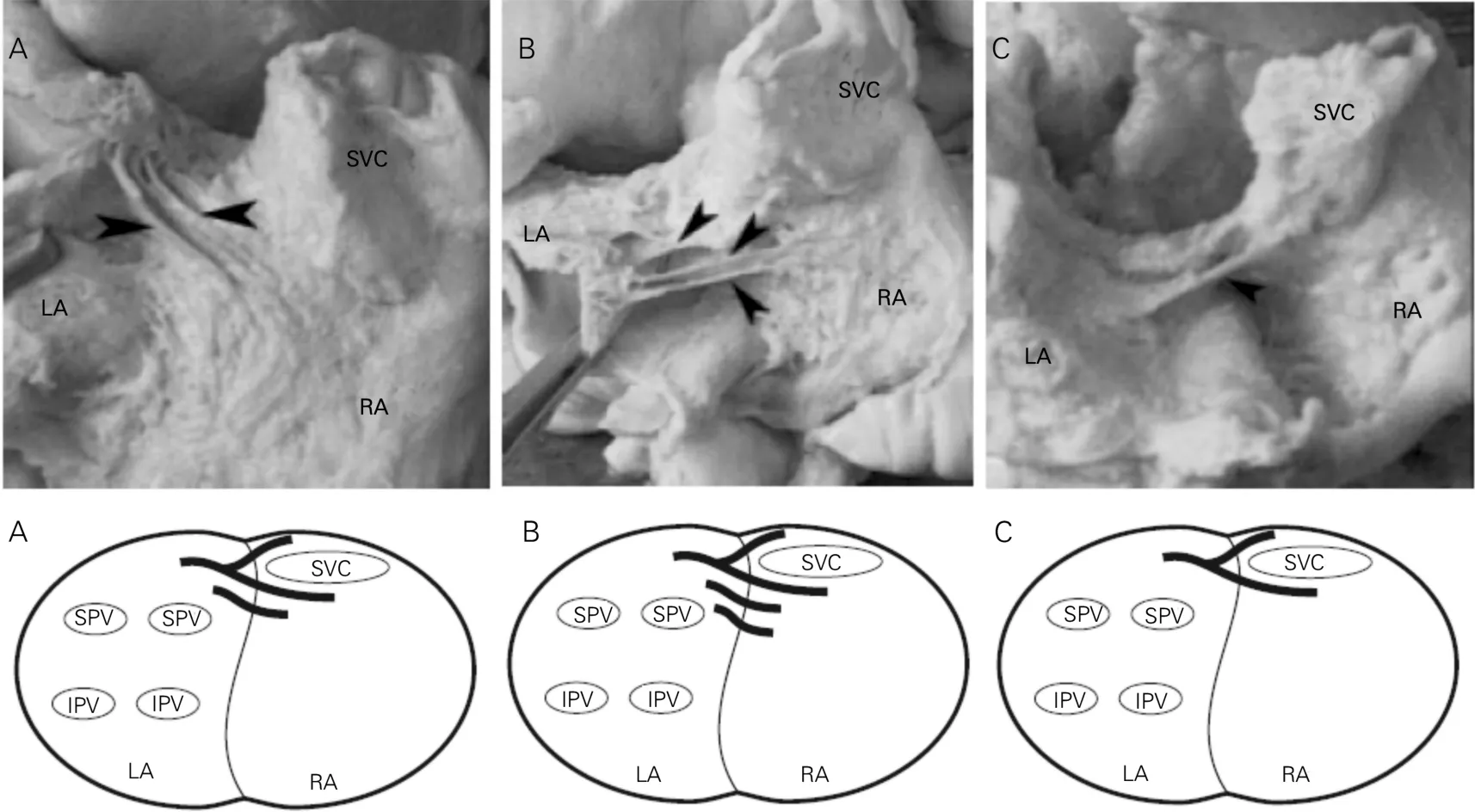
图7 心外膜下心房后壁表面的肌束连接(后连接)实体(上)及示意图(后面观)[14]
3 结语
房间传导可能不存在传导系统的传导,都是经过心肌的传导,心房某些部位的传导速度比其他部位更快,如Bachmann束,原因可能是由于心肌纤维的走向、大小和几何形态的不同所致,形态学和功能的研究揭示了房间传导途径的复杂性。
