一种新型高脂血症易感大鼠的血脂水平与心血管并发症
2019-03-01马全鑫陈姣姣郁晨张利棕寿旗扬陈民利
马全鑫,陈姣姣,郁晨,张利棕,寿旗扬,陈民利
(浙江中医药大学动物实验研究中心/比较医学研究所,杭州 310053)
大鼠在代谢性疾病研究中是一种使用广泛的实验动物,但由于大鼠本身脂代谢的特性,血脂水平往往很低[1-2]。普通SD或Wistar大鼠经高脂饲料后血脂水平有一定的上升,但总胆固醇(total cholestrol,TC)浓度依然维持在5.0 mmol/L以下[3-6],无法达到临床上普遍认为的≥5.72 mmol/L高血脂状态[7],因此在高脂血症的研究中具有较大的局限性。
本课题组在实验研究中,偶然发现了一只Wistar大鼠在4周高脂饲料诱导后血脂升高异常,其血清TC浓度高达20.26 mmol/L,而此时同一批次的其余Wistar大鼠TC平均值仅为(2.20 ± 0.34) mmol/L。考虑到SD大鼠繁殖力强,将该大鼠与SD大鼠交配后进行保种传代。我们初步研究发现其后代大鼠在饲喂普通饲料时,血脂水平与普通大鼠无显著差异,但经过高脂诱导,雌性大鼠TC水平基本在5.0 ~ 14.9 mmol/L之间,虽然低于始发现的大鼠,却远远高于其他普通大鼠高脂诱导后的血脂水平。我们将其后代命名为Wistar-SD高脂血症易感(Wistar-SD hyperlipidemia)大鼠,简称WSHc大鼠。
本实验取第四代WSHc雌性大鼠,观察其经高脂饲料诱导后不同阶段血脂的变化情况及心血管并发症,并与Wistar大鼠进行对比,以了解WSHc大鼠血脂变化的一般规律,探讨 WSHc大鼠的应用范围及科研价值。
1 材料与方法
1.1 材料
1.1.1 实验动物
SPF级雌性Wistar大鼠20只,7 ~ 8周龄,来源于上海斯莱克实验有限公司 【SCXK(沪)2017-0005】;SPF级雌性WSHc大鼠30只,7 ~ 8周龄,来源于封闭繁殖的WSHc第四代大鼠,随机挑选雌性动物进行试验,饲养于浙江中医药大学动物实验研究中心屏障实验室【SYXK(浙)2013-184】,环境温度:(22 ± 2)℃,相对湿度:50% ~ 60%,光照:12 h/12 h明暗交替,噪声 < 50 dB;在IVC笼内饲养,自由饮食。在实验过程中按实验动物使用的“3R”原则给予人道的关怀。浙江中医药大学实验动物伦理审查委员会通过(ZSLL-2017-045)。
1.1.2 主要试剂和仪器
TC,三酰甘油(triglyceride,TG),低密度脂蛋白胆固醇(low-density lipoprotein cholesterol, LDL-c)和高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-c)检测试剂,均购自上海德赛诊断系统有限公司;HE与Masson染色试剂盒,购自珠海贝索生物技术公司;TUNEL染色试剂盒,购自罗氏公司。
7020全自动生化分析仪(日本日立公司); Thermo多功能酶标仪(美国Thermo公司);AL204-电子分析天平(瑞士Mettler公司);Nana Zoomer 2.0 RS数字切片扫描设备(日本滨松公司);HM335E半自动石蜡切片机(德国Microm公司);自动染色机(德国Leica公司),小动物麻醉呼吸麻醉机(美国Summit公司); vevo1100 小动物超声影像系统(日本Fujifilm 公司)。
普通基础饲料购自南京爱立默科技有限公司,辐照全营养颗粒饲料。
高脂饲料配方:胆固醇1%、猪油10%、蛋黄粉10%、3号胆盐0.5%、基础饲料78.5%。
1.2 实验方法
1.2.1 实验动物分组
取20只7 ~ 8周龄的SPF级雌性Wistar大鼠,随机分为2组,分别饲喂普通饲料(general feed,G)和高脂饲料(high-fat feed,HF),每组10只,即Wistar + 普通饲料组(Wistar+G)和Wistar + 高脂饲料组(Wistar + HF)。取30只7~8周龄的雌性WSHc大鼠,随机取其中10只饲喂普通饲料,即WSHc + 普通饲料组(WSHc+G),另20只饲喂高脂饲料,即WSHc + 高脂饲料组(WSHc + H)。
1.2.2 生化指标检测
各组大鼠在饲喂2、4、8、12、16周时过夜禁食,采血并分离血清,使用全自动生化仪检测TC、TG、HDL-c和LDL-c含量。
1.2.3 心动超声检测
饲喂16周时,大鼠异氟烷吸入麻醉,使用高分辨率小动物超声影像系统测量左室舒张末期室间隔厚度(interventricular septum,IVS,d)、左室收缩末期室间隔厚度(IVS,s)、左室后壁舒张末期厚度(left ventricular posterior wall,LVPW, d)、左室后壁收缩末期厚度(LVPW,s),射血分数(ejection fraction,EF)、每分钟输出量(cardiac output,CO),在 2 ~ 3 个心动周期上测量各指标并取其平均值,并由软件测算左心室质量,并与体重相比得左心系数(left ventricular index,LVI)。
1.2.4 病理组织学观察
饲喂16周后,对各组大鼠实施安乐死,取心和胸主动脉。心脏置于4%中性甲醛固定24 h后分别行Masson染色和TUNEL染色,主动脉组织行HE染色,具体操作步骤按试剂和说明书要求。
1.3 统计学方法
2 结果
2.1 WSHc大鼠血脂动态变化情况
由图1可见,高脂饲喂2周后,与正常对照组比较,WSHc大鼠与Wistar大鼠血清TC与LDL-c差异有显著性(P< 0.05);高脂饲喂的WSHc大鼠TC、LDL-c水平为:(6.34 ± 2.12)、(2.56 ± 0.94)mmol/L,而高脂饲喂的Wistar大鼠TC、LDL-c水平仅为(2.93 ± 0.23)、(0.63 ± 0.12)mmol/L。高脂饲喂期间,与Wistar大鼠相比,WSHc大鼠血清TC、LDL-c和HDL-c差异有显著性(P< 0.05),但TG差异无显著性 (P> 0.05)。
高脂诱导的WSHc大鼠血脂动态变化表现为:TC和LDL-c在第2周时开始显著升高,在4 ~ 12周内均维持于高水平范围内波动,其中,在高脂饲喂至8周时达到高峰,16周时稍有下降;TG与HDL-c维持于相对稳定的状态。
2.2 WSHc大鼠心动超声影像学变化
经心动超声成像检测发现,与Wistar + 高脂饲料组大鼠相比,WSHc + 高脂饲料组大鼠LVI、IVS, s和LVPW, s差异有显著性(P< 0.05),见表1。WSHc+高脂饲料组大鼠EF差异有显著性(P< 0.05),收缩舒张生理曲度有一定的改变,而各组大鼠CO差异无显著性(P> 0.05),见图2,3。
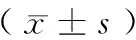
表1 不同组别大鼠左心结构的比较Table 1 Comparison of the left ventricular structures in the different groups of rats
注:不同字母表示差异有显著性(P< 0.05)。
Note. Different letters indicate significant differences(P< 0.05).
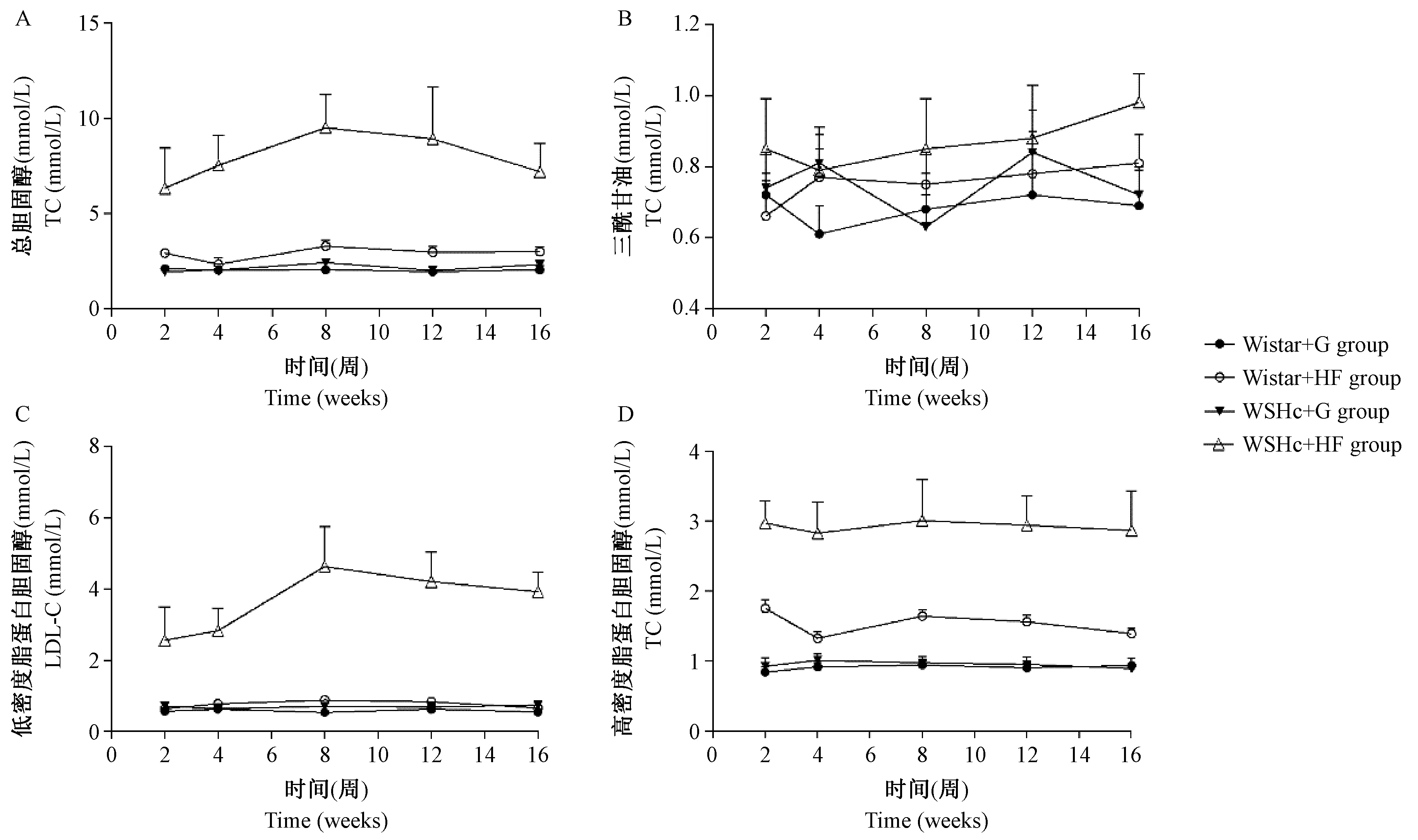
图1 高脂饲喂各阶段不同组别的大鼠血脂水平变化Figure 1 Changes of plasma lipid levels in the rats of different groups at high-fat fed stage
注:A: 射血分数;B: 每分钟输出量. 不同字母表示差异有显著性(P< 0.05)。图2 不同组别大鼠心功能的比较Note. A. EF. B. CO. Different letters indicate significant differences(P<0.05).Figure 2 Comparison of the cardiac function in the different groups of rats

注:A:Wistar+普通饲料组大鼠;B:Wistar+高脂饲料组大鼠;C:WSHc+普通饲料组大鼠;D: WSHc+高脂饲料组大鼠。下图同。图3 不同组别大鼠心动超声影像学比较Note. A. Wistar+ General fed rat. B. Wistar+ High fat fed rat. C. WSHc+ General fed rat. D. WSHc+ High fat fed rat. The same in the following figures.Figure 3 Comparison of echocardiographic images in different groups of rats
2.3 WSHc大鼠心脏病理变化
由Masson染色结果可见,饲喂正常饲料的大鼠心肌组织中仅在冠脉及微血管周边可见蓝色着色,而非胶原纤维着色,而Wistar大鼠+高脂饲料组大鼠心肌组织中心肌细胞较疏松,被少量的胶原纤维分割呈现“网筛状”,WHSc大鼠+高脂饲料组心肌组织中有大量蓝色的胶原纤维呈片状分布,心肌间质胶原纤维过度沉积,见图4。由TUNEL染色结果可见,WHSc+高脂饲料组大鼠心肌组织中,有大量细胞核被染成棕色,而其余各组心肌阳性染色的细胞较少,说明WHSc大鼠经高脂诱导后,心肌细胞凋亡率上升,见图5。
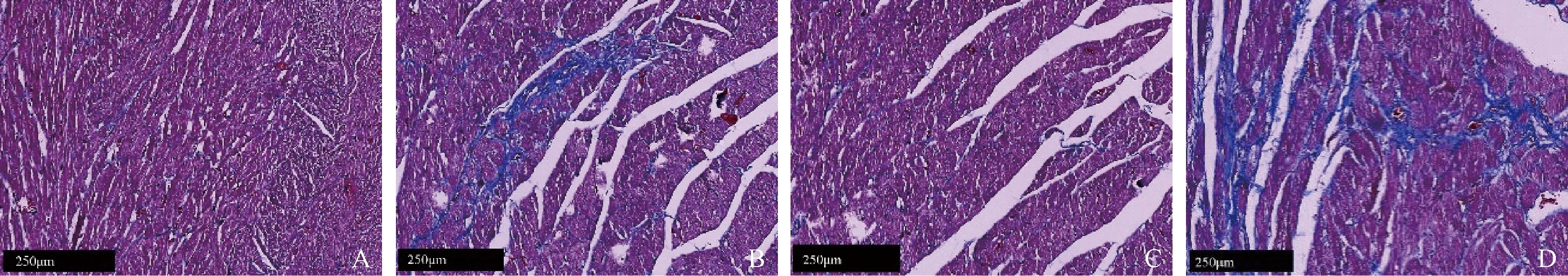
图4 不同组别大鼠心肌纤维化情况(Masson染色)Figure 4 Myocardial fibrosis in different groups of rats (Masson staining)
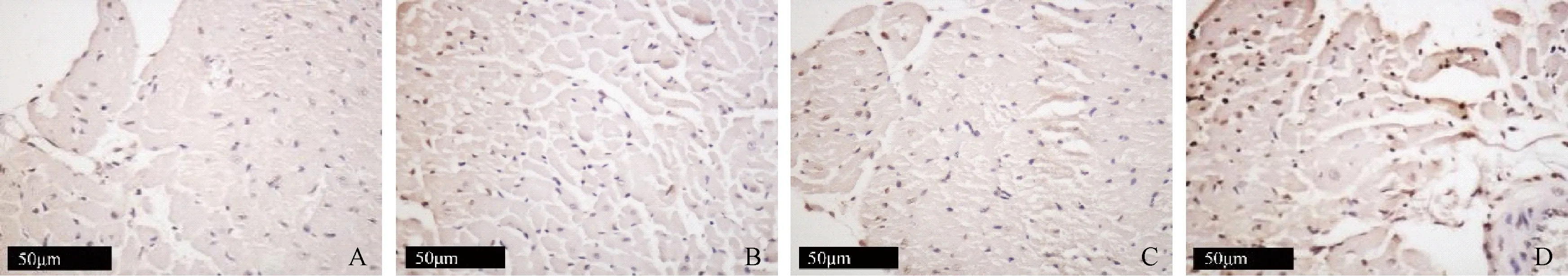
图5 不同组别大鼠心肌细胞凋亡情况(TUNEL染色, ×400)Figure 5 Apoptosis in myocardial cells in different groups of rats (TUNEL staining,×400)

图6 不同组别大鼠主动脉病变情况(H&E染色, ×400)Figure 6 Aortic lesions in the different groups of rats (H&E staining,×400)
2.4 WSHc大鼠主动脉病变情况
饲喂普通饲料的两种大鼠均主动脉管腔内膜平整光滑,中膜可见梭形平滑肌细胞,弹力纤维层结构清晰完整,外膜为疏松结缔组织,未见明显病理改变;WSHc+高脂饲料组大鼠主动脉内膜明显增厚,内弹力板排列紊乱变性坏死,脂质斑块内可见泡沫细胞和炎性细胞聚集,形成了动脉粥样硬化早期斑块;Wistar+高脂饲料组大鼠未见明显斑块,内膜增厚程度较小。见图6。
3 讨论
高脂血症一般是指血液中的TC和(或)TG高于正常值,临床上普遍认为TC浓度大于5.72 mmol/L即为高脂血症[7-8]。我国常用大鼠制备高脂血症动物模型,大鼠在脂质代谢研究中是一种使用广泛的实验动物,具有价廉、便于饲养、取血方便、有着明确的遗传背景等优点,普遍运用于降脂药物的研究。但大鼠体内血胆固醇的清除率明显高于人类,不易产生高脂血症,也不易形成动脉粥样硬化[9-10]。普通大鼠饲喂高脂饲料虽然与正常大鼠比较有显著升高,但升高的幅度有限,国内外发表的研究报道中显示,用含0.5% ~ 2%胆固醇的高脂饲料诱导建立的高脂血症SD大鼠血浆TC水平在2.5 ~ 4.5 mmol/L之间[4,6],而Wistar大鼠高脂诱导后TC水平仅在2.0 ~ 3.0 mmol/L之间[11-12]。由此可见,普通大鼠高脂诱导后的血脂水平与人类的高脂血症的血脂水平差异较大。
WSHc大鼠是本实验室偶然发现并培育的新型高脂血症易感大鼠,本实验研究发现,雌性WSHc大鼠经高脂饲喂2周时,80%大鼠的血清TC值大于5.0 mmol/L,在高脂饲喂第8周时达到峰值,在第16周时稍有下降,但基本上保持稳定,始终处于高于临床诊断标准的高血脂状态。造成WSHc大鼠高脂饲喂期间血脂的波动情况可能与胆固醇的吸收排泄稳态有关,这与本实验室建立的高脂血症动脉粥样硬化小型猪动物模型的血脂变化情况相似[13]。
高脂血症常常引起心脏功能失衡,利用无创的心动M型超声检测可动态观察心肌增厚及心脏功能的改变。IVS及LVPW反应了心肌增厚的情况,而EF、CO反应了心脏的收缩功能和泵血功能。本实验发现,WSHc大鼠经高脂诱导,左心系数增大,室壁增厚,EF上升,但实际每分钟输血量并未明显升高,提示大鼠出现了左心室重构,且出现代偿性心功能增强的症状。
为了进一步探讨心肌的病变情况,我们对WSHc大鼠心肌组织进行了Masson染色及TUNEL染色,以观察心肌纤维化程度和心肌细胞凋亡情况。当心脏长期压力负荷过重时,心肌细胞发生代偿性肥大,心肌间质产生具有较强抗张能力的I型胶原,且随着血流动力学改变、血管紧张素II产生过多等因素,刺激凋亡基因活化和凋亡蛋白的合成,使心肌细胞凋亡明显增加[14]。因此,细胞凋亡和心肌胶原的产生参与了左心重构过程。本实验研究发现,高脂诱导的WSHc大鼠心肌细胞凋亡水平显著上升,心肌细胞发生水肿,细胞核增大,排列紊乱,并有明显的胶原沉积。提示高脂饲料诱导WSHc大鼠易形成左室重构及心肌纤维化,与手术造模方法相比,具有简便易行的优势,是较好的研究左心肥大的动物模型。
目前普遍认为TC和LDL-C过高是导致动脉粥硬化的重要因素[15]。WSHc大鼠经高脂饲料诱导16周时,出现内膜增厚、平滑肌细胞排列紊乱、泡沫细胞和炎性细胞浸润等动脉粥样硬化早期斑块,而在高脂饲喂的Wistar大鼠主动脉组织中未见明显的病变。可见WSHc大鼠易造成早期动脉粥硬化疾病模型,但要形成成熟的动脉粥样硬化斑块,还需要进一步实验研究,寻找稳定可行的实验方法,如改变饲料配方、延长实验周期及注射促动脉粥样硬化物质等。
综上所述,WSHc大鼠经高脂饲料诱导,能较快地形成高脂血症,且血脂水平与临床高脂血症水平接近,是一个新型的高脂血症疾病模型动物;同时发现,WSHc大鼠易形成左心室重构和早期动脉粥样硬化等心血管并发症,具有一定的研究价值和开发前景,其发病机制和遗传特点需要进一步实验研究。
参考文献
[1] 王燕萍,彭丹虹,刘晓琪,等.高脂饮食喂养建立高脂血症模型的验证及规律探讨[J].中国比较医学杂志,2017,27(01):5-10.
Wang YP, Peng DH, Liu XQ, et al. Verification and regularity of hyperlipidemia model fed by high fat diet [J]. Chin J Comp Med, 2017, 27(01): 5-10.
[2] 李艳,宋亚刚,苗明三,等.基于高脂血症临床病症特点的动物模型分析[J].中华中医药杂志,2018,33(08):3557-3561.
Li Y, Song YG, Miao MS, et al. Analysis of animal models based on the characteristics of hyperlipidemia clinical symptoms [J]. Chin J Tradit Chin Med, 2018, 33 (08): 3557-3561.
[3] Lee S, Keirsey KI, Kirkland R, et al. Blueberry supplementation influences the gut microbiota, inflammation, and insulin resistance in high-fat-diet-fed rats [J]. J Nutr, 2018, 148(2): 209-219.
[4] Wu Q, Li S, Li X, et al. Inhibition of advanced glycation end-product formation by lotus seedpod oligomeric procyanidins through RAGE-MAPK signaling and NF-κB activation in high-fat-diet rats [J]. J Agr Food Chem, 2015, 63(31): 6989-6998.
[5] 吴晶魁, 杨乔. 中药水蛭对高脂血症大鼠脂质代谢及肝脏的影响 [J]. 中国中药杂志, 2018, 43(04): 794-799.
Wu JK, Yang Q. Effects of traditional Chinese medicine leech on lipid metabolism and liver in rats with hyperlipidemia [J]. Chin J Tradit Chin Med, 2018, 43(04): 794-799.
[6] 周朋辉, 张静姝, 王晓军, 等. 核黄素对高脂血症大鼠血脂水平的影响 [J]. 中国慢性病预防与控制, 2014, 22(6): 662-664.
Zhou PH, Zhang JW, Wang XJ, et al. Effects of riboflavin on blood lipid levels in hyperlipidemia rats [J]. Chin J Prev Control Chronic Dis, 2014, 22(6): 662-664.
[7] 诸骏仁,高润霖,赵水平,等.中国成人血脂异常防治指南(2016年修订版) [J].中国循环杂志, 2016, 31(10): 937-953.
Zhu JR, Gao RL, Zhao SP,et al.Guidelines for prevention and treatment of dyslipidemia in Chinese adults (2016 revised edition) [J]. Chin J Circ, 2016, 31(10): 937-953.
[8] Kim ES, McCormack PL. Icosapent ethyl: a review of its use in severe hypertriglyceridemia [J]. Am J Cardiovasc Drugs, 2014, 14(6): 471-478.
[9] 张安邦,黄昕,李令根,等.复合方法制备SD大鼠动脉粥样硬化模型[J].中国中西医结合外科杂志, 2015, 21(03): 282-285.
Zhang AB, Huang X, Li LG, et al. Preparation of atherosclerosis model in SD rats by composite method [J]. Chin J Surg Integr Tradit West Med, 2015, 21(03): 282-285.
[10] Russell JC, Proctor SD. Small animal models of cardiovascular disease: tools for the study of the roles of metabolic syndrome, dyslipidemia, and atherosclerosis [J]. Cardiovasc Pathol, 2006; 15(6): 318-330.
[11] Madariaga YG, Cardenas MB, Irsula MT, et al. Assessment of four experimental models of hyperlipidemia [J]. Lab Anim, 2015, 44(4): 135-140.
[12] 王义勇. 高脂血症对大鼠基因组 DNA 及 bcl-2 甲基化的影响 [D]. 宁夏医科大学, 2012.
Wang YY. Effect of hyperlipidemia on genomic DNA and bcl-2 methylation in rats [D]. Ningxia Medical University, 2012.
[13] 马毅超,潘永明,陈亮,等.胰岛素抵抗动脉粥样硬化小型猪模型的研究 [J].中国比较医学杂志, 2014, 24(01):12-17.
Ma YC, Pan YM, Chen L, et al. Study on insulin resistance atherosclerosis miniature pig model [J]. Chin J Comp Med, 2014, 24(01): 12-17.
[14] 贺滟, 贾蝉忆, 韩勇, 等. CaMK Ⅱ介导20-HETE诱导的乳鼠心肌细胞凋亡及肥大作用研究 [J]. 遵义医学院学报, 2017, 40(05): 475-481.
He W, Jia YY, Han Y, et al. CaMK II mediated 20-HETE-induced apoptosis and hypertrophy of neonatal rat cardiomyocytes [J]. Acta Acad Med Zunyi, 2017, 40(05): 475-481.
