CRISPR/Cas9基因编辑系统的发展及其在医学研究领域的应用
2019-03-01朱佩琪蒋伟东
朱佩琪, 蒋伟东, 周 诺*
(1.广西医科大学附属口腔医院,南宁 530021;2.广西口腔颌面修复与重建研究自治区级重点实验室,南宁 530021;3.广西颅颌面畸形临床医学研究中心,南宁 530021;4.颌面外科疾病诊治研究重点实验室(广西高校重点实验室),南宁 530021)
近几十年来基因编辑技术发展迅速,通过操纵宿主基因组中的功能性DNA序列进行基因组编辑是生物医学研究的基本策略。RNA干扰(RNA interference,RNAi)和工程DNA结合蛋白技术(锌指核酸酶 zinc finger nucleases,ZFN或转录激活因子样效应物核酸酶 transcription activator-like effector nucleases,TALEN)是靶向基因调控的强大技术[1]。RNAi是目前遗传学方法中应用较广泛,并且具有操作简单、效果显著的优点,但该技术具有一定的局限性,不能作用于所有基因和某些细胞类型(如神经元),还有显著的脱靶效应、具有毒副作用等缺点。后续发展的第一、第二代人工核酸酶技术即ZFN技术和TALENS在基因编辑效率以及脱靶率上得到明显改进,但是作为定制的DNA结合蛋白,他们对操作者的专业能力要求高,成本较高[2]。直到2013年初,一种全新的基因组定点改造技术被开发,即为CRISPR/Cas9(clustered regularly interspaced short palindromic repeats/CRISPR- associated protein 9),这一技术为在各种生物体中进行基因组编辑打开了使用RNA导向的核酸酶的大门[3]。与其他的基因编辑技术相比,CRISPR/Cas9具有操作方便、设计简单、效率高、成本低以及可同时进行多位点编辑等优势。目前该系统为研究基因功能和生物进展提供更为理想的方法和先进的动物模型,极大的促进了各种疾病在体内条件下的研究。本文综合论述了CRISPR/Cas9的作用机理、发展历史及其在医学领域的应用,为更好地挖掘出CRISPR/Cas9在疾病治疗方面的潜力提供参考。
1 CRISPR/Cas系统研究历史
1987年,Ishino等[4]在研究大肠杆菌中lap酶参与的碱性磷酸酶的同工酶转化时发现的iap基因,是可以追溯到的关于CRISPR的最早报道。iap基因包含一段十分独特的29nt重复序列,这些序列以串联的形式重复出现,并被5个32 nt的非重复序列间隔开。接下来,越来越多的细菌和古细菌基因组被测序并被鉴定出CRISPR序列。大量的数据表明,大约有40%的细菌和90%的古细菌基因组含有这一独特的序列[5]。直到2002年,这一独特的重复串联序列家族正式被命名为CRISPR,取自的它的英文全称Clustered regularly interspaced short palindromic repeats首字母缩写[6]。同时,CRISPR系统相关基因(CRISPR-associated genes,Cas)也被鉴定出来[6],它们具有一定的保守性。据此,研究人员将CRISPR/Cas系统进行了大致分类,确定了CRISPR/Cas系统的三种主要类型,其中Cas3、Cas9(formerlycsn1)和Cas10分别是I型、II型和III型系统的标签基因。2005年,有研究发现CRISPR序列与细菌的适应性免疫功能相关[7-8]。2007年,丹麦的食品添加剂公司Danisco 的Horvath 等[9]发现CRISPR具有抵抗特定噬菌体针对嗜热链球菌的感染的功能,这是第一个证实CRISPR与适应性免疫相关的实验数据,也是II型CRISPR系统作为一个适应性免疫系统的实验证据。由于I型和III型相对复杂,CRISPR功能活性需要多种蛋白质配合进行。而II型CRISPR/Cas系统中涉及到的Cas蛋白最少,通常被认为是最小的CRISPR/Cas系统,仅包括CRISPR重复-间隔序列和3~4个cas基因。其中,Cas9基因是一个大分子量的多结构域蛋白质,能够独自起到靶向和裂解侵入DNA的功能。此后的十多年里,诸多研究者把目光投向II型CRISPR/Cas系统。2009年后,CRISPR系统的基本功能和机制逐渐清晰,随后许多研究小组已开始将自然的CRISPR 系统应用于各种生物技术。自2013年首次将CRISPR/Cas9应用于真核细胞的基因编辑后,这一领域的研究发展十分迅速,目前这一系统已经在人类细胞、猴子、猪、小鼠、斑马鱼、果蝇、酵母、植物、秀丽隐杆线虫以及细菌等基因工程领域成功使用。CRISPR/Cas系统在各种细胞和生物体中进行基因组编辑的通用性和高效性证明了该系统的在基因改造领域的巨大优势,使其成为高效、便捷精准的新一代基因编辑工具。本文中,笔者总结了CRISPR发展的简略时间表(图1)。
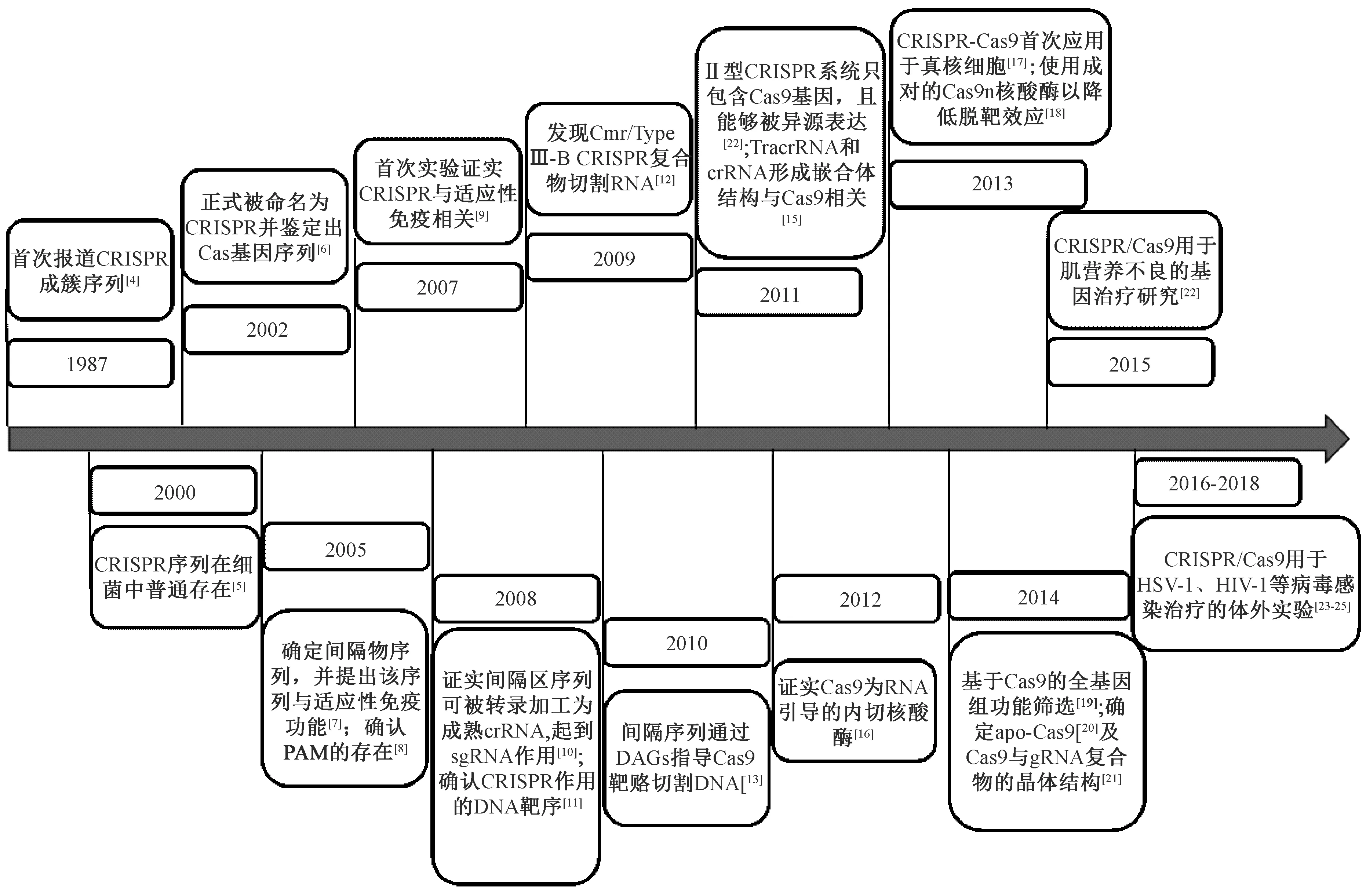
图1 CRISPR/Cas9系统研究历史Figure 1 History of CRISPR/Cas9 technology
2 CRISPR/Cas9系统的基因编辑过程
CRISPR/ Cas9介导的基因组编辑依赖于双链DNA断裂(double strand breaks,DSB)和随后的细胞DNA修复过程。在内源性CRISPR/ Cas9系统中,首先,由成熟crRNA与反式激活crRNA(tracrRNA)结合形成sgRNA(tracrRNA-crRNA复合物),该复合物负责将Cas9引导至目标位点。其中,tracrRNA与crRNA部分互补,并参与crRNA成熟过程,而另一部分序列(5’末端约20 nt)与靶向序列碱基互补配对。CRISPR/ Cas9介导的序列特异性切割要求crRNA与靶向序列的碱基互补配对和一段短的原间隔序列相邻基序(Protospacer adjacent motif,PAM)。与靶位点结合后,与crRNA的互补链和非互补链分别被Cas9切割,在靶点位置产生DSB(图2)。该过程中,Cas9 蛋白中 HNH 结构域剪切目标链,而Rucv结构域切割非目标链。最后,由CRISPR/ Cas9产生的DSB将触发细胞DNA修复过程,包括非同源末端连接(NHEJ)介导的易错DNA修复和同源定向修复(HDR)介导的无错误DNA修复(图2)。
其中,NHEJ介导的DNA修复可以快速连接DSB,但在靶位点产生小的插入和缺失突变。这些突变就可以帮助各相关领域研究人员对靶基因或基因组元件进行插入和缺失的编辑。例如,Gratz等[26]通过NHEJ介导的DNA修复,通过CRISPR/ Cas9诱导的DNA切割在果蝇基因组的黄色基因座处产生了移码突变。DSB也可以启动HDR介导的DNA修复,这比NHEJ介导的DNA修复更复杂。HDR介导的无错误DNA修复需要含有同源性的供体DNA序列作为修复模板。通过共同注射Cas9,两种指导RNA(gRNA)分别靶向黄色基因座的5’和3’序列以及单链寡聚脱氧核苷酸模板,Gratz等人用果蝇基因组中的50nt attP重组位点成功替换了黄色基因座[26]。
为了便于在基因组编辑中应用,研究人员设计了一种精密的gRNA,它是一种含有所有必需crRNA和tracrRNA成分的嵌合RNA[27]。目前已经开发了多种CRISPR/Cas9变体,包括能够识别20或24 nt的gRNA和位于靶点位置的2~4 nt PAM序列。理论上CRISPR/Cas9可以靶向22~29 nt的特定DNA序列,这在大多数基因组中能够保证靶点的特异性。然而,最近的研究观察到CRISPR/Cas9对gRNA和其互补靶序列之间的碱基对错配具有高度耐受性,导致该系统在应用中存在较高的脱靶效应[27-29]。
与ZFN和TALEN相比,CRISPR/ Cas9有几个显著优点。ZFNs和TALENs建立在蛋白质引导的DNA切割的基础上,这需要复杂和耗时的蛋白质工程,选择和验证。相比之下,CRISPR/Cas9只需要一个短的可编程gRNA进行DNA定位,相对便宜且易于设计和生产。通过使用Cas9和几种不同靶位点gRNA,CRISPR/Cas9能够在多个独立位点同时诱导基因组修饰。该技术可以加速产生具有多个基因突变的转基因动物[27],并破坏一个或数个基因以研究基因功能。
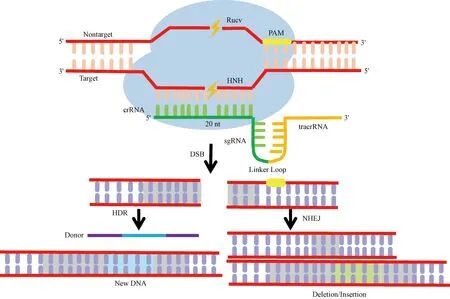
图2 CRISPR/Cas9介导的基因组编辑示意图Figure 2 Mechanism of CRISPR/Cas9
3 CRISPR/Cas9系统在医学领域的应用
大量的研究证明CRISPR/Cas9系统可以快速方便地在哺乳动物细胞系,动物模型或其他物种中实现基因组编辑[28-35]。因此,CRISPR/Cas9系统被视为基因治疗的有希望的候选者。
3.1 CRISPR/Cas9系统应用于抗肿瘤免疫治疗
肿瘤发生是由多种基因改变所驱动的,并且总是与复杂的免疫反应有关,其涉及肿瘤细胞的免疫逃避和免疫抑制性肿瘤微环境的产生[36]。随着诸多免疫检查点的确定,如细胞毒性T淋巴细胞相关蛋白4(cytotoxic T-lymphocyte-associated protein 4,CTLA-4)和程序性细胞死亡蛋白1(programmed cell death protein 1,PD-1),近年来,抗肿瘤免疫治疗已经成为备受瞩目的防治癌症的策略之一[37-38]。通过对患者的免疫细胞进行基因编辑抗肿瘤免疫治疗无疑是一个富有希望的研究方向。
在肿瘤中已经获得良好的临床结果的一种方法是免疫检查点抑制剂,如阻断CTLA-4,PD-1及其配体PDL-1。已有大量研究表明CRISPR/Cas9介导的PD-1[39],PDL-1[40]或CTLA-4[41]基因敲除是打破肿瘤治疗中基于T细胞的过继疗法耐受性的有效策略。2016年一篇文献报道,使用CRISPR/Cas9系统通过灭活PD-1来设计癌症患者的T细胞的两项临床试验正在进行,分别在美国和中国进行[42]。
此外,CRISPR/Cas9介导的基因组编辑在基因治疗中最具前景的应用之一是CAR T细胞的产生。CAR通常含有识别和结合特定肿瘤相关抗原的胞外单链可变片段和驱动T细胞活化的细胞内嵌合信号传导结构域[43]。作为一种新型的基因治疗方法,CAR T细胞疗法,尤其是CD19特异性CAR T细胞疗法在治疗B细胞急性淋巴细胞白血病[44]和非霍奇金淋巴瘤[45]中显示出显著的抗肿瘤活性。然而,临床研究中发现这种治疗具有体内神经毒性,并可能引起细胞因子释放综合征[44-45]。此外,目前进行的CAR T细胞临床试验主要是通过收集患者的T细胞,对其进行基因修饰,在将它们送回患者体内,从而达到治疗目的。但这种方式对医疗设备和技术人员的技术要求极高,更重要的是,想要从患有严重疾病的患者身上获得足够功能完整的自体细胞也是十分困难的。这些都极大地限制了这一技术在临床上的推广应用。为了克服这些障碍,通过编辑来自一个供体的同种异体T细胞制造出“通用”CAR T细胞,然后施用给多个其他患者,已经成为新的研究方向。研究表明,使用CRISPR-Cas9将CD19特异性CAR靶向T细胞受体α保守(T-cell receptor a constant,TRAC)位点不仅可以在人外周血T细胞中产生均一的CAR表达,还可以增强T细胞的活性,大大优于传统的在ALL的小鼠模型中产生CAR T细胞[46-47]。然而,同种异体T细胞上的内源性αβ T-细胞受体(αβ T-cell receptor,TCR)可能识别受体中的组织相容性抗原,导致移植物抗宿主病,且同种异体T细胞表面表达人类白细胞抗原(human leukocyte antigen,HLA)往往会触发宿主快速免疫排斥反应。这成为了利用CRISPR/Cas9系统开发“通用”CAR T细胞的一大挑战。
虽然仍然存在一些挑战,但基因编辑和肿瘤免疫治疗方面的巨大进步使其成为人类疾病基因治疗的有希望的方法。许多科研工作者相信,在提高该方法的安全性并降低脱靶率后,该系统可以迅速应用于临床肿瘤治疗。
3.2 CRISPR/Cas9系统应用于病毒性疾病治疗
由于病毒突变率高和潜伏感染,病毒引起的疾病难以治疗,尤其是人类宿主中的潜伏病毒几乎是不可能被消灭的。近年来,基因治疗成了治疗病毒性疾病的新宠。CRISPR/ Cas系统起源于古细菌和细菌的免疫系统,赋予其对外源遗传元件如质粒和病毒(噬菌体)的抗性,并为宿主提供获得性免疫[48-49]。
目前常用的抗病毒药物的作用机制主要是阻断病毒复制周期,比如阻断病毒进入宿主细胞或是阻碍病毒的基因组复制等。但是这一治疗的缺陷是只能在病毒进入复制周期时起作用,无法消灭潜伏期病毒。因此,制定出能够破坏病毒基因组的治疗策略,是抗病毒治疗领域十分值得研究的方向之一。借助CRISPR/Cas系统对病毒基因组进行编辑,可以达到这一效果。2016年,有研究者设计了针对ICP0的sgRNA,用以治疗HSV-1感染[23],这是一种重要的病毒编码蛋白,可调节HSV-1病毒基因的表达和复制。同年,Diemen等[24]利用CRISPR/ Cas9技术来抑制疱疹病毒在潜伏感染和裂解感染模型中的复制。这项研究显示CRISPR系统能够抑制三种疱疹病毒家族成员:EBV,HSV和HCMV[24]。2018年一项研究报道中描述研究人员设计了RNA引导的CRISPR/ Cas9靶向HIV-1调节基因tat和rev,并选择了基于六种主要HIV-1亚型的CRISPR特异性和序列保守性的gRNA。然后在持续和潜伏的HIV-1感染的T细胞系中进行了测试,结果显示CRISPR/Cas9在持续和潜伏感染的人CD4 + T细胞系中能够成功抑制HIV-1复制[25]。
虽然目前在药物研发方面已然取得了巨大的成就,现有的治疗方案包括小分子药物(如siRNA),抗病毒药物,蛋白酶抑制剂和预防性疫苗。然而对于许多持续性、潜伏期长、高复发性或是高度流行的病毒仍然缺乏有效的治疗方案,病毒治疗领域仍有许多未被攻克的领域。CRISPR/ Cas9技术的发展为治疗潜伏性疱疹病毒感染提供了一种新颖而有前景的策略。尽管这一方案的有效性和安全性仍然需要更多的临床前研究数据来证明,但不可否认的是,CRISPR/ Cas9仍然有潜力成为针对病毒感染的有效疗法。
3.3 CRISPR/Cas9系统应用于遗传性疾病治疗
在完成人类基因组计划以后,医学正迅速发展成为基因组医学学科。尽管目前许多疾病距离基因治疗仍十分遥远,但是在过去25年中,人类对各类疾病发病机制的知识积累,尤其是许多疾病的遗传基础的了解达到了指数增长,尤其是许多无法治愈的遗传性疾病。许多研究者认为,纠正这些疾病相关的点突变同时保留遗传功能的策略是治疗遗传疾病的理想方法。CRISPR/Cas9技术通过Cas9在突变位点处或附近引入DNA DSBs,然后通过NHRJ或HDR诱导不同类型的插入,导致基因突变,敲入,删除,反转等,在这一过程中有机会纠正基因组中相应缺陷,从而达到治疗遗传疾病的效果。
2014年,Yin等[50]报道了一项在成年小鼠体内进行的CRISPR/ Cas9介导的HDR纠正Fah基因点突变的研究,证明了利用CRISPR/Cas9介导的基因编辑纠正基因突变在成年动物中是可行的,并且具有纠正人类遗传疾病的潜力。这种策略也被应用于其他类似遗传疾病的研究,如Yang等[51]利用同样的技术成功校正了小鼠Otc基因外显子4的G→A点突变,证实了该疗法对新生小鼠高氨血症的治疗效果。此外,HDR介导的点突变校正也已应用于包括β-地中海贫血[52],慢性肉芽肿病[53],Duchenne肌肉萎缩症[54],镰状细胞病[55]和严重联合免疫缺陷[56]。国内在该领域的研究也十分令人瞩目,已将CRISPR/ Cas9技术应用于大鼠、小鼠、猪、猴等各类动物模型[57-61]。如可用于Abcb1基因相关药物代谢研究的Abcb1基因敲除大鼠和人源化大鼠模型[57],Rag2、IL2rg基因突变的T、B及NK细胞联合免疫缺陷BABL/c小鼠[58],用于2型糖尿病研究的Irs1 基因敲除大鼠[59],用于癌症研究的基因修饰工具猪模型[60]。此外,在非人类灵长类动物疾病模型[61]的建立上CRISPR/Cas9技术也有巨大的潜力,可以预测CRISPR/Cas9技术能够使灵长类动物成为各相关领域研究人员研究重大神经系统疾病的发病机制及疾病的早期干预和药物筛选的重要动物模型。
CRISPR/Cas9技术为靶向基因编辑提供了强有力的工具,并且已经在遗传疾病的治疗发展中展现出其强大的潜力。无论是在体外实验还是动物实验中,使用CRISPR/Cas9技术来校正基因缺陷已经取得了显著进展,使得治疗性基因编辑有望应用于临床。同时,在临床应用中该技术的使用也需要考虑疗效、准确性、安全性以及伦理问题。
4 天使或魔鬼?——风险问题
实际上,“基因疗法”并非CRSIPR技术出现后才被提出的概念。早在1990年,美国就批准了人类第一个对遗传病进行体细胞基因治疗的方案,将腺苷脱氨酶基因(ADA)导入两名患有严重复合免疫缺陷综合征(SCID)的儿童T细胞中[62]。然而,随着在1999年,一位在宾夕法尼亚大学接受基因治疗实验的18岁患者,在实验期间出现多器官功能衰竭后死亡,敲响了第一个质询“基因疗法是否安全”的警钟[63]。此后几年内,基因疗法的临床试验一再出现安全问题。最终,基因疗法临床试验暂停,几乎不再有人提及。直至2015年,借助TALEN基因编辑技术,伦敦大奥蒙德街医院一位1岁大女婴Layla Richards的白血病被“治愈”[64]。不过,这一病例中研究人员只是对健康捐献者的T细胞某些引起机体免疫排斥反应的基因进行了删除,以防止这些外来T细胞被病人自身的免疫系统和抗癌药物的攻击,从而提升女婴的免疫能力,争取更多的治疗时间。正如她的主治医生所说,只是起到了“桥梁”作用,最终想要治愈还是需要进行骨髓移植。然而,全球首例利用基因疗法“治愈”的白血病,仍然给科学界带来了极大的鼓舞。而CRISPR/Cas9技术的发展更是在技术上实现了巨大的突破,似乎基因疗法就在眼前。
但是,CRISPR/Cas9技术的风险问题,也不容忽视。今年6月11日,Nature子刊NatureMedicine上同期发表的两篇在人多能干细胞中进行相关研究发现[65-66]:CRISPR基因编辑造成的DNA双链断裂会激活p53,引起人多能干细胞的凋亡。而p53是重要的抑癌基因,这意味着最后被“筛选”出来的细胞,极有可能是存在p53功能缺陷的细胞,这就使得患者处于癌症风险之中。虽然目前尚无直接实验证实其致癌性,但是这一研究结果再一次为CRISPR/Cas9应用于临床治疗敲响了警钟。这也再一次提醒了大家,在应用于人体之前,CRISPR还有很长的一段路要走。
5 总结与展望
目前CRISPR/Cas9系统凭借其明显优势已经成为基因编辑系统的焦点,且该技术用于靶向基因组编辑和调控的应用正在不断增长,并扩展到更广泛的生物体和细胞类型。作为现代科学中革命性的基因组编辑技术,它可以作为工具建立动物模型,纠正缺陷性致病基因,消除病毒/细菌感染,治疗癌症和重新编程神经元细胞。目前,科研工作者们已经能够成功地利用该技术为研究特定基因的功能建立疾病模型。在器官移植领域、病毒类疾病以及遗传类疾病方面,该技术也已有了明显的突破。相信CRISPR/Cas9技术在今后的基础研究和临床治疗中能够取得更大的突破,大放异彩。但不可忽视的是,任何基础研究中获得的研究成果,想要应用于临床治疗,都还需要大量的研究,既要保证保证安全性,也要保证有效性。
