气滞血瘀型慢性输卵管炎症大鼠模型的建立与评价
2019-03-01刘建秋
郑 跃,刘 丽,刘建秋
(黑龙江中医药大学, 哈尔滨 150040)
中医对于疾病的诊断基础是证候,不同的证候表现为人体对于疾病的全身整体反应,是辨证的结果,同时更是论治的依据。传统的中医建立在医家的思辨基础上,由于目前病证模型相结合的方法较少,单一从病上论治其有效性,而忽视辨证,并不能完整的体现中药治疗的价值,而一直以来,将复杂的中医辨证理论转化为临床上更直观的指标数据都是中医药发展的瓶颈所在[1]。为了更好地研究输卵管炎的发病机制和其分型的病症表现,本实验将病与证的模型相结合,通过对大鼠模型的标准化、客观化、计量化的采集和分析,从而建立与临床表现相类似的气滞血瘀型慢性输卵管炎症模型大鼠,进而加深中医药对输卵管炎等妇科疾病的探索,为治疗该领域疾病提供科学理论依据。
1 材料和方法
1.1 实验动物
雌性SPF级SD大鼠52只,8~12周,体重(200±20)g,由黑龙江中医药大学实验动物中心提供,生产许可证编号[SCXK(黑) 2015-004],实验动物使用许可证号[SYXK(黑)2013-012]。经黑龙江中医药大学实验动物管理和使用委员会审核,符合科技部《关于善待实验动物的指导性意见》和《实验动物使管理和使用委员会章程》 的相关规定,实验动物伦理审查批准编号 DWLL20151108001。保持饲养环境温度22℃,相对湿度40%左右,每日早8:00到晚8:00人工灯光照明,饲养密度为每盒5只,笼具交换1周1次,每3 d全部作业结束后,由动物室人员进行清扫并擦拭消毒,并更换鼠盒及垫料。标准大鼠饲料喂养,自由饮水,适应环境一周之后开始实验。
1.2 主要试剂与仪器
电子天平(北京赛多利仪器有限公司)、HNY-2102C恒温培养振荡器(天津欧诺仪器仪表有限公司)、EG1160 石蜡包埋机(德国 LEICA 技术公司)、BM-2135石蜡切片机(德国 LEICA 技术公司)、CS Ⅲ生物组织摊片机(湖北省医用电子仪器厂)、CX41光学显微镜(日本 OLYMPUS 公司)、JEM-1220型透射电镜(日本电子有限公司)、HPIAS-1000 高清晰度彩色病理图文分析系统(武汉同济医科大学千屏影像工程公司)。GRT-6008全自动血液分析仪器(济南格利特科技有限公司)、LBY-N6 Compact全自动血液流变仪(北京普利生仪器有限公司)、LBY-BX型红细胞变形聚集仪(北京普利生仪器有限公司)。
金黄色葡萄球菌(菌号ATCC29213)FSCC225002(购自北京东方赛瑞生物技术有限公司)、二甲苯(天津市永大化学试剂有限公司,批号160107)、伊红(天津科密欧化学试剂开发中心,批号150927)、苏木素(上海山浦化工有限公司,批号150424)、纯净水(广州屈臣氏食品饮料公司)。
1.3 实验方法
1.3.1 菌种培养与菌液配制
将35 g牛肉汤培养基,加入到1000 mL的蒸馏水中溶解, 121℃灭菌20 min,放冷,取斜面保存的金黄色葡萄球菌菌种,用无菌蒸馏水溶解,在超净工作台下接种至新配制的液体培养基中,于28℃,110 r/min,摇床培养24~48 h,得到菌液即可使用。
1.3.2 分组与模型构建[2-3]
雌性SD大鼠52只,随机分为4组,分别为空白组(K)、手术组(S)、模型组(M)、复合模型组(F),每组13只。于实验第1天,除K组外,其余各组麻醉后,将大鼠侧卧式平放,剃毛并用碘伏进行消毒,取肋缘过肾区0.5 cm近脊柱侧旁开1 cm长的横切口,打开腹腔,拨开其他组织,暴露一侧卵巢、输卵管及部分子宫,M组、F组均向输卵管方向注入已配好的4×109/mL金黄色葡萄球菌悬液0.1 mL,后逐层缝合腹壁肌层、皮肤,再以75%的酒精消毒切口,另一侧输卵管同样方法操作,S组只手术不注菌,注入等剂量生理盐水(见表1)。
于实验第8天,复合模型组(F)给予大鼠不可预知的慢性长期刺激,包括大鼠足底25~35 V的电击刺激,每隔8~15 min进行一次,每次60~120 s,持续10~12 h;频率为5~15 KHz的噪声刺激(等级为3级),每隔8~15 min进行一次,每次60~120 s,持续10~12 h;频率为1~3 KHz强度的闪烁光刺激,每隔8~15 min进行一次,每次60~120 s,持续10~12 h;夹尾每小时1次,每次4 min,每天8次;45°倾斜鼠笼两小时,每日1次;连续21 d。
1.3.3 大鼠体重、摄食量
实验过程中各组大鼠每7 d分别测量一次体重与饮食量。
1.3.4 大鼠一般行为学观察
实验过程中各组大鼠每7 d分别进行一般行为学记录,包括活动量、精神、舌色、爪色、耳色。
1.3.5 大鼠症候积分
根据表2 气滞血瘀模型大鼠的症候积分评价量表评价大鼠证候积分。此价量表是查阅文献中做过类似模型的文章中记载的,分评价量表最早用在格拉斯昏迷评分量表(Glasgow Coma Scale, GCS)中,它是医学上评估病人昏迷程度的方法,是由英国格拉斯哥大学的两位神经外科教授Graham Teasdale与Bryan J. Jennett在1974年发明的测评昏迷的方法。昏迷程度以三者分数相加来评估,得分值越高,提示意识状态越好,比较客观,现今分评价量表越来越多用在模型评价研究中。
1.3.6 肉眼观察输卵管形态
于实验给药28 d后,禁食不禁水12 h,用20%乌拉坦0.1 mL/kg腹腔麻醉,无菌条件下解剖大鼠,取双侧输卵管,肉眼观察输卵管组织形态,并进行评分。

表1 各组实验大鼠处理方法一览表Table 1 List of the treatment methods for each group of experimental rats

表2 气滞血瘀模型大鼠的症候积分评价量表Table 2 Symptom score scale for evaluation of qi stagnation and blood stasis in the model

表3 肉眼观察输卵管组织形态学评分标准Table 3 Evaluation scores of gross appearance of the inducts
1.3.7 HE染色病理切片观察
于实验给药21 d后,禁食不禁水12 h,用20%乌拉坦0.1 mL/kg腹腔麻醉,无菌条件下解剖大鼠,取双侧输卵管,进行HE染色制成病理切片。
切取厚度为3 μm的大鼠输卵管组织切片,放置于烤箱中2 h,温度设定为65℃。使用二甲苯脱蜡,每次15 min,脱蜡两次后进行脱水1 min,用苏木素染色5 min,流水冲洗2~3 min, 1%盐酸酒精分化2 s,温水水冲15 min(返蓝),再用伊红染色1 min,采用梯度脱水,二甲苯透明,中性树胶封片后在光镜下观察各组大鼠子宫组织形态学变化。
1.3.8 血流变学检测
于给药后21 d,禁食不禁水12 h,用20%乌拉坦0.1 mL/kg腹腔麻醉,无菌条件下腹主动脉取血测定血浆黏度、全血黏度3.0/s、30/s、50/s、100/s、180/s,还原黏度3.0/s、30/s、50/s、100/s、180/s,红细胞刚性指数、聚集指数、电泳时间、变形指数,血沉方程K值。取肝素钠抗凝血1 mL,3000 r/min离心10 min,吸取0.25 mL血浆,测定血浆黏度。取肝素钠抗凝血1 mL,用血液粘度仪测定全血黏度。取400 μL抗凝血,用红细胞变形聚集仪测红细胞聚集指数。取20 μL抗凝血,加入15%PVP悬浮液1 mL中混匀,吸取50 μL用红细胞变形聚集仪测红细胞变形指数。
1.4 数据分析
2 结果
2.1 大鼠体重和摄食量变化
除空白组(K)外,手术组(S)、模型组(M)、复合模型组(F)体重和饮食量均降低,其中复合模型组减低更为明显(见表4、5),从第2周起复合模型组大鼠开始出现对于刺激的不适应性,摄食量减少明显。
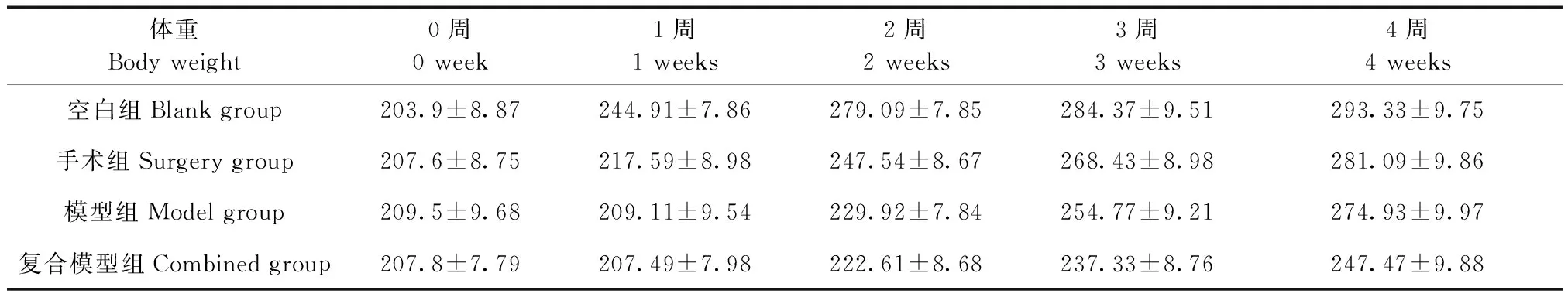
表4 大鼠体重变化(g)Table 4 Weight changes in the rats
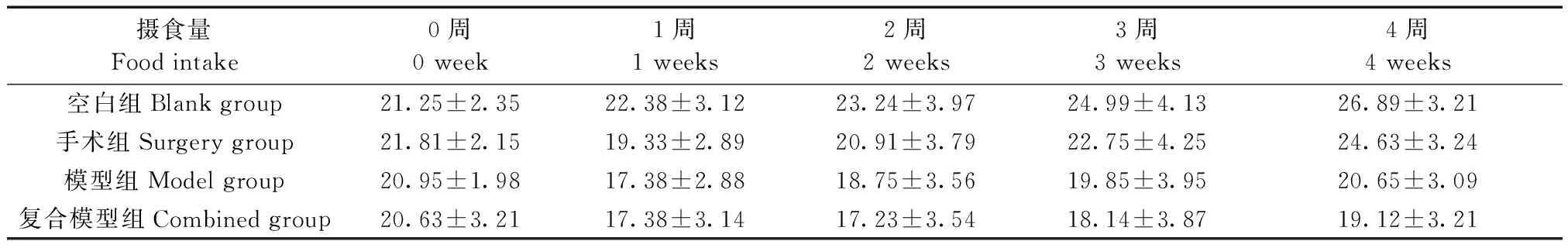
表5 大鼠摄食量变化(g)Table 5 Changes in food intake in the rats
2.2 一般行为学观察结果
造成气滞血瘀型慢性输卵管炎的复合模型大鼠在活动量、精神、舌色、爪色、耳色等方面有很明显的区别(见图1、表6),空白组大鼠以上行为学形态均正常,复合模型组活动量方面表现出行动迟缓,蜷缩少动,并伴有精神上萎靡,基本生活状态不旺盛的现象;同时复合模型组的舌色发紫红,爪色也与正常大鼠有明显区别,颜色近乎于紫红,耳色由白粉色色变为红色并带有斑点出现,说明模型构建后大鼠表征状态与一般行为学等各个方面均出现明显差异。此外,模型组、复合模型组均在造模时出现1只死亡,对死亡大鼠进行解剖,考虑主要因急性感染导致死亡。
2.3 症候积分评价结果
由表7可知,与空白组(K)比较,手术组(S)、模型组(M)、复合模型组(F)的症候总积分显著升高(P<0.01);与模型组相比较,复合模型组症候总积分亦有显著上升(P<0.01),提示气滞血瘀加炎症的复合模型构建成功,且与单独注菌的炎症模型组有明显差异。
2.4 肉眼观察输卵管形态结果
由表8可知,与空白组(K)比较,复合模型组输卵管80%出现严重血管肿胀,60%出现严重管壁增厚,50%出现严重盆腔粘连。
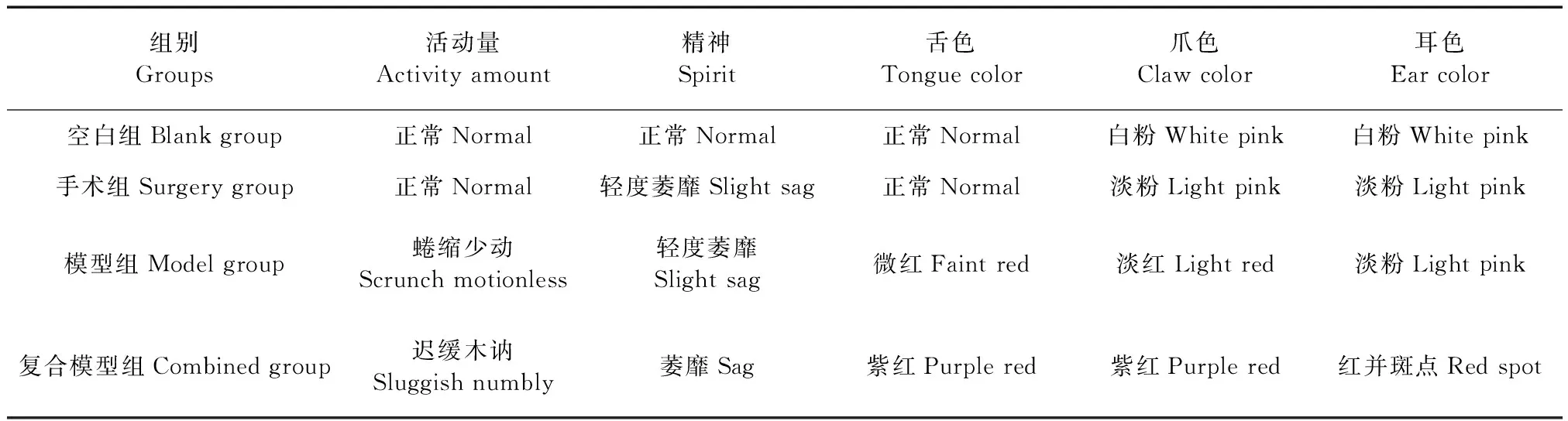
表6 大鼠一般行为状况的观察Table 6 Observation of general behavior in the rats

注:A:空白组大鼠舌色;B:复合模型组大鼠舌色;C:空白组大鼠耳色;D:复合模型组大鼠耳色;E:空白组爪色;F.复合模型组爪色。图1 空白组(K)与复合模型组(F)大鼠舌色、耳色与爪色对比图Note. A. Tongue, Blank group. B. Tongue, Compound model group. C. Ear, Blank group. D. Ear, Compound model group. E. Claw, Blank group. F . Claw, Compound model group. Figure 1 Comparison of the color of tongue, ear and claw between the rats of the blank group(K) and conpound model group(F)
2.5 病理学改变
由图2可见,空白组输卵管结构良好,粘膜清晰,无炎细胞浸润、充血、水肿。手术组输卵管周围少量炎细胞,输卵管结构尚完整。模型组输卵管周围组织淋巴细胞浸润、疏松、水肿。复合模型组输卵管管腔内较多炎细胞浸润,粘膜上皮细胞脱落,并伴有输卵管周围大量炎细胞浸润,其中以淋巴细胞为主,部分区域疏松、水肿,输卵管外膜血管扩张,充血,淋巴细胞浸润。
2.6 血流变学检测结果
2.6.1 对大鼠的血浆黏度、全血黏度在切变率3.0/s、30/s、50/s、100/s、180/s下的影响
由表9、10可知,与空白组比较,模型组的血浆黏度有显著上升(P<0.05),其全血黏度3.0/s与全血黏度30/s均有极显著的上升(P<0.01),复合模型组的血浆黏度、全血黏度3.0/s及30/s均有极显著升高(P<0.01),说明大鼠慢性输卵管炎模型构建成功;与模型组比较,复合模型组血浆黏度、全血黏度3.0/s、全血黏度30/s升高极为显著(P<0.01),说明气滞血瘀伴炎症反应的复合模型与单独注菌造成的炎症模型有明显差异。

表7 症候总积分统计表Table 7 Symptom statistics
注:与空白组比较,△P<0.05,△△P<0.01;与模型组比较,▲P<0.05,▲▲P<0.01。下表同。
Note. Compared with the blank group,△P< 0.05,△△P< 0.01.Compared with the model group,▲P< 0.05,▲▲P< 0.01. The same in the flowing tables.

表8 肉眼观察输卵管形态结果Table 8 Visual observation of the fallopian tube morphology
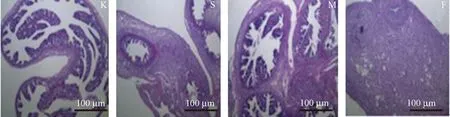
注:K.空白组;S.手术组;M.模型组;F.复合模型组。图2 各组大鼠输卵管HE染色图(×100)Note. K. Blank group;S. Surgery group;M. Model group;F. Combined group.Figure 2 Histology of the rat fallopian tubes in the different groups (HE staining)

组别Groups血浆黏度Plasma viscocity全血黏度3.0/sBlood viscocity 3.0/s全血黏度30/sBlood viscocity 30/s空白组Blank group0.85±0.1119.97±2.208.06±1.18手术组Surgery group0.87±0.1222.64±2.359.49±1.24模型组Model group0.97±0.11△25.21±2.28△△10.61±1.48△△复合模型组Combined group1.39±0.19▲▲△△27.95±3.15▲▲△△13.86±1.76▲▲△△
2.6.2 对大鼠的还原黏度3.0/s、30/s、50/s、100/s、180/s的影响
由表11、12可知,与空白组比较,模型组、复合模型组的还原黏度3.0/s、还原黏度30/s有极显著的上升(P<0.01),模型组还原黏度50/s有显著的上升趋势(P<0.05),复合模型组还原黏度50/s有极显著的上升趋势(P<0.01),提示大鼠慢性输卵管炎模型血流变学指标差异较为显著;与模型组比较,复合模型组还原黏度3.0/s、还原黏度30/s、还原黏度50/s均显著性增加(P<0.01),提示气滞血瘀加炎症的复合模型与单独注菌的炎症有明显差异,病证结合模型构建成功。
2.6.3 对大鼠的红细胞刚性指数、聚集指数、电泳时间、变形指数,血沉方程K值的影响
由表13、14可知,与空白组比较,模型组中红细胞刚性指数有显著性升高(P<0.05),红细胞聚集指数有极为显著的上升(P<0.01);复合模型组的红细胞刚性指数、红细胞聚集指数有极显著的增加(P<0.01),提示大鼠慢性输卵管炎模型构建成功;与模型组比较,复合模型组红细胞刚性指数、红细胞聚集指数有极显著性升高(P<0.01),有显著性升高(P<0.05),提示气滞血瘀加炎症的复合模型与单独注菌造成的炎症模型有明显差异。
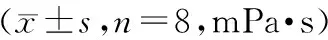
表10 对全血黏度在切变率50/s、100/s、180/s的影响Table 10 Effects on whole blood viscosity under shear rates 50/s, 100/s, and 180/s

表11 对还原黏度3.0/s、30/s、50/s的影响Table 11 Effect on reducing viscosity under shear rates 3.0/s, 30/s, and 50/s

表12 对还原黏度100/s、180/s比较表Table 12 Comparison for reduced viscosity under shear rates 100/s and 180/s

表13 对红细胞刚性指数、红细胞聚集指数的影响Table 13 Influence on the red cell rigidity index and erythrocyte aggregation index

表14 对血沉方程K值,红细胞电泳时间、变形指数的影响Table 14 Effect of K value on erythrocyte sedimentation rate, erythrocyte electrophoresis time, and deformation index
3 讨论
慢性输卵管炎是导致输卵管性不孕症和异位妊娠的重要原因,严重影响女性的生殖健康。目前西医治疗方法主要为抗生素,在慢性期和后遗症期效果不佳,中药在慢性转归方面疗效显著,具有活血、化瘀、止痛、抗菌、消炎、提高免疫力、改善微循环的作用,有利于局部炎症的瘢痕软化、松解,微循环的改善。然而慢性输卵管炎容易反复发作,需要长期按疗程治疗,为了更好地研究输卵管炎的发病机制和寻找更有效的治疗方法,建立最接近人类发病的理想动物模型,是不可或缺的坚实基础。
病证结合模型是中西医相结合的连接桥梁[4-7],现代的病证结合模型,多数为西医的病加中医的证,这种病证结合模型的优势在于既有西医中明确的病理组织、器官、血液的评价支持,又引入中医的辨证思想,可以动态观察宏观指标和微观指标,这更符合临床诊治的情况,先辨病,再辨证,辨证论治,更有利于探讨疾病的病理变化在中医特定证型中的表现。
目前建立符合气滞血瘀型慢性输卵管炎的病证结合模型是非常困难的,本实验在预实验中也进行了长期的摸索,最终确定了现行病证结合模型。在气滞血瘀模型方面经过反复的预实验,选择了与人类发病机理最类似的方法进行模型构建,在炎症模型方面摸索了不同的菌种,菌浓度,接种方法,接种剂量。在保证模型成功同时,兼顾大鼠的带病生存,以备实验用。并且通过实验观察,研究人员发现在整个过程中,复合模型组大鼠(病证结合模型大鼠)从行为学的一般特征和症候总积分都符合气滞血瘀模型的改变,与模型组大鼠(单纯慢性输卵管炎症模型)存在显著的差异,说明病证结合模型的结果和单纯慢性输卵炎模型的结果是存在差异的。对气滞血瘀型模型大鼠的血流变学指标进行检测,发现气滞血瘀型慢性输卵管炎模型大鼠与慢性输卵管炎模型大鼠在血液粘度、还原粘度、红细胞刚性指数、聚集指数等方面存在差异性,这也为相关人员对中医药的进一步研究提供了新思路,更加证明了病证结合模型大鼠建立的意义。实验结果可知,复合模型组大鼠存在气滞血瘀的改变,具有慢性输卵管炎症的表现,从而印证了病证模型的成功。
现代医学常将中医瘀证解释为机体的心血管在特定的内因和外因共同的作用下[8],导致的一系列生理、病理改变,从而影响血液流变,表现为血液流动缓慢,严重者可导致阻滞,由动态,变成为静态,血液循环障碍和受累的组织,发生炎症、水肿、腐烂、坏死、增生等一系列变化。血瘀证包括一系列的生理、病理改变,与微循环、血液循环密切相关,与炎症反应、代谢障碍、免疫功能、组织增生都有一定关系[9-12]。因此常用血流变学检测指标对血瘀程度进行评估。而炎症是机体对损伤的一种反应,包括血液和结缔组织的变化、微循环的障碍等。机体受到致炎因子的刺激后,会引起一系列的变化,以助于清除有害物质、修复受损组织。表现为血管通透性增加、白细胞游走和增值期等,这些变化会导致血流变学指标出现相应的改变。
本实验研究中,从宏观到微观多层次选择观察指标,从症候评分、病因病机变化以及血液流变学指标改变来多角度界定,成功建立了大鼠气滞血瘀型慢性输卵管炎模型,并以临床中西医结合理论为基础,通过声、光、电、夹尾刺激造成大鼠气滞血瘀,客观分析该模型的可行性,并用于模型的系统评价,造模方法可行,成功率较高,较符合常见气滞血瘀型慢性输卵管炎的病症临床表现,为进一步实验研究提供坚实基础。
