局部应用上皮钠通道阻滞剂对干眼兔泪液分泌的影响
2019-03-01陈晓敏陈冬翠周世有
魏 园,陈晓敏,陈冬翠,周世有
(中山大学中山眼科中心//眼科学国家重点实验室,广东广州 510060)
泪液的量、质或流体动力学的异常会引起泪膜不稳定和(/或)眼表损害,主要表现为眼部干涩、灼烧痛、眼红、异物感、眼痒、视力下降等,临床上称为“干眼症”[1]。严重干眼者会导致视力下降明显,甚至导致失明,给正常的工作和生活带来困扰[2-3]。近年来,随着视频终端的普及、人口老龄化、空气污染等原因,干眼症的发病率越来越高。现有流行病学研究显示:我国的干眼症发病率高达21%~30%,全球有超过10亿人口存在不同程度的干眼症。临床上最常见的干眼症为水样液缺乏型[4]。在泪膜稳态的维持和失衡过程中,泪液变化机制的研究始终占据着泪液疾病研究的核心位置。近年来,通过体外电生理实验发现:结膜上皮和其他组织上皮一样,存在着多种离子通道,结膜分泌的液体量占到了泪液总量的25%左右[5]。水分的转运依赖于离子的转运,当离子转运调控失衡,则会出现一系列症状,典型代表如囊性纤维病[6]。钠离子是最常见的阳离子之一,钠离子的转运伴随着水分的移动。在与上皮细胞基底膜上的 Na+/K+-ATPase 的共同作用下[7-10],上皮钠通道(epithelial sodium channel,ENaC)介导了Na+的跨上皮转运,带动水分的转运完成上皮吸收功能。但结膜ENaC在干眼症的发生和发展过程中的作用机制到目前尚不清楚,本研究旨在探讨ENaC通道与泪液分泌变化的关系,探讨能否可以将其作为干眼症治疗的分子靶向目标,为干眼症的治疗提供一种新选择。
1 材料与方法
1.1 试剂和动物
正常雄性新西兰白兔,体质量2.0~2.5 kg,购于广州花都区华东信华实验动物养殖场(动物生产许可证号:SCXK(粤)2014-0023),动物饲养及实验操作均在中山大学中山眼科中心实验动物中心普通区进行(实验单位使用许可证编号:SCXK(粤)2015-0058),并遵守中山大学中山眼科中心动物实验伦理规定以及“眼科和视觉研究动物使用”的ARVO申明,饲养环境采用12 h光照-黑暗循环,室温20~25℃,动物可自由取食和取水。
阿米洛利(Amiloride)、东莨菪碱(scopolamine hydrochloride,SCOP)购于 Sigma-Aldrich公司,细胞增殖及细胞毒性检测试剂盒(MTT BB-4201贝博生物),胰酶细胞消化液购于Invitrogen公司,荧光定量PCR试剂购自南京诺唯赞公司。
1.2 组织的制备
经兔耳缘静脉注射速眠新(0.3 mL/kg),1 min后取下结膜上皮组织,放入BRS(Bicarbonate Ringer’s Solution)溶液中适当润洗,而后钳夹在短路电流灌流小室的中间,两侧的灌流小室各加入5 mL BRS溶液(NaCl 116.4,KCl 5.4,CaCl21.8,NaHCO325,MgSO40.81,NaH2PO40.78 mmol/L)。
1.3 短路电流
使用北京泰盟科技公司的短路电流装置[11-13]。将放大器连接BL420+生物机能实验系统,BL420+生物机能系统输出连接电脑。实验时设置参数为:采样率10 Hz,扫描速度40s/格子数,增益2,时间常数DC,滤波0.3 Hz。
将结膜上皮组织固定在面积为0.5 cm2的灌流小室中,向小室管两侧各加入5 mL相应的BRS溶液,通入混合气体(体积分数95%O2和5%CO2),当表示电流的图形曲线达到平稳时,往顶膜面(A面,apcial side)加药,观察电流的变化,待电流达到最大变化值时,测量加药前后的电流差值(ΔIsc),计算单位面积的短路电流变化量,即短路电流=ΔIsc/0.5/放大倍数(μA/cm2)。
1.4 荧光定量PCR
用Trizol提取总RNA,根据诺唯赞公司荧光定量PCR试剂盒说明进行产物合成[14]。所用的PCR仪为Thermo Fisher PikoReal 96。反应条件为:95 ℃预变性30 s,PCR:95 ℃ 10、60 ℃ 30 s,共40个循环,溶解曲线:95℃ 15 s、60℃ 60 s、95℃15 s。基于目的基因和看家基因实时荧光定量扩增曲线得到 Ct(C 为 Cycle,t为 threshold)值,用Folds=2-ΔΔCt表示实验组目的基因与对照组目的基因表达量的倍比关系。实验重复例数为3。引物序列如表1所示。
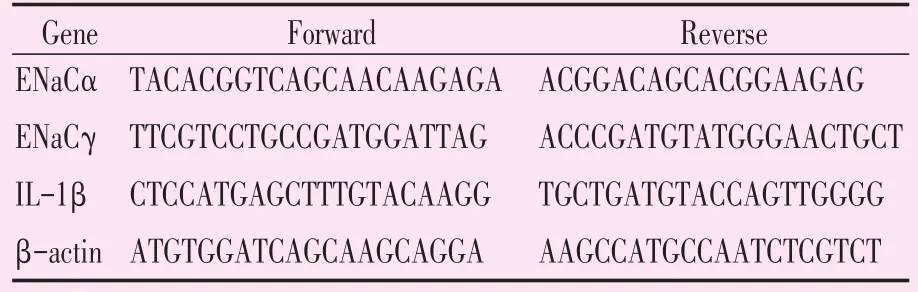
表1 实时荧光定量PCR引物序列Table 1 Primers sequence of real time PCR
1.5 干眼模型的制作
实验组皮下注射0.8 mL东莨菪碱(5 mg/mL),对照组注射等量生理盐水(溶剂),各一天4次。分别于给药第0、3、6、9、12天观察眼表,检测泪液分泌量以及角膜荧光素钠染色拍照记录,待泪液下降至5 mm以下以及出现角膜荧光素钠染色阳性,造模完成[15-17]。
1.6 泪液的测量和荧光素钠染色
泪液分泌量采用Schirmer实验,即:将泪液检测滤纸条一端反折5 mm,置于下眼睑外侧1/3处结膜囊内,5 min后取出,读取泪液浸入的长度。每次测量重复3次,取均值为最终测量值。分别在实验前和实验第3、6、9、12天按照如上方法行泪液分泌情况的检测并记录。
1.7 局部应用上皮钠通道抑制剂阿米洛利
阿米洛利粉剂溶于生理盐水中,配成100 mmol/L滴眼剂,8只干眼模型制作完成后,右眼用阿米洛利滴眼,作为治疗组别,左眼滴用溶剂生理盐水,作为自身对照,分别于第3、6、9、12天进行荧光素钠染色和泪液分泌检测。
1.8 MTT实验
用0.25%胰蛋白酶消化并收集新西兰兔结膜上皮细胞,并计数细胞,制成细胞悬液[18-21]。以2.0×104/mL、100 μL/孔接种于96孔板上,加入含体积分数20%胎牛血清的DMEM培养液,37℃,体积分数5%CO2培养箱中培养24 h。将上皮钠通道抑制剂阿米洛利储存溶液倍比稀释为工作液终浓度分别为 10×104、10×103、1000、100、10、1 μmol/L,对照组不加,每个浓度设置6个复孔,于24 h取出96孔板,每孔加入5 mg/mL MTT 20 μL继续培养2 h,终止培养,吸弃孔内上清;每孔加入150 μL DMSO与无水乙醇的混合液(体积比1∶1)震荡10 min,使结晶物充分溶解;在酶标仪上,以波长570 nm测定各孔光密度(Optical density,OD)值;以测定孔OD-空白孔OD表示每组的实际OD值;以正常对照组的细胞活力为100%,各实验组的细胞活力=实验组OD的实际值/对照组OD的实际值。
1.9 统计学处理
数据采用SPSS 20.0、GraphPad prism5进行处理分析。数据以均数 ±标准差(±s)表示。两组之间比较采用单样本t检验。多组间的比较采用one-way ANOVA(方差齐时)或Welch法(方差不齐时),两两比较采用Tukey′s multiple comparison test。不同时间的泪液测量采用重复测量方差分析法。以P<0.05为差异有统计学意义。
2 结果
2.1 东莨菪碱诱导的干眼模型的病理现象
2.1.1 泪液分泌检测结果 实验组和对照组泪液分泌的比较如表2,由此可看出造模组注射SCOP第3天泪液分泌量明显下降,随时间延长,泪液分泌量进行性递减,在第12天降至5 mm以下,为(4.42±1.34)mm,与对照组相比泪液分泌量显著下降(t=13.363,P<0.001,n=8)。
2.1.2 角膜荧光素钠染色 在第3、6、9、12天进行荧光素钠染色,实验中观察到模型组兔角膜第6天开始出现点状荧光素钠染色,第12天出现片状染色,对照组荧光素钠染色阴性(图1)。
2.2 兔结膜上皮在不同状态下的钠电流变化
三组间方差分析,F=72.41,P<0.001,n=8/groups。短路电流结果见图2。对照组中兔子结膜上皮钠电流大小为(5.72±0.35)μA/cm2(n=8),实验组钠电流升高至(12.24± 0.54)μA/cm2(n=8),两组之间有统计学差异(P<0.001)。治疗组经过上皮钠通道特异性阻滞剂阿米洛利(100 mmol/L)连续点眼12 d、每天3次后,同未经过治疗的实验组相比,其钠电流大小明显降低,降至(4.00±0.61)μA/cm2,与正常组相比无统计学差异(图3,P≥0.05)。

表2 东莨菪碱对泪液分泌的影响Table 2 The effect of scopolamine on tear secretion [(n=8 pairs,X ± S,mm/5 min)]
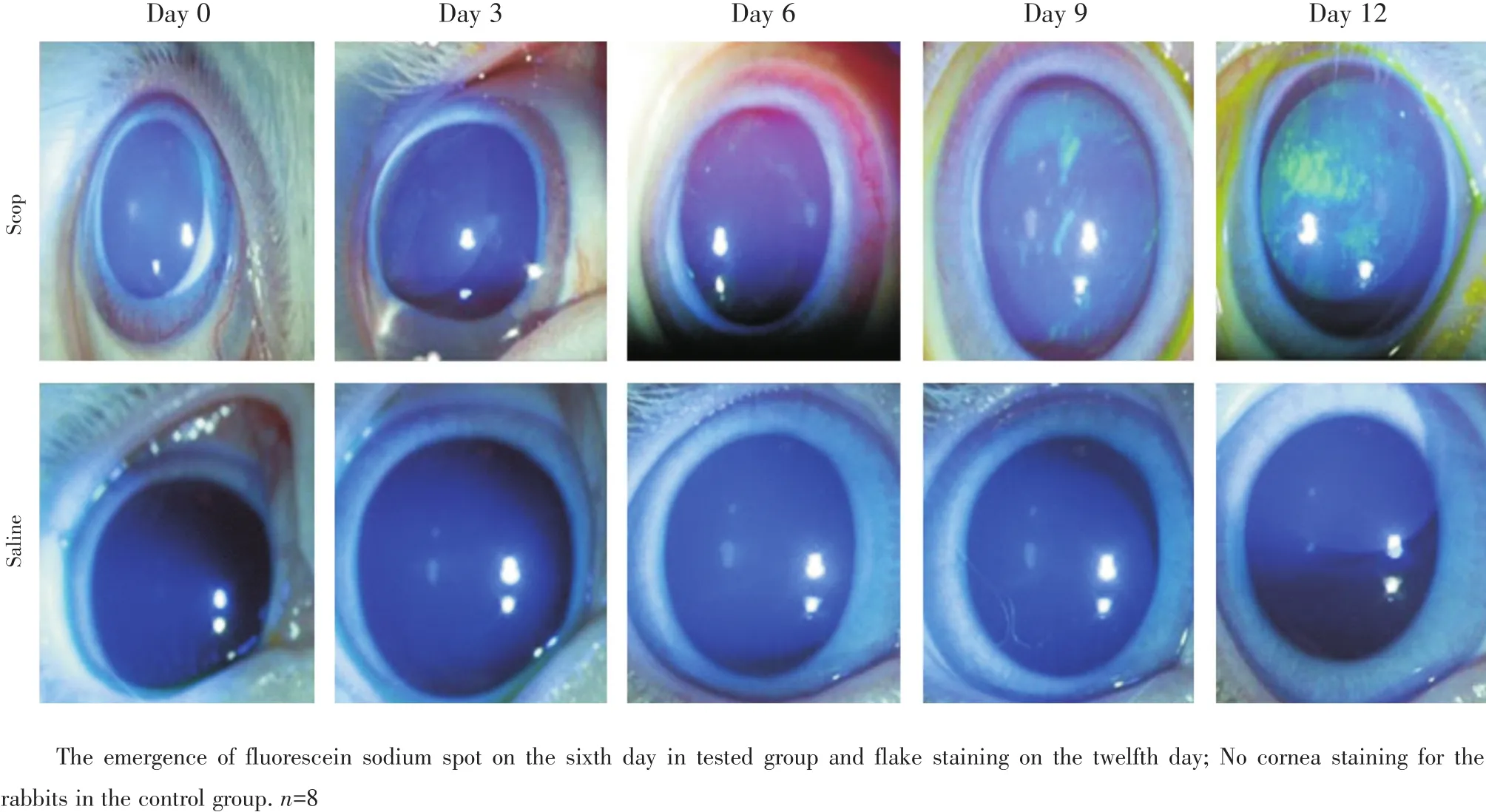
图1 兔角膜荧光素钠染色照相Fig.1 Fluorescein sodium staining of rabbit’s cornea
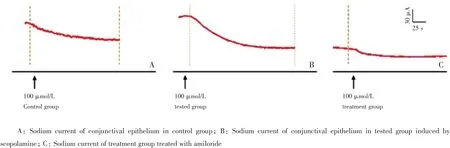
图2 上皮钠通道介导的钠电流Fig.2 Sodium current mediated by epithelial sodium channel
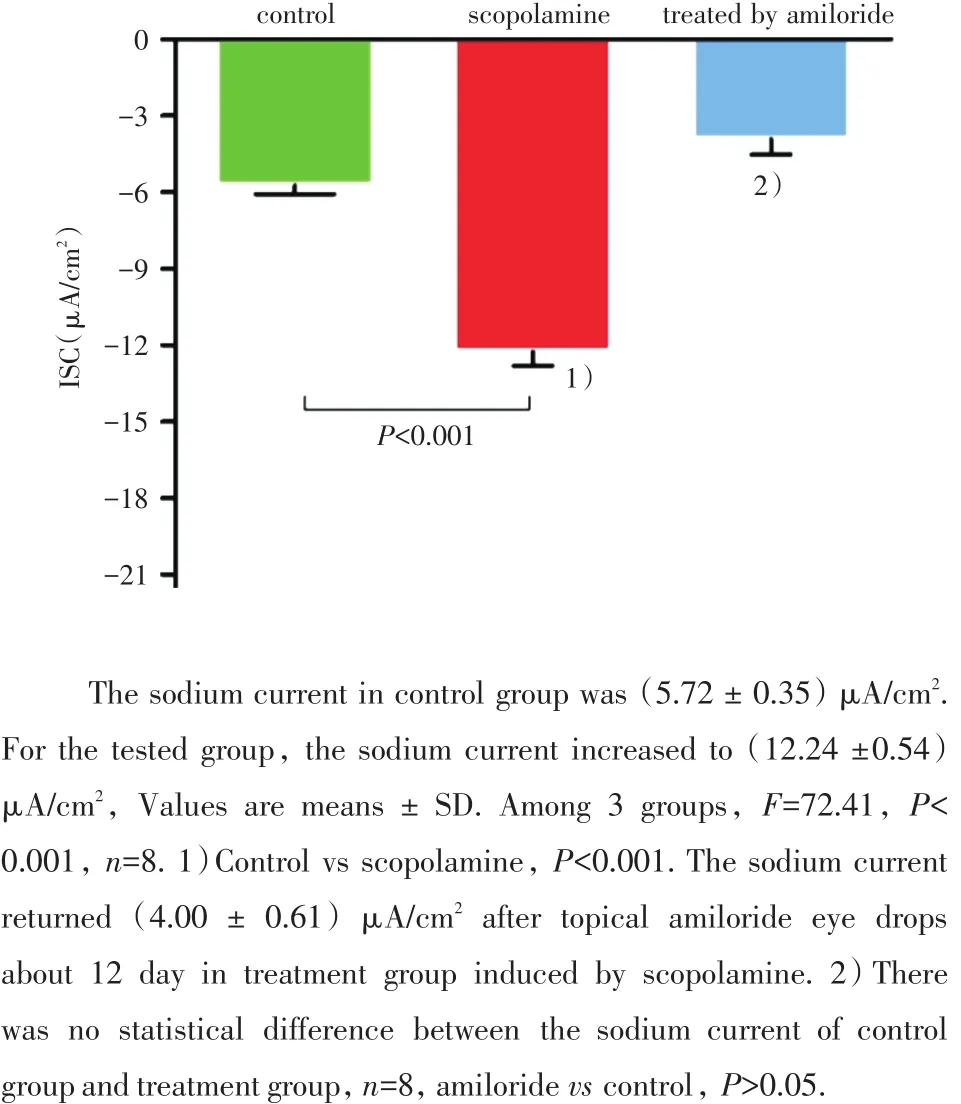
图3 上皮钠通道介导的钠电流统计学结果Fig.3 Statistical results of sodium currents mediated by epithelial sodium channels
2.3 兔结膜上皮钠通道基因在干眼症治疗前后的变化
取下对照组、实验组、治疗组的结膜上皮,通过荧光定量PCR方法检测上皮钠通道ENaCα、ENaCγ以及炎症因子IL-1β,结果显示,实验组中ENaCα、ENaCγ以及炎症因子IL-1β表达升高,并且具有统计学差异(P<0.01)。治疗组经过阿米洛利点眼后,ENaCα、ENaCγ以及炎症因子IL-1β表达下降,与对照组组相比,差异无统计学意义(P>0.05,图4)。
2.4 局部滴用上皮钠通道阻滞剂后眼表的变化
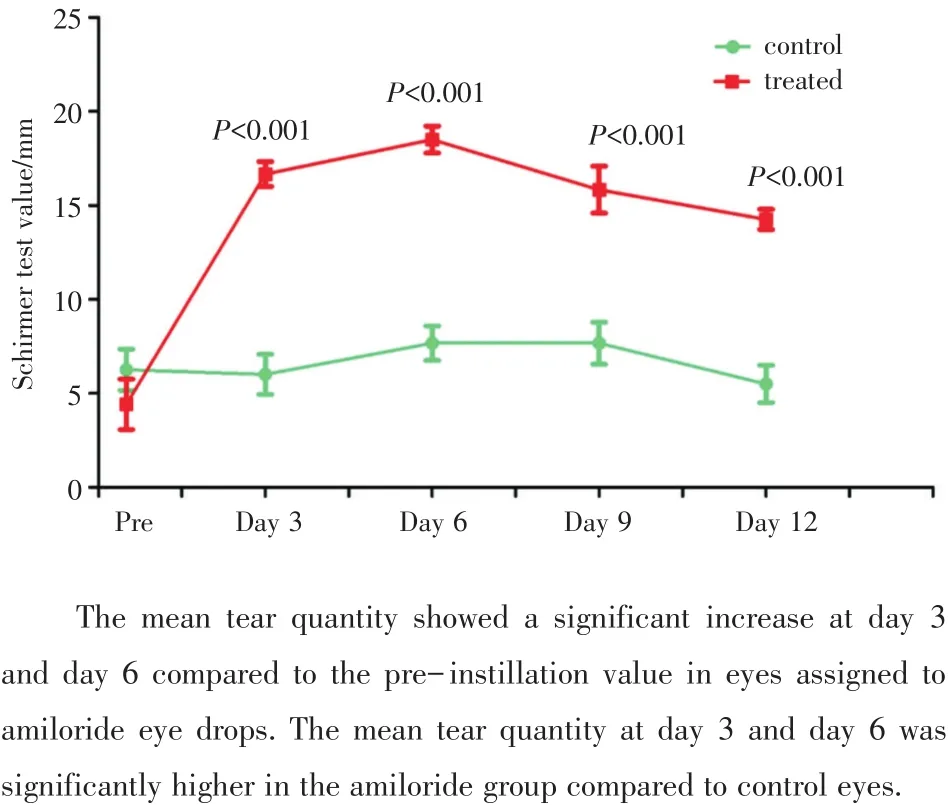
图5 阿米洛利点眼后泪液分泌浸入长度的变化趋势Fig.5 The variation trend of tear’s quantity after amiloride application in dry eye model rabbit
治疗前,右眼泪液分泌量为(4.42±1.30)mm,左眼泪液分泌量为(6.25± 1.10)mm(图5),左右眼荧光素钠染色皆为片状染色(图6)。治疗第3天,右眼泪液分泌增加至(16.67±0.67)mm,具有统计学差异(F=36.64,P<0.001,n=8),荧光素钠染色显示上皮缺损减轻,第6天泪液分泌浸入长度达到顶峰并维持一段时间,上皮染色范围局限在第一象限,随着给药时间延长,泪液分泌趋于正常,上皮染色逐渐减轻,治疗第12天右眼泪液为(14.25± 0.54)mm(n=8,F=36.64,P=0.000)。左眼未给予治疗,作为自身对照。左眼第3、6、9、12天泪液分别为(6.00±1.06、7.60±0.92、9.30±2.04、5.50± 0.99)mm(与治疗前相比,P皆>0.05,n=8;多组间比较,F=0.002,P=0.965)。
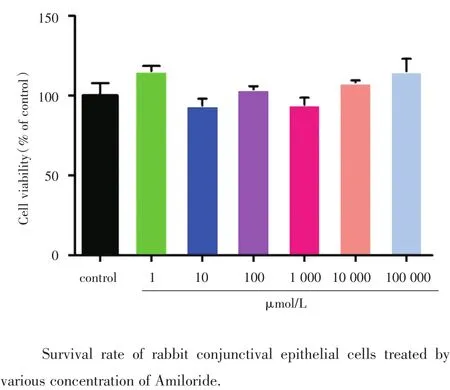
图7 MTT检测细胞存活率柱状图Fig.7 Histogram of cell survival by MTT
2.5 MTT法检测阿米洛利对兔结膜上皮细胞体外增殖的影响
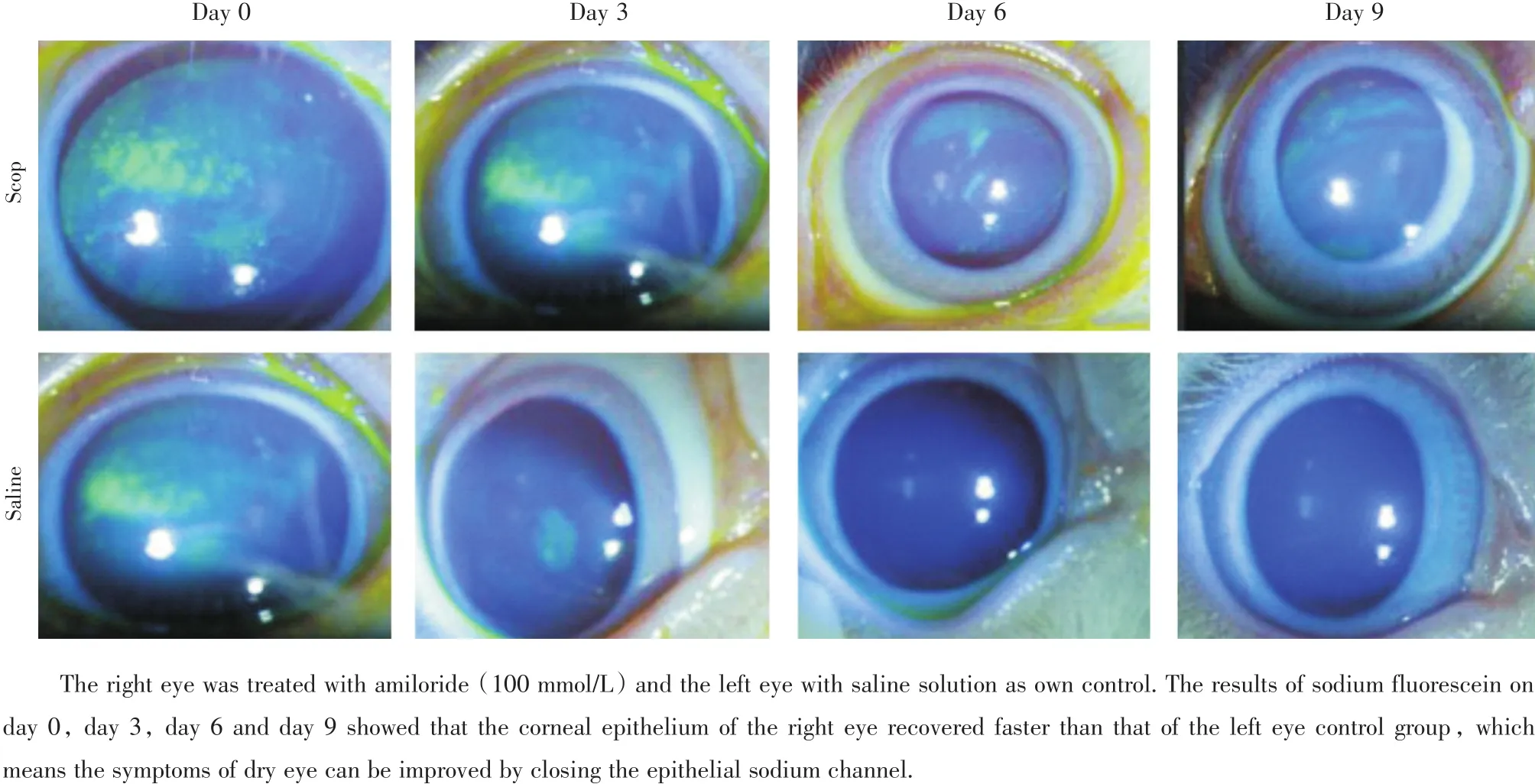
图6 干眼症模型兔用阿米洛利点眼后角膜上皮的变化Fig.6 Changes of corneal epithelium after amiloride eye drops for the rabbits in tested group
阿米洛利对兔结膜上皮细胞没有细胞毒性,不能抑制细胞增殖(图7,F=2.365,P>0.05,n=6)。
3 讨论
目前传统治疗干眼症的方法主要是滴人工泪来维持眼表湿润,或者通过刺激泪腺分泌缓解干眼症状[22]。
最近有文献报道P2Y2受体激动剂,地瓜磷酸可以促进泪液分泌,改善干眼症状,促黏蛋白分泌的药物如DE-089和15-S-HETE也可以改善干眼症[23]。因为结膜上皮是一层“分泌型”上皮[24],我们提出使用局部阿米洛利滴眼液的想法,希望通过抑制结膜上皮钠通道来增加眼表泪量。我们认为,这种抑制会导致眼表上皮对“现存的眼表泪液”的吸收受到抑制,从而增加泪液向眼表的分泌。在验证这一假说之前,我们进行了短路电流实验,以证实上皮钠通道在兔结膜组织中的存在。
本研究中,我们应用上皮钠通道特异性阻滞剂作用于兔结膜上皮面观察离子转运,确定了ENaC存在于结膜上皮顶膜面,接着我们通过对兔皮下连续注射东莨宕碱12 d,建立泪液分泌不足型干眼模型,根据临床检测指标泪液分泌量和角膜荧光素钠染色来确定干眼模型的可靠性。下一步,我们对兔进行局部阿米洛利滴眼液滴眼,观察泪液量随时间的变化。考虑到眼表的自身修复作用,我们采取了自身对照的方法,即让右眼接受阿米洛利的治疗,左眼仅仅滴用等量溶剂生理盐水,结果,在治疗的第3天,右眼泪液逐渐增多,并且持续升高,到第6天达到高峰,左眼泪液分泌量无明显变化。我们注意到,尽管接受阿米洛利滴眼液的眼睛的眼表泪液分泌量随后继续增加,眼表染色减轻直至恢复至完整状态,对侧的盐水滴眼液的泪量无明显改变,但是眼表染色减轻,可能是由于左右眼之间存在神经反馈作用所致。
本研究发现,东莨菪碱诱导的干眼症组钠电流增大,即钠离子过度被吸收,这个现象最先在囊性纤维化病患者呼吸道黏膜上皮中发现,Huang等[25]在异源表达系统中证明了CFTR(囊性纤维化跨膜转导调节因子)对上皮钠通道的抑制作用,解释了该现象。但是右眼经过阿米洛利连续12 d的治疗,钠离子通道的开放逐渐减少并恢复至正常。接下来,我们检测了正常对照组,干眼症模型组,以及治疗组的ENaC,IL-1β基因表达变化,结果,我们发现干眼症组的ENaC亚基以及炎症因子IL-1β基因表达升高,经过12 d的治疗后,治疗组与正常组之间,ENaC亚基以及炎症因子IL-1β基因表达,差异无统计学意义。此外,我们通过体外实验,MTT显色法检测阿米洛利对兔结膜上皮增殖的影响,该药物对结膜上皮细胞无明显抑制作用。通过在体实验,兔子接受阿米洛利局部点眼过程中,眼表无充血红肿,无分泌物。
本研究不足之处在于未对结膜上皮钠离子的整个转运信号通路做出研究,接下来的研究将着重探讨钠离子的转运以及调控机制,进一步解释干眼症中钠离子通道的病理生理改变。
综上所述,我们提出并且验证:结膜上皮钠离子过度吸收是干眼症发病机制之一,并针对该靶点,通过关闭该通道来治疗干眼症,泪液分泌增加,促进角膜上皮修复,改善干眼症状,有望成为治疗干眼症中新的选择。
