对胃腺癌变异基因、临床病理特征、治疗及预后关系的探究
2019-02-28李永刚张有成
李永刚 张有成
兰州大学第二临床学院普外科,甘肃省兰州市 730000
胃癌是最常见的消化道肿瘤之一,其发病率居第四位,而在恶性肿瘤中致死率排第二位。在中国,胃癌死亡率居高不下,严重影响人们的生命健康和生活质量。据国内外研究[1],胃癌的发生发展是一个多因素、多环节、多个基因共同参与的复杂过程,其中,关于胃腺癌基因检测的探究已成为当今胃癌研究的热点,并取得了惊人的成效。随着生物化学、基因工程的发展,可以对癌症中基因组、转录组、外显子组进行更全面的深度精确测序,为对癌症更精确地诊断和分类,进行个体化治疗、合理预后评估及靶向抗癌药物的研发提供一定的依据。
1 对象与方法
1.1 研究对象 搜集2012—2016年我院具有完整病历资料,经电子胃镜病理活检、转移淋巴结切取或穿刺活检及手术切除标本病理或其他转移病灶穿刺活检确诊Ⅲ或Ⅳ期的胃腺癌患者48例,所有患者均行突变基因检测。肿瘤分期根据国际抗癌联盟/美国癌症联合委员会(UICC/AJCC)胃癌TNM分期标准(2010)[2]。
1.2 方法 对选取的48例患者的病历资料进行回顾性分析,包括性别、年龄、EGFR、ROS1、ALK基因突变情况(采用FISH法进行检测)、病理分级、TMN分期、淋巴结转移、劳伦斯分型、治疗情况,所有首检患者的预后中位生存期以年计,以初治日期为起点,死亡日期为终点。生存数据收集至2016年12月。PFS计算自确诊时间开始至疾病复发转移或者死亡的时间。
1.3 统计学方法 采用SPSS19.0统计分析软件进行数据处理,统计学处理主要是构成比计算的统计学描述方法。χ2检验用于判断性别、年龄、病理类型、淋巴结转移等构成比的差异,生存分析采用Kaplan-Meier、Log-rank和Cox回归进行检验和多因素分析;采用α<0.05作为检验标准。P<0.05表示差异有统计学意义。
2 结果
2.1 临床病例资料 本组48例患者中,男31例,女17例;Ⅲ期25例,Ⅳ期23例;淋巴结转移35例,淋巴结未转移13例;劳伦斯分型中,弥漫型33例,肠型8例,混合型7例。见表1。
2.2 EGFR基因突变与临床病理之间的关系 所选48例胃腺癌患者中,EGFR基因突变的患者有31例,其阳性率为64.58%。经统计学分析,EGFR基因突变在不同性别、淋巴结有无转移、临床分期及劳伦斯分型之间差异具有统计学意义(P<0.05)。见表2。
2.3 ALK及ROS1基因突变与临床病理之间的关系 所选48例胃腺癌患者中,ALK基因突变的患者有15例,其阳性率为31.25%;ROS1基因突变的患者有4例,其阳性率为8.33%。经统计学分析,ALK及ROS1基因突变在不同性别、淋巴结有无转移、临床分期及劳伦斯分型之间差异无统计学意义(P>0.05)。见表3。
2.4 EGFR有无突变患者的OS(总生存期)和TTP(疾病进展时间)比较 对48例胃腺癌患者均进行了EGFR基因检测后进行跟踪调查分析,发现EGFR突变阳性患者中位生存期要低于未突变基因患者,且差异具有统计学意义(P<0.05),见表4。
2.5 影响胃腺癌患者预后的因素 对48例胃腺癌者进行单因素分析,不同性别(χ2=2.156,P>0.05)、有无淋巴结转移(χ2=3.612,P>0.05)、劳伦斯分型(χ2=1.847,P>0.05)患者的中位生存期差异无统计学意义。而临床分期不同的患者中位生存期差异有统计学意义(χ2=4.195,P<0.05)。采用Cox回归分析表明,临床分期是独立预后影响因素(P<0.05),而其他因素包括性别、淋巴结有无转移和劳伦斯分型与生存期无关,见表5。

表1 48例胃腺癌患者的临床病理资料
3 讨论
胃癌在我国的发病率和死亡率逐年升高,愈加威胁人们的生命健康。因此,对胃癌更深入的了解更加迎合社会发展的需要。据研究表明[3],对进展期胃癌患者,只有人表皮生长因子受体2基因阳性患者,才能通过化疗联合靶向治疗以期待延长生存时间。但是,在这些患者中,人表皮生长因子受体2基因阳性率不足25%,而在我国其阳性率更低[4]。

表2 EGFR基因突变和临床病理特征关系
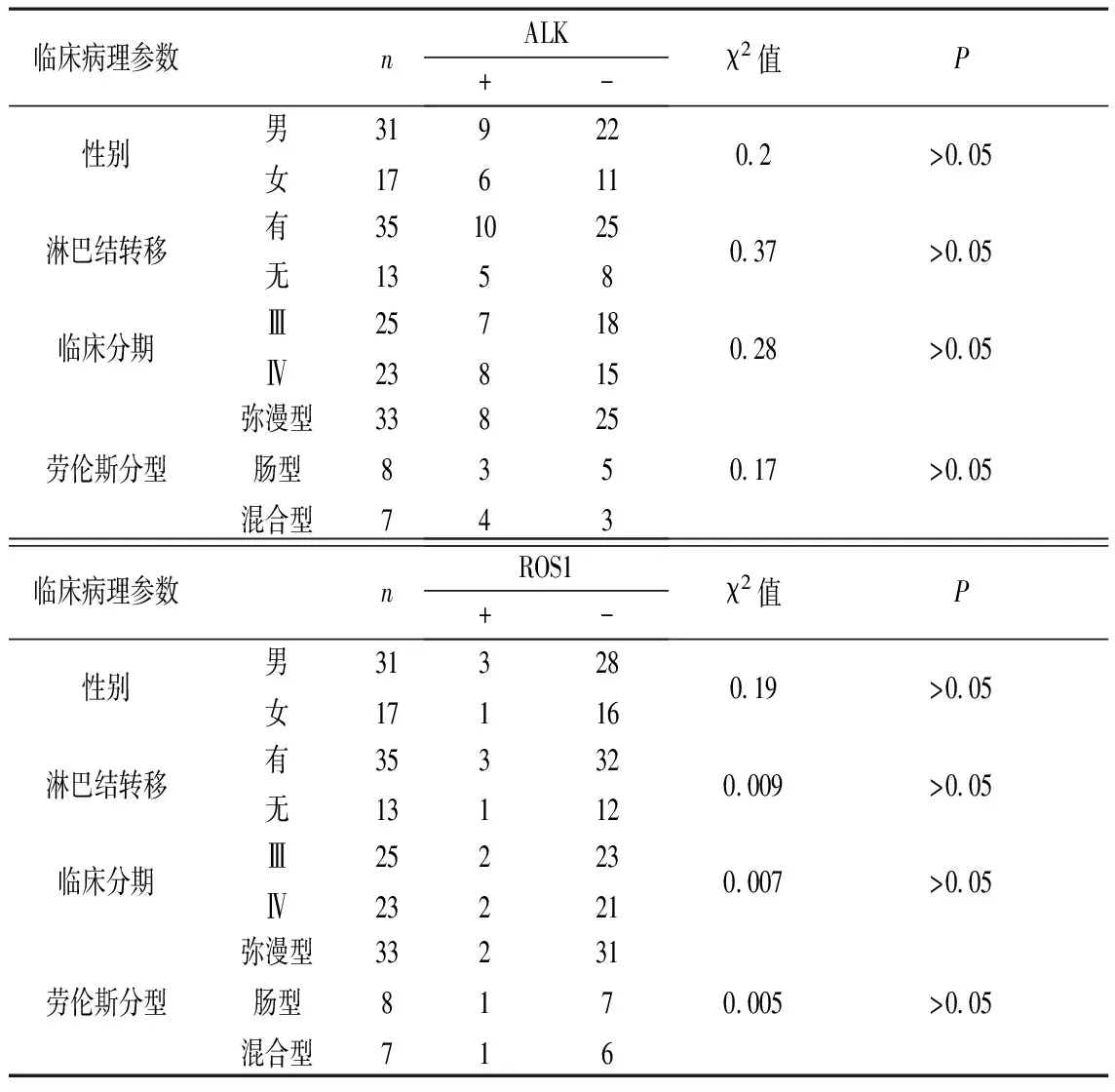
表3 ALK及ROS1基因突变与临床病理特征关系

表4 EGFR突变对OS和TTP比较
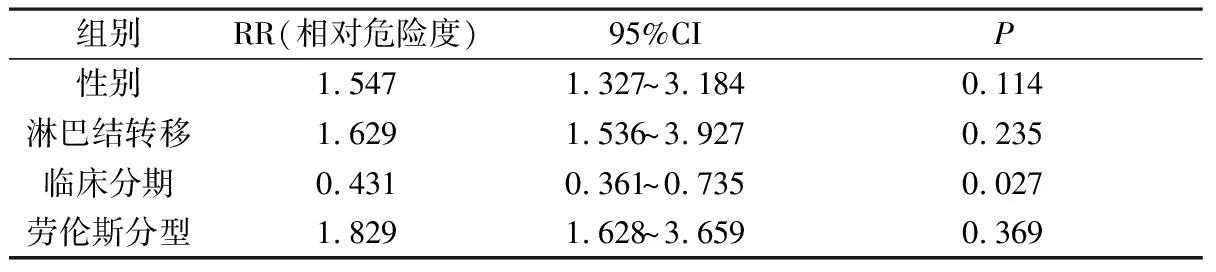
表5 影响胃腺癌患者预后的因素
因此对进一步探索胃癌新的靶向治疗更迫在眉睫。EGFR是表皮生长因子受体家族成员之一,表皮生长因子受体家族在细胞生理过程中发挥重要作用,EGFR信号通路对细胞的生长、增殖和分化等生理过程发挥重要的作用。ALK最早是在间变性大细胞淋巴瘤(ALCL)的一个亚型中被发现的,因此定名为间变性淋巴瘤激酶(ALK)。随后,在发现非小细胞肺癌中有ALK基因重排之前,在弥漫性大B细胞淋巴瘤和炎症性肌纤维母细胞瘤(IMT)中分别发现了有多种类型的ALK基因重排,至此证明ALK是强力致癌驱动基因[5-6]。ROS1是1982年在曼彻斯特大学肿瘤病毒2(UR2)鸟肉瘤病毒中发现的一种具有独特致癌作用的病毒原癌基因。其致病机理已被证实,ROS1受体酪氨酸激酶参与激活多条下游信号转导通路,调控肿瘤细胞的生长、增殖、分化及细胞周期[7]。
根据此实验研究结果,EGFR在胃癌组织中的阳性表达率明显高于相应癌旁组织,EGFR在胃癌组织中的阳性表达率与不同性别、淋巴结有无转移、临床分期及劳伦斯分型密切相关。同时,发现EGFR突变阳性患者中位生存期要低于未突变基因患者,且差异具有统计学意义(P<0.05),此结果表明EGFR基因突变与胃腺癌的发生发展有着密切关系,提示EGFR可能是反映胃癌严重程度的重要指标,也是胃癌患者预后的不良指标。Demeure 等[8]发现在乳头状甲状腺癌中ALK和EML4的融合可导致ALK的连续性激活,形成肿瘤生长及存活的通路,是肿瘤发生过程中的驱动事件。原癌基因ROS1酪氨酸激酶属于RTK家族,是非小细胞肺癌的驱动基因,因此,ALK及ROS1基因突变可能存在与胃癌相关的基因变异,这些基因变异可能与胃腺癌的发生发展存在一定的联系。然而,进一步对ALK、ROS1基因突变与胃腺癌临床病理特征分析后,并未发现这两个基因突变与性别、淋巴结有无转移、临床分期及劳伦斯分型等病理特征存在明显相关性。鉴于本次实验研究样本量较少,这两个基因突变与胃腺癌发生发展的关系有待进一步研究。通过对48例胃腺癌者进行单因素分析,不同性别、有无淋巴结转移、劳伦斯分型患者的中位生存期差异无统计学意义。而临床分期不同的患者中位生存期差异有统计学意义。因此早期发现胃癌,对患者预后及生存质量和生存时间有非常重要的意义。
EGFR基因突变与临床病理特征存在明显相关性,对胃腺癌患者中EGFR基因突变阳性,应开展化疗同时靶向治疗,以提高患者预后。而ROS1、ALK突变基因可能与胃腺癌发生存在一定相关性,但与临床病理特征未发现明显相关性。应进一步提高样本量及检测技术,以期待发现ROS1、ALK突变基因与胃腺癌发生发展的联系,为探究进展期胃腺癌的靶向治疗开辟新道路。胃腺癌患者应行突变基因检测,对该患者实施个体化治疗有临床意义。
