α芋螺毒素MI分支肽的合成及免疫原性研究
2019-02-28陈荣芳余硕周良燚张学荣戴秋云
陈荣芳,余硕,周良燚,张学荣,戴秋云
1.广西医科大学 蛇毒研究所,广西医科大学 基础医学院,广西 南宁530021;2.军事医学研究院 生物工程研究所,北京100071
α芋螺毒素MI 来自幻芋螺(Conus magus),其氨基酸序列为GRCCHPACGKNYSC-NH2[1],含2 对二硫键(连接方式为Cys3-Cys8,Cys4-Cys14[2])。MI 作用于肌肉型烟碱乙酰胆碱受体,对小鼠的半数致死剂量约10 μg/kg(腹腔注射)[2-4],我们实测为15~20 μg/kg,是目前发现的毒性最强的芋螺毒素。MI 可导致中毒对象肌肉瘫痪及麻木,呼吸困难,心肌损害,心搏停止乃至死亡[1]。
目前MI 中毒无有效治疗药物,也未见MI的抗毒血清报道,仅见结构相似的α芋螺毒素GI 抗血清对MI的解毒效果报道[5]。GI与孔蓝蛋白或卵清蛋白偶联后免疫山羊,制备的抗血清对GI 及MI的保护活性不高[5]。本实验室开展了GI-BSA(牛血清蛋白)偶联物免疫后制备的小鼠抗血清工作,发现GI 抗血清对GI 中毒小鼠有一定的保护作用,但活性仍不高[6]。其原因可能是α芋螺毒素GI 通过戊二醛偶联蛋白载体时反应位点多,影响了GI的抗原表位,导致抗血清活性不高。
多抗原肽系统(multiple antigen peptide sys⁃tem,MAPs)由小的核心基质与围绕核心基质的高密度抗原肽形成,与常规的肽-载体蛋白相比抗原密度更高,免疫原性增强,已用于多肽抗体及疫苗的研发[7-8]。为制备MI 抗血清,我们采用点击反应制备了MI 多分支肽,保持MI 抗原表位的完整性,然后免疫小鼠,测定其抗体滴度与抗毒活性。结果表明,成功制备了MI 八分支抗原,但其免疫抗原性较低,抗血清的抗毒活性不佳。
1 材料与方法
1.1 材料
KM 小鼠(雌雄各半,18~20 g)及BALB/c 小鼠(雌性,5周龄,17~19 g)购自斯贝福(北京)生物技术有限公司)。有机合成用试剂9-芴甲氧琥珀酰亚胺基碳酸酯(Fmoc-OSu)、三异丙基硅烷(TIS)、三[(1-苄基-1H-1,2,3-三唑-4-基)甲基]胺(TBTA)、抗坏血酸钠、Boc-Lys-OH、3-丁炔-1-醇、三光气等购自北京伊诺凯科技有限公司。多肽固相合成用试剂Rink 树脂(取代率0.6 mmol/g)购自天津南开合成有限公司,Fmoc 保护氨基酸、苯并三氮唑-N,N,N',N'-四甲基脲六氟磷酸盐(HBTU)、1-羟基苯并三唑(HoBt)等购自上海吉尔生化有限公司,二甲基甲酰胺(DMF)、哌啶、二氯甲烷(DCM)、无水甲醇(MeOH)、无水乙醚等购自国药集团化学试剂有限公司,二异丙基二乙胺(DIEA)、三氟乙酸(TFA)等购自北京伊诺凯有限公司。ELISA检测试剂辣根过氧化物酶标记的山羊抗体、TMB 底物显色试剂盒等购自康为世纪生物科技有限公司。其他常规化学试剂等购自国药集团化学试剂有限公司。
旋转蒸发仪(日本EYELA 公司);循环水式真空泵(郑州长城科工贸有限公司);多肽固相合成仪(德国Zinsser analytic 公司);冻干机(德国Christ 公司);Waters 625 高效液相色谱仪(Waters公司);安捷伦1200 型高效液相色谱仪(安捷伦科技有限公司);核磁共振仪(日本JEOL 公司);mi⁃croTOF QII 质谱仪(德国布鲁克公司);酶标仪(赛默飞世尔科技有限公司)。
1.2 Fmoc-Lys(butynyl)-OH 合成
按文献[9]先合成Boc-Lys(butynyl)-OH,再用4 mol/L HCl 脱去保护基,所得白色固体(2.38 g,9.83 mmol)和碳酸钠(1.04 g,9.83 mmol)溶于30 mL 四氢呋喃(THF)水溶液中(THF∶水=2∶1),冰浴冷却后,缓慢滴加Fmoc-OSu(3.31 g,9.83 mmol)THF 溶液(10 mL)。室温搅拌过夜,反应完成后旋去THF,乙酸乙酯萃取4~5 次,无水硫酸钠干燥,旋蒸后经硅胶柱纯化,获得3.52 g Fmoc-Lys(butynyl)-OH。
1.3 MI 多分支抗原的合成
C端连接的MI 多分支抗原合成路线见图1,N端连接的MI 多分支抗原路线与此相同。
1.3.1 含炔基MI 线性肽及含叠氮的赖氨酸多分支肽的合成 采用Fmoc-固相多肽合成法[10],应用自动合成仪合成含炔基MI 线性肽MI-1、MI-2及含叠氮的赖氨酸多分支肽(D),序列如下:
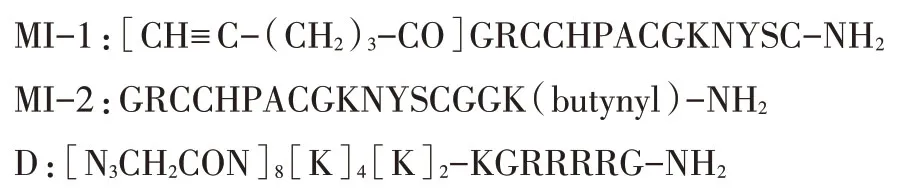
然后将肽树脂裂解(裂解液:TFA/DTT/H2O/TIPS=44/2.5/2.5/1,v/w/v/v),旋蒸除去大部分TFA后加入预冷的无水乙醚4℃沉淀,G4 漏斗过滤得到粗肽。
1.3.2 含炔基MI 线性肽的氧化折叠及纯化 采用空气氧化法折叠线性肽[11]。多肽折叠采用0.1 mol/L的NH4HCO3溶液(肽浓度为0.3 mg/mL),氨水调pH值至8.0,室温搅拌24 h,用HPLC 监测折叠产物。折叠完成后,用冰醋酸调pH 至5 终止折叠,反向高效液相色谱(RP-HPLC)法除盐、富集。
采用高效液相色谱纯化粗肽,纯化柱为C18半制备柱(Kromasil,300 Å,10 mm×250 mm)。色谱条件:0~2 min 5%~10% B,2~30 min 10%~60%B(依多肽不同流动相B 比例相应变化),30~31 min 60%~95% B,流动相A 为含0.1% TFA的去离子水,流动相B 为含0.1% TFA的乙腈,检测波长230 nm,流速3 mL/min。粗肽纯化后冻干,做HPLC 分析及质谱鉴定。
1.3.3 赖氨酸多分支肽的纯化 同1.3.2。
1.3.4 含炔基MI与D的CuAAc 反应(click 反应)采用铜[Cu(I)]催化叠氮-炔杂环化反应(Cu⁃AAc)[12-14],将含炔基MI 连接至赖氨酸多分支肽,合成N、C端连接的MI 多分支抗原。
溶解含炔基肽(16 eq)至190 μL DMF 中,分别 加 入D(1 eq)、CuSO4(1.6 eq)、TBTA(1.6 eq)。通氮气15 min后,加入抗坏血酸钠(4 eq),氮气保护下室温搅拌40 h,0、20、40 h 取样做HPLC 分析。产物经RP-HPLC 法纯化,分离柱为C8半制备柱(Kromasil,300,10 mm×250 mm)。
1.4 含炔基MI 腹腔注射毒性
KM 小鼠雌雄各半,随机分为MI-1 20 μg/kg组、MI-2 20、40 μg/kg 组,每组10只。腹腔注射200 μL后,记录小鼠死亡时间,小鼠死亡时间以x±s表示。
1.5 小鼠免疫
BALB/c 小鼠随机分为生理盐水组、N端连接的MI 八分支肽10、20 μg/只组、C端连接的MI 八分支肽10、20 μg/只组,每组10只。免疫前取阴性血清作为对照,共4 次免疫。基础免疫时,八分支肽与完全弗氏佐剂等体积混合,皮下注射加腹腔注射(注射体积200 μL)。基础免疫后每隔2周进行一次加强免疫,共进行3 次加强免疫,加强免疫时八分支肽与不完全弗氏佐剂等体积混合,免疫剂量和方式同基础免疫。
1.6 MI 八分支肽抗血清滴度测定
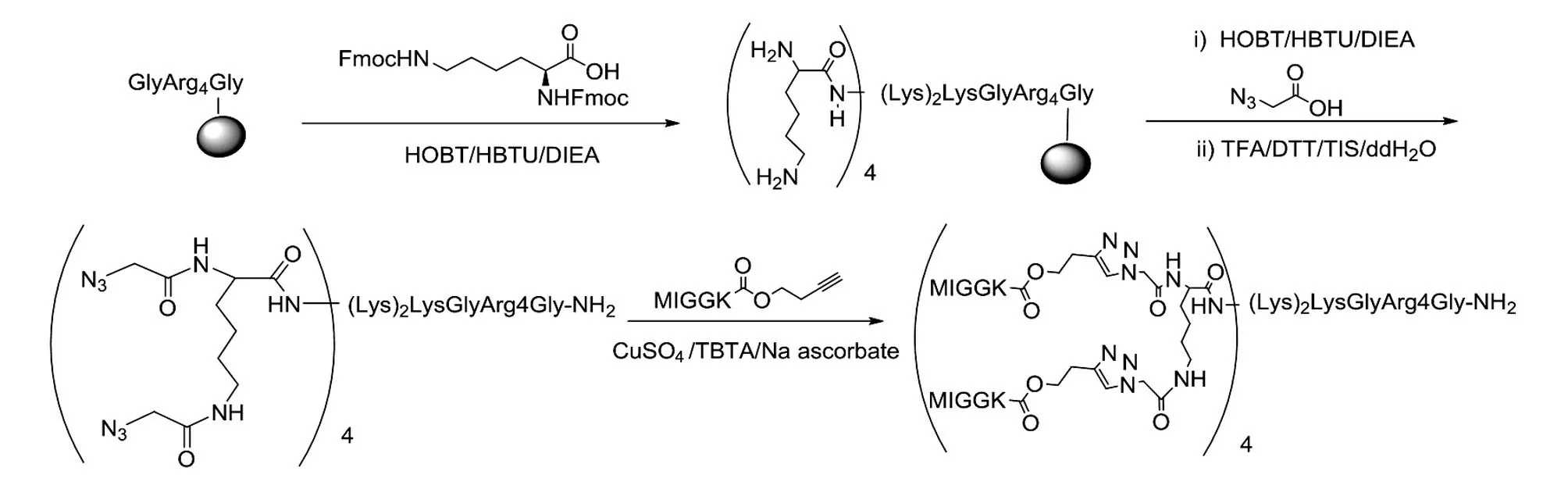
图1 C端连接的MI 多分支肽抗原的合成路线图
设生理盐水组、空白组及待测血清组,为保证实验准确性及重复性设2个复孔。各组血清采用相应的八分支肽作为包被抗原,包被量均为100 ng/孔,4℃包被过夜,PBST 洗4 次,5%脱脂奶粉封闭2 h,PBST 洗4 次,加入不同稀释度待测血清(一抗),孵育1 h,PBST 洗4 次,加辣根过氧化物酶标记的山羊抗鼠IgG(二抗),孵育30 min,PBST 洗4 次,TMB 底物显色15 min,再加0.5 mol/L 硫酸终止显色反应,酶标仪测D450nm及D600nm值。数据用Microsoft Excel 2010 处理。D值为D450nm值减去D600nm值。最终以生理盐水组的2.1倍为阳性判断标准。
1.7 中和活性实验
KM 小鼠(雌雄各半)随机分为6 组,即阴性对照组MI、生理盐水组、N端连接的MI 八分支肽组(10、20 μg/只)、C端连接的MI 八分支肽组(10、20 μg/只),每组10只,各组血清与MI(20 μg/kg)混合,37℃孵育40 min后腹腔注射,记录小鼠死亡时间。采用Log-rank 检验统计方法比较抗血清组与对照组的死亡时间差别。
2 结果
2.1 含炔基MI的合成
含炔基MI的线性肽、折叠产物及纯肽的HPLC 分析见图2。结果表明,MI-1、MI-2 线性肽折叠为一个主峰,纯化后多肽纯度均大于95%。质谱测定结果显示,MI-1、MI-2的M+1 峰值为1587.55 及1831.65,与其理论单同位素分子量1586.64、1830.76 一致。
2.2 MI 多分支肽的合成结果
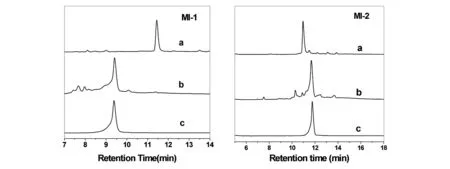
图2 含炔基MI 线性肽、折叠产物及纯肽的HPLC 分析图
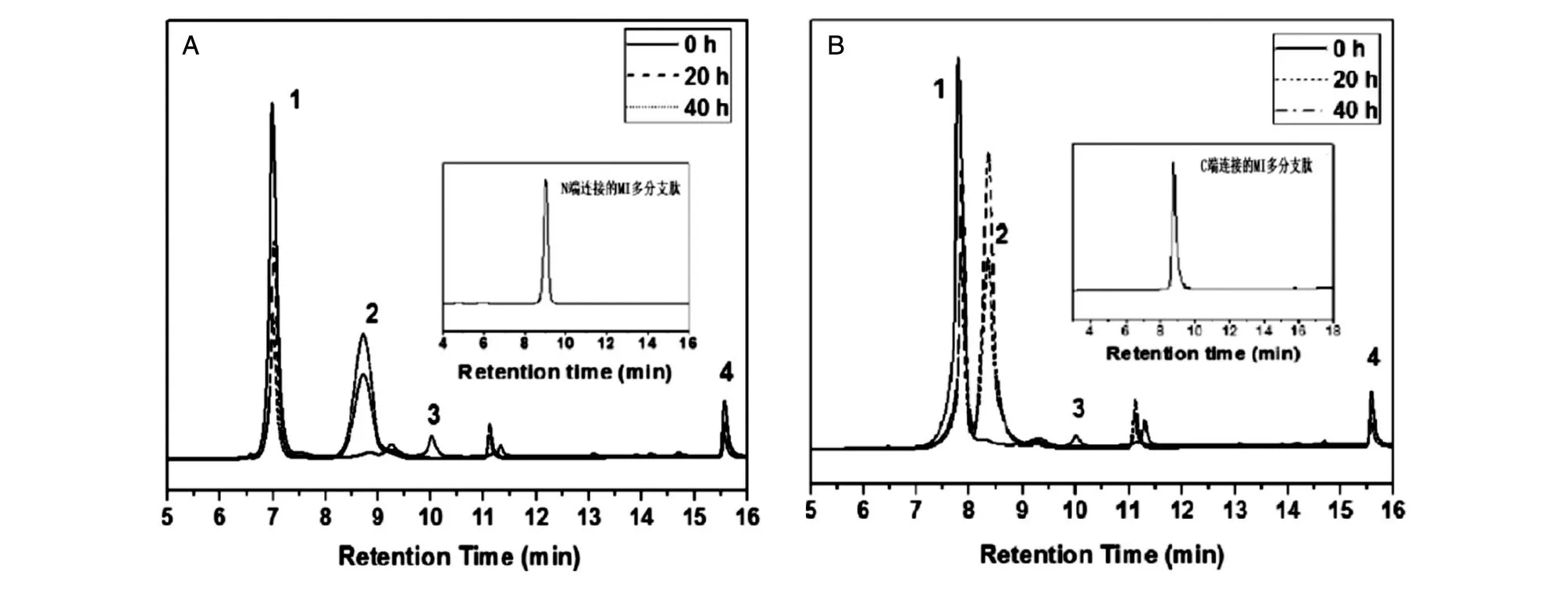
图3 N端(A)及C端(B)连接的MI 多分支肽点击反应产物及纯肽的HPLC 分析
含炔基MI与赖氨酸多分支肽的点击反应产物为一个主产物(图3)及反应原料,产物纯化后,质谱分析结果如图4 所示,均为八分支肽。

图4 MI 多分支肽的质谱分析图
2.3 含炔基MI 小鼠腹腔注射毒性
结果表明,N端连接炔基的MI(MI-1)的毒性有所降低,20 μg/kg MI-1 组的小鼠死亡率为50%,同样剂量的MI的死亡率为100%。C端连接炔基的MI(MI-2)20、40 μg/kg 剂量组的小鼠死亡率分别为0 及20%,明显低于MI。
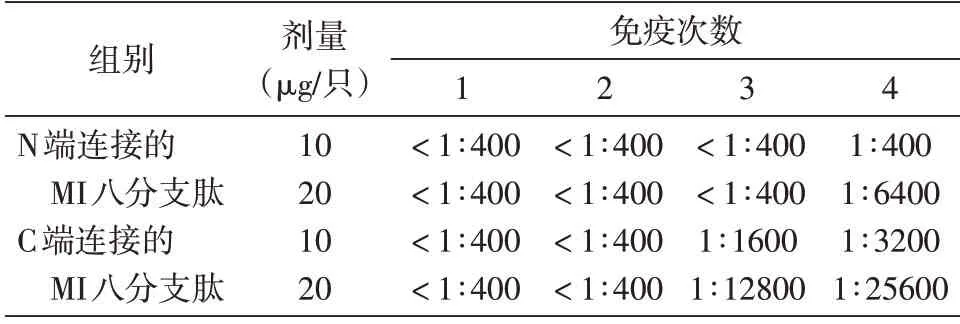
表1 小鼠血清抗体滴度测定结果
2.4 MI 八分支抗原的抗体滴度
MI 八分支抗原4 次免疫后2周采集的血清抗体滴度结果见图5 及表1。10、20 μg/只剂量的N端连接MI 八分支肽组第4 次免疫后血清抗体滴度分别为1∶400 及1∶6400,10、20 μg/只剂量的C端连接MI 八分支肽组第4 次免疫后血清抗体滴度分别为1∶3200 及1∶25 600。
2.5 抗血清的中和活性
各组血清与MI(20 μg/kg)的中和实验结果见图6 及表2。实验组与对照组小鼠死亡率均为100%,GraphPad Prism 做生存曲线图,Log-rank 检验对各组进行多重比较,统计结果分析显示小鼠死亡时间与对照组比较无显著差异(P=0.5855)。
3 讨论
赖氨酸分支肽连接多个精氨酸主要考虑增加目标分支肽的溶解度及穿膜性。考虑空间位阻对MI 多分支肽合成效率的影响,在MI的N端连接一个5-己炔酸、C端增加2个GG,结果表明MI-1 或MI-2的折叠效率仍很高,与赖氨酸多分支肽点击反应时效率较高。
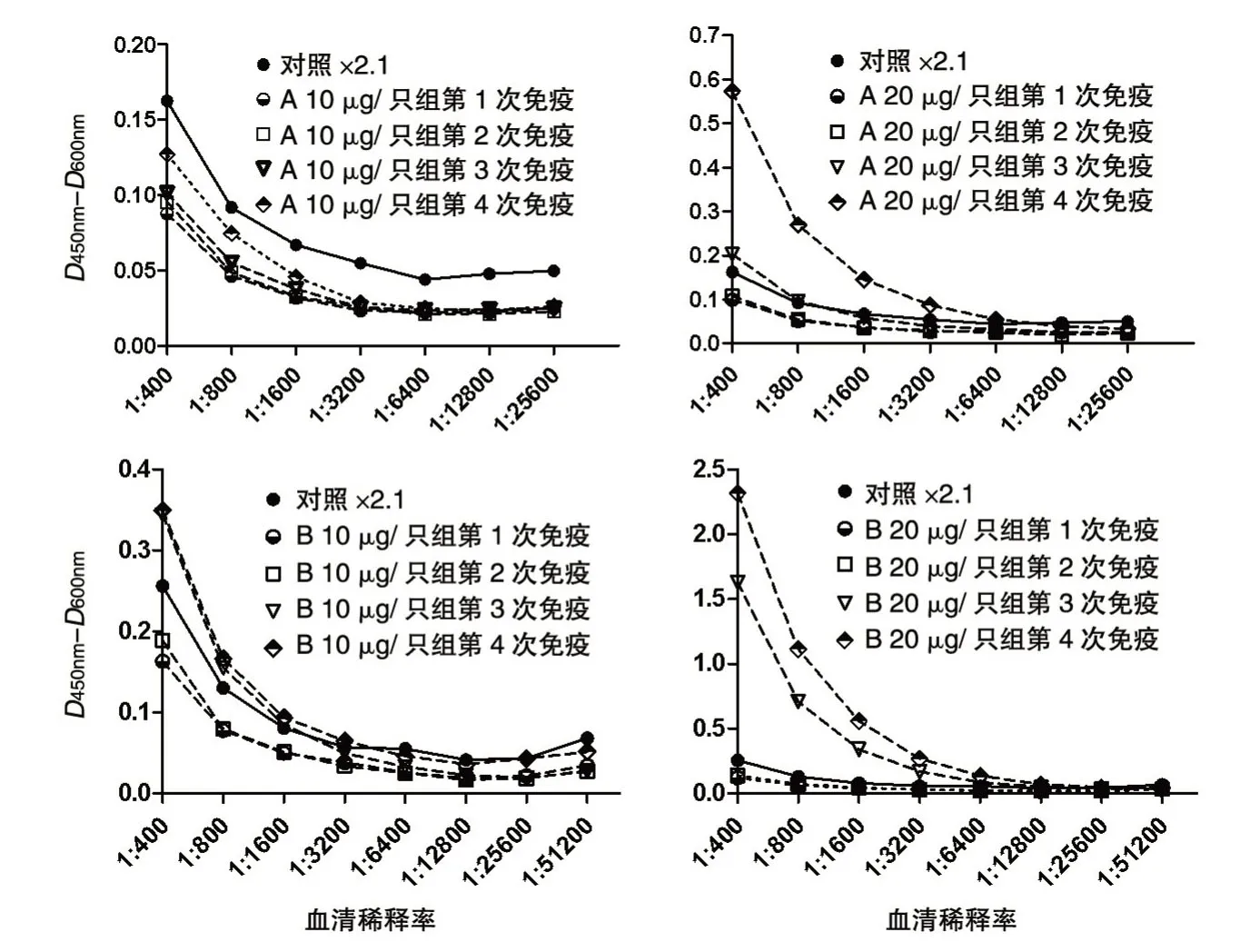
图5 小鼠血清抗体滴度测定结果
为使反应完全,我们采用含炔基MI与赖氨酸多分支肽的反应比例为16∶1,即含炔基MI与叠氮的摩尔比例为2∶1。为使抗坏血酸钠能有效还原二价铜离子为一价铜离子并尽可能减少对毒素二硫键的还原,须控制抗坏血酸钠的用量,一般采用抗坏血酸钠与含炔基MI的摩尔比例为1∶4。实验采用氮气保护,以防一价铜离子被氧化而丧失催化活性[15-16]。

图6 200 μL 血清与MI(20 μg/kg)中和结果

表2 200 μL血清与MI(20 μg/kg)中和实验结果(n=10)
免疫原性与其各自单体的毒性并无对应关系,由C端含炔基连接的MI 毒性低于N端含炔基连接的MI,但N端连接的MI 八分支肽组免疫后的抗血清滴度明显低于C端连接的MI 八分支肽组,且2个八分支肽的毒性较低,20 μg/只对小鼠无明显毒性。
MI 八分支抗原的免疫原性较低,抗血清的抗毒活性不高,原因可能是MI 本身免疫抗原性低,这与其序列短、亲水氨基酸多有关。
