花江峡谷岩生草本植物群落及其氮磷计量特征
2019-02-28敖家林
姚 凯,敖家林,徐 僡
(贵州师范大学生命科学学院,贵州 贵阳 550025)
中国西南喀斯特地区是具有海拔梯度大、地势格局复杂、生态脆弱等特征的独特环境单元[1],其土壤中的养分含量低下,而且极易流失[2],常常表现为N、P极度缺乏的状况[3],被认定为一种特殊的脆弱生境,严重影响植物的发育[4]。根据张清海等[5]的研究,在喀斯特地区石漠化程度最高的区域土壤w(全N)仅为1.46 g·kg-1,w(全P)和w(速效P)分别为 0.16和5.4 mg·kg-1,显著低于非喀斯特区域。然而,对于该区域植物和生态系统中N、P化学计量特征的研究较少,N、P化学计量特征不太明确。自REINERS[6]提出生态化学计量学思想以来,陆地植物的N、P含量和N/P比特征及其在区域和全球尺度上的影响因素已经受到越来越广泛的关注[7-9]。叶片元素含量与土壤营养之间的理论关系也逐渐成为生态系统科学研究的一块基石[10-12]。N、P是生命活动所必需的化学元素,但是在绝大多数陆生环境中,这2种元素相对于生物生长发育的需要常常是缺乏的。土壤N、P供给情况能影响叶片含量;植物叶片的营养情况,尤其是N和P含量也可以反映土壤养分的供给情况[13-15]。岩生植物指生长在岩石表面的薄层土壤或完全裸露的岩石表面上的植物[16]。岩生植物对干旱具有良好的适应性,能通过各种方式应对干旱胁迫的影响。岩生植物可适应岩石边坡以及岩石创面等特殊生境,在水土保持和群落演替方面起着非常重要的作用,对于石漠化防治也起着重要的作用[17]。岩生植物群落往往成为岩石创面群落演替过程中早期形成的群落形态,所以开展岩生植物群落特征、适应性及其演替过程方面的研究,对阐明石漠化地区生态恢复机理和石漠化防治都具有重要的意义。
以贵州省关岭县和贞丰县交界处的花江峡谷岩生草本植物群落为研究对象,对不同海拔草本植物群落的水热环境因子、群落特征、植物叶片N、P含量和土壤N、P含量进行研究,目的在于:(1)揭示调查区域内岩生草本植物群落的类型及特征;(2)揭示调查区域内土壤与植物氮磷化学计量特征;(3)阐明调查区域内物种重要值与氮磷化学计量特征之间的联系。
1 研究方法
1.1 研究区概况
研究区位于贵州省关岭县和贞丰县交界处的北盘江段,为典型的喀斯特峰丛峡谷地貌,区内石灰岩占95%以上,石漠化面积占总面积的55%左右。土壤母质为石灰岩风化物,土壤类型为石灰土。海拔440~1 420 m,坡度25°以上的土地面积超过总面积的85%[18]。地表支裂破碎,土面、石面、石槽、石沟、石缝、石洞等地表结构的生态小气候有较明显区别,形成不同的小生境[19]。气候类型主要为典型的中亚热带干热河谷气候,年均气温18.4 ℃,年总积温达6 542.9 ℃,全年无霜期在337 d以上,河谷肩部和河谷底部温差较大,河谷底部终年无霜;年均降雨量1 100 mm,降雨主要集中在5—10月,冬春旱及伏旱严重[20]。
1.2 岩生草本植物群落调查
选择在试验地植被生长最为繁茂的季节,于2017年8月在研究区内按海拔梯度和代表性植被从花江河谷底部到河谷肩部共设置4个样地,分别为样地1、样地2、样地3和样地4。每个样地取随机正方形样方5个(1 m×1 m),样方间距在10 m左右,进行植物群落及水热环境因子调查,记录样方内岩生草本植物的物种数、个体数、生物量、高度和盖度等生长特征,使用方格网法计算盖度,使用温湿度计测量空气温度湿度,使用曲管地温表测量土温。因土层极薄,地温表尽量深埋。计算岩生草本植物的物种组成比例、频度、多样性指数等群落特征。
1.3 生物量与含水量的测定
生物量采用收(获)割法测定。植物样本采集后,立即分为地上部分与地下部分并称重,放入自封袋中保存。带回实验室后在烘箱内105 ℃杀青30 min后,65 ℃恒温连续烘干至恒重,称量干重。土壤含水量采用烘干法(失重法)测定。在各样方4角获取土样混合为1个样品,约1 kg。土样采集后立即称量湿重,在烘箱内105 ℃恒温连续烘干至恒重,称量干重。土壤含水量以重量含水量表示,其计算公式为
Øm=(W1-W2)/W2×100% 。
(1)
式(1)中, Øm为质量含水量,%;W1为湿土质量,g;W2为烘干土质量,g。
1.4 群落物种重要值测算
Pi为物种i在群落中的相对重要值,Pi= (相对盖度+相对高度+相对频度) /3。相对频度指含有物种i的样方数占样方总数的比例。
1.5 多样性测算
物种丰富度采用Margalef指数计算,α多样性采用Shannon-Wiener指数和Pielou均匀度指数来测度,选取β多样性指数中的Jaccard指数反映群落或样方间物种的相似性,Cody指数则反映样方物种组成沿环境梯度的替代速率。计算公式为
D1= (S-1) /lnN,
(2)
H=-∑ (Pi×lnPi),
(3)
E=H/lnS,
(4)
Cj=c/(a+b-c),
(5)
βc=(a+b-2c) /2。
(6)
式(2)~(6)中,D1为Margalef指数;H为Shannon-Wiener指数;E为Pielou指数;Cj为Jaccard指数;βc为Cody指数;S为群落中的物种数;N为样方中记录的个体总数;Pi为每个种在群落中的相对重要值。a、b为2个群落的物种数;c为2个群落共有的物种数。
1.6 氮磷含量的测定
烘干植物样粉碎过0.25 mm孔径筛,烘干土样研磨为粉末后过0.15 mm孔径筛,自封袋贮藏待用。全N含量测定:取植物样品0.5 g或土壤样品2 g,用浓硫酸消化后,用凯氏定氮法测定;全P含量测定:取植物样品0.25 g,用浓硝酸-双氧水消解后,用钒钼黄比色法测定,土壤样品0.5 g用浓硫酸-高氯酸消解后,采用钼锑抗比色法测定。
1.7 数据处理
采用Excel 2016软件对基础数据进行处理,并制作相关图表,所有样地调查结果均为5次重复数据的平均值,N、P含量测定做3个重复试验。并用SPSS 22分析软件对数据进行单因素Anova检验和Pearson相关分析。
2 结果与分析
2.1 各样地位置、水热特征及土壤N、P含量
花江峡谷为典型的中亚热带干热河谷,河谷肩部和河谷底部最大温差在10 ℃左右,河谷底部到河谷肩部较小的海拔跨度内分布着外貌特征具有明显差异的草本植物群落。如表1所示,各样地的空气温度、空气湿度、土壤温度和土壤含水量都随海拔高度的上升而下降。
表1花江峡谷不同样地的位置、水热特征及土壤氮磷含量
Table1Thelocation,hydro-thermalfeatureandsoilnitrogen,phosphoruscontentsofsampleplotsinHuajiangGorge
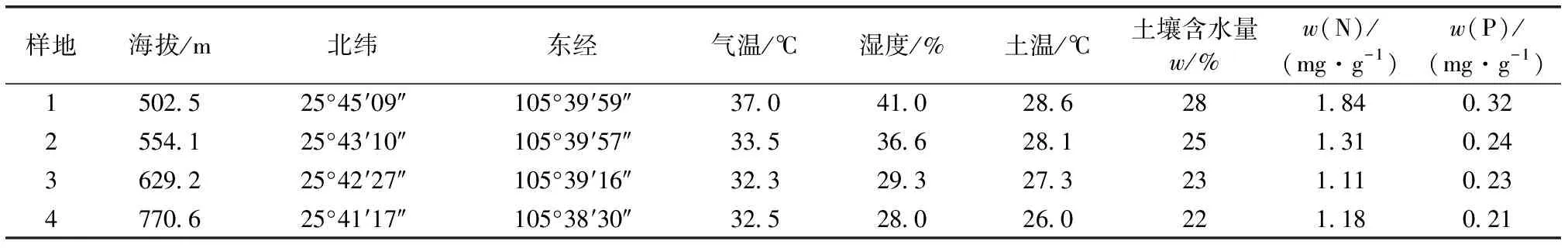
样地海拔/m北纬东经气温/℃湿度/%土温/℃土壤含水量w/%w(N)/(mg·g-1)w(P)/(mg·g-1)1502.525°45′09″105°39′59″37.041.028.6281.840.322554.125°43′10″105°39′57″33.536.628.1251.310.243629.225°42′27″105°39′16″32.329.327.3231.110.234770.625°41′17″105°38′30″32.528.026.0221.180.21
各样地土壤的N、P含量如表1所示,在所有样地中,样地1的N、P含量均高于其他3个样地,其中土壤w(N)为1.84 mg·g-1,土壤w(P)为0.32 mg·g-1,其余3块样地土壤P含量差异较小。各样地土壤的N含量高低顺序为样地1>样地2>样地4>样地3;而各样地土壤的P含量高低顺序为样地1>样地2>样地3>样地4。
2.2 各样地岩生草本植物群落的基本特征
由于海拔高度的不同造成环境因子的差异,从花江峡谷的底部到肩部不同海拔高度选择的4个样地内,其群落的类型及其基本特征有所区别,但也存在一定的联系。对4个样地共调查到的岩生草本植物物种数16种,主要为菊科和禾本科植物。样地1、2、3和4的物种数分别为11、5、3和3种,群落内物种的种属名称及其重要值详见表2。
在样地1中,荩草(Arthraxonhispidus)与显子草(Phaenonpermaglobosum)为优势种,构成了荩草+显子草草本植物群落;在样地2中,荩草为单一优势种,其余植物均为伴生种,群落类型为荩草草本植物群落;在样地3中,荩草和白茅草(Imperatacylindrica)为优势种,华东早熟禾(Poafaberi)为伴生种,群落类型为荩草+白茅草草本植物群落;在样地4中,白茅和小颖羊茅草(Festucaparvigluma)为优势种,伴生种为荩草,群落类型为白茅+小颖羊茅草本植物群落。
如表3所示,花江峡谷不同海拔样地的岩生草本植物群落的物种多样性特征有所不同。根据Margalef 指数,样地1的物种丰富度明显高于其他样地,其余样地物种丰富度的排序为样地2>样地3>样地4。Shannon 指数显示,样地1的物种多样性最大,样地2的物种多样性最低,样地4多样性大于样地3。Pielou 指数显示,样地2的均匀度明显低于其他样地,其余样地的均匀度较为接近,从高到低依次为样地4>样地1>样地3。
表2花江峡谷不同样地岩生草本植物群落的物种组成和重要值
Table2ThespeciescompositionandimportantvalueofrockherbcommunitiesinHuajiangGorge
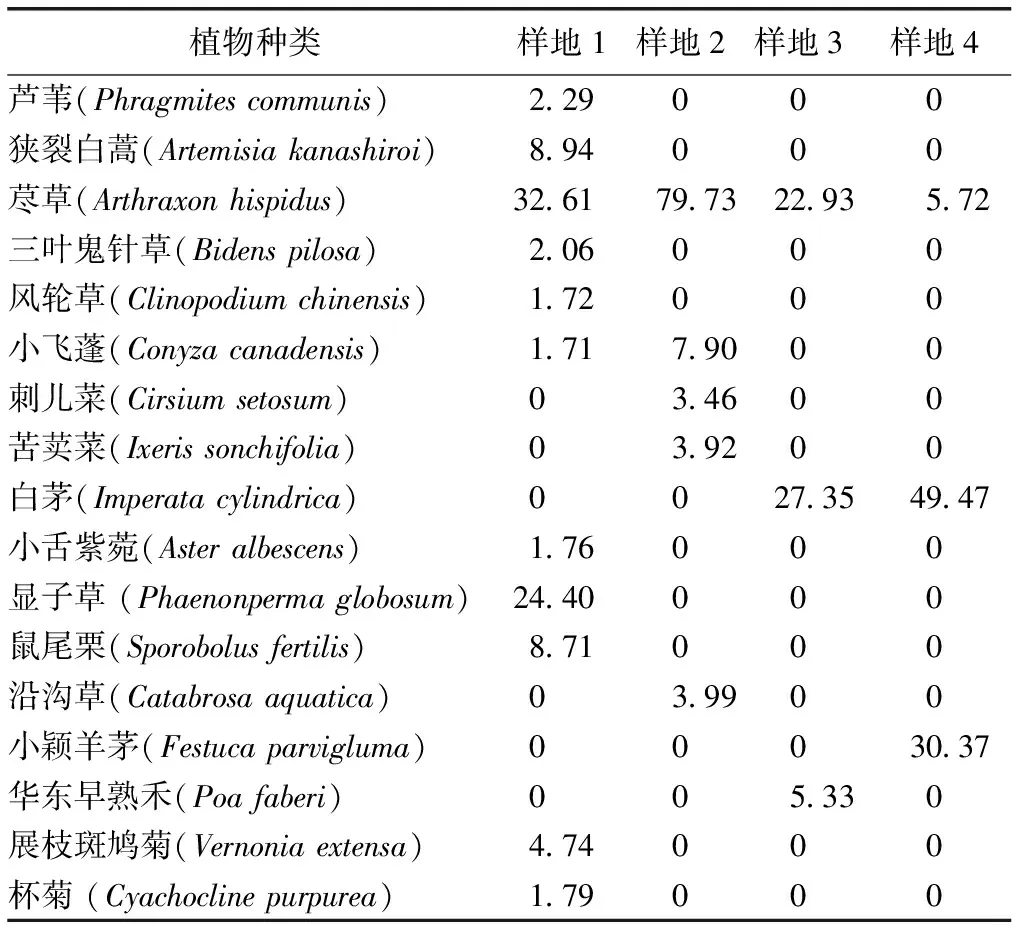
植物种类样地1样地2样地3样地4芦苇(Phragmites communis) 2.29000狭裂白蒿(Artemisia kanashiroi)8.94000荩草(Arthraxon hispidus) 32.6179.7322.935.72三叶鬼针草(Bidens pilosa)2.06000风轮草(Clinopodium chinensis)1.72000小飞蓬(Conyza canadensis)1.717.9000刺儿菜(Cirsium setosum) 03.4600苦荬菜(Ixeris sonchifolia)03.9200白茅(Imperata cylindrica) 0027.3549.47小舌紫菀(Aster albescens) 1.76000显子草 (Phaenonperma globosum)24.40000鼠尾栗(Sporobolus fertilis)8.71000沿沟草(Catabrosa aquatica)03.9900小颖羊茅(Festuca parvigluma)00030.37华东早熟禾(Poa faberi) 005.330展枝斑鸠菊(Vernonia extensa) 4.74000杯菊 (Cyachocline purpurea)1.79000
如表4所示,Jaccard 指数显示,样地1和样地2、样地3和样地4之间的物种相似度均小于0.25,为极不相似。样地3和样地4的物种相似度较高。从Cody 指数来看,花江峡谷地区岩生草本植物群落沿海拔替代较为明显,样地1与其他样地之间的替代速率最高且相同,从样地3到样地4的替代速率最低,样地2与样地3、样地4之间的替代速率也一致。
表3花江峡谷不同样地岩生草本植物群落物种的α多样性
Table3αdiversityofrockherbcommunitiesinHuajiangGorge
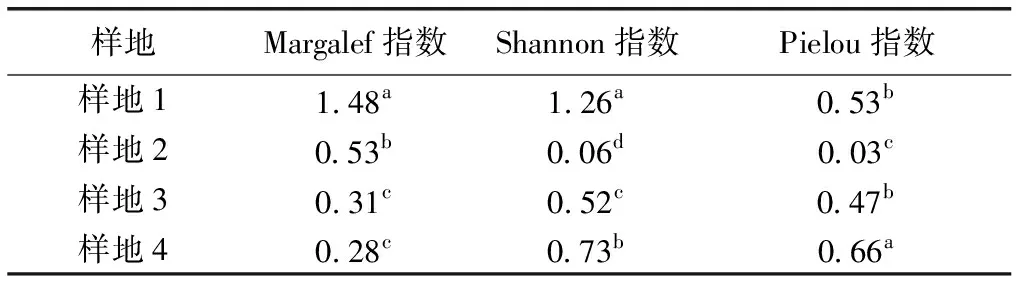
样地Margalef指数Shannon指数Pielou指数样地11.48a1.26a0.53b样地20.53b0.06d0.03c样地30.31c0.52c0.47b样地40.28c0.73b0.66a
同一列数据后英文小写字母不同表示不同样地间物种α多样性指数差异显著(P<0.05)。
表4花江峡谷不同样地岩生草本植物群落物种的β多样性
Table4βdiversityofrockherbcommunitiesinHuajiangGorge
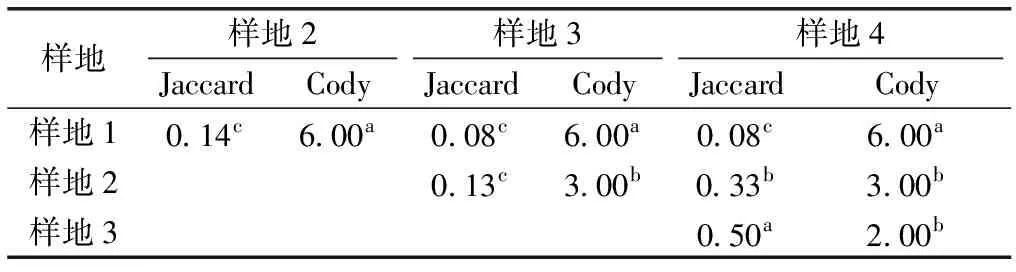
样地样地2样地3样地4JaccardCodyJaccardCodyJaccardCody样地10.14c6.00a0.08c6.00a0.08c6.00a样地20.13c3.00b0.33b3.00b样地30.50a2.00b
数据后英文小写字母不同表示不同样地间物种β多样性指数差异显著(P<0.05)。
如图1所示,花江河谷地区的植物群落的各样地生物量干重的排序为样地2>样地4>样地3>样地1,但样地2与样地4生物量没有显著差异。样地2地上部分的干重最大,样地4地下部分的干重最大,样地1地上部分和地下部分的干重均最小。经计算,各样地的根冠比排序为样地4>样地1>样地3>样地2。
2.3 各样地岩生草本植物叶片氮磷化学计量特征
对花江峡谷地区4个样地采集到的16种草本植物叶片的N、P含量进行测定,结果如表5所示。植物叶片样品中w(N)的变化范围为3.267~7.665 mg·g-1,叶片N含量最低的植物为样地4中的荩草,含量最高的为样地3中的白茅。植物叶片样品中w(P)变化范围为0.746~1.481 mg·g-1,叶片P含量最少的植物为样地4中的白茅,含量最高的为样地2中的苦荬菜。植物叶片样品N/P比值(摩尔比,下同)的变化范围为6.81~17.66,N/P比值最小的为样地1中的小舌紫菀,最大的为样地2中的荩草。在样地1的11种植物中,N/P比值<14的共有9种,N/P比值>16的有1种,N/P比值在14~16范围内的由1种;在样地2的5种植物中,N/P比值<14的共有4种,N/P比值>16的有1种;在样地3和样地4中,均有1种植物的叶片N/P比值<14,1种植物叶片的N/P比值>16,1种植物的N/P比值在14~16范围内。
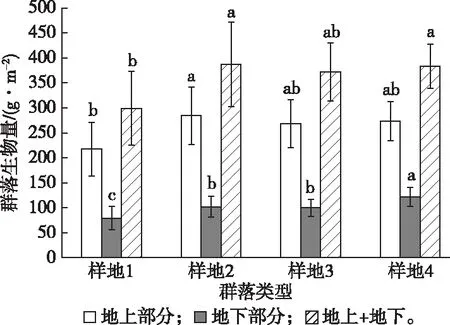
不同样地同一部位直方柱上方英文小写字母不同表示各样地间生物量差异显著(P<0.05)。
2.4 各样地岩生草本植物叶片氮磷化学计量特征与群落物种重要值之间的关系
如图2所示,根据Pearson相关系数的分析结果,花江峡谷草本植物的物种重要值与植物叶片N/P比之间为正相关关系,两者之间有极强的相关性;物种重要值与叶片P含量之间也表现为中等程度的负相关;而植物物种重要值与叶片N含量之间虽然也表现出一定的正相关,但相关程度较弱。
3 讨论
植物群落的具体特征是对该区域生态环境的综合反映,其构成既反映植物对环境资源的利用与适应关系,也反映物种特性及更新、竞争等种内种间关系[21]。在花江峡谷地区,降水主要分布在5—10月,占全年总降水量的83%[22],也是该区域水热条件最适合植物生长的时期。因此7—9月是花江植被最为繁茂的时期,也是群落内物种间对环境资源竞争最为激烈的时期,在此时段内研究喀斯特植物群落内的种间竞争和群落演替具有较强的代表性。学者们[23-26]也常常选择在此时段对其他喀斯特区域内的群落结构或营养特征进行研究。
表5花江峡谷不同样地岩生草本植物叶片的氮、磷化学计量特征
Table5PlantleavesNandPstoichiometryofsampleplotsinHuajiangGorge
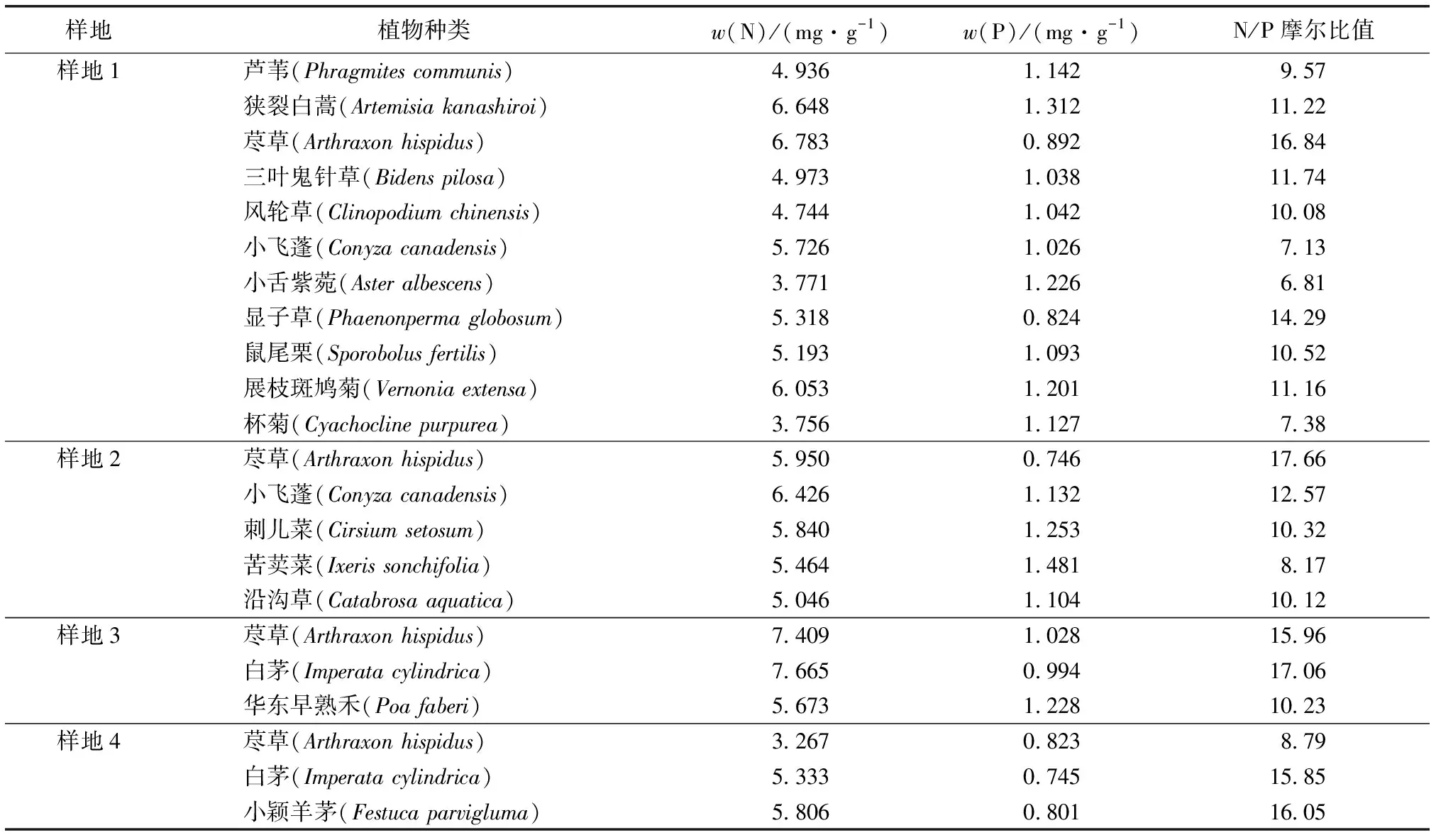
样地植物种类w(N)/(mg·g-1)w(P)/(mg·g-1)N/P摩尔比值样地1芦苇(Phragmites communis)4.9361.1429.57狭裂白蒿(Artemisia kanashiroi)6.648 1.31211.22荩草(Arthraxon hispidus)6.783 0.89216.84三叶鬼针草(Bidens pilosa)4.973 1.03811.74风轮草(Clinopodium chinensis)4.744 1.04210.08小飞蓬(Conyza canadensis)5.726 1.0267.13小舌紫菀(Aster albescens)3.771 1.2266.81显子草(Phaenonperma globosum)5.318 0.82414.29鼠尾栗(Sporobolus fertilis)5.193 1.09310.52展枝斑鸠菊(Vernonia extensa)6.053 1.20111.16杯菊(Cyachocline purpurea)3.756 1.1277.38样地2荩草(Arthraxon hispidus)5.950 0.74617.66小飞蓬(Conyza canadensis)6.426 1.13212.57刺儿菜(Cirsium setosum)5.840 1.25310.32苦荬菜(Ixeris sonchifolia)5.464 1.4818.17沿沟草(Catabrosa aquatica)5.046 1.10410.12样地3荩草(Arthraxon hispidus)7.409 1.02815.96白茅(Imperata cylindrica)7.665 0.99417.06华东早熟禾(Poa faberi)5.673 1.22810.23样地4荩草(Arthraxon hispidus)3.267 0.8238.79白茅(Imperata cylindrica)5.333 0.74515.85小颖羊茅(Festuca parvigluma)5.806 0.80116.05
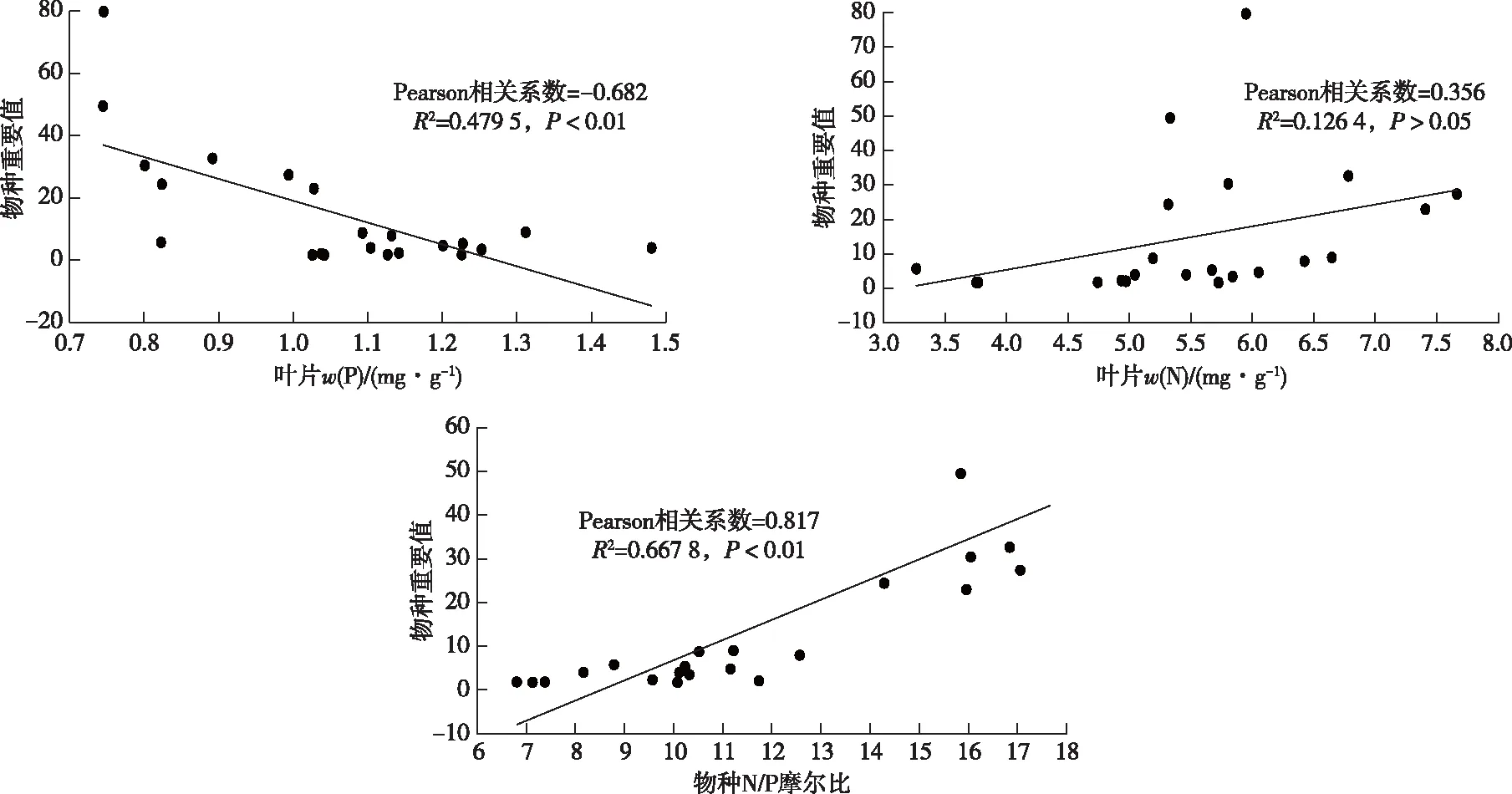
图2 花江峡谷植物物种重要值与N/P摩尔比的关系
3.1 群落类型与特征
海拔是影响植物分布生长的重要因子,环境因子随着海拔的升高发生变化,对植物的限制作用导致群落的物种组成和结构发生变化,从而造成植物群落组成和特征的差异形成[27-28]。在花江河谷地区调查的4个样地,虽然海拔差不超过300 m,但由于花江峡谷地面支离破碎,且气候类型主要为亚热带季风湿润气候,属于干热河谷,河谷底部与河谷肩部气温湿度差异较大,调查的4个样地的气温、空气湿度、土温和土壤含水量等水热环境因子有较为明显的区别。4个样地的植物群落也已经演替为不同的类型。群落的物种多样性常常与海拔高度表现为负相关[29]或“单驼峰型”[30]2种模式,花江河谷地区草地植物群落的物种多样性的变化属于前一种形式。从河谷底部到河谷肩部,空气湿度和土壤含水量都明显下降,水分胁迫应该是造成植物群落物种多样性随海拔下降的最重要因素。位于河谷底部的样地1的气温明显高于其他3个样地,温度在该样地作为扰动因子的作用,叠加上土壤N、P含量较高的效果使该样地的物种多样性升高。所调查的4个样地的物种相似度与海拔高度表现为正相关,而替代速率与海拨高度表现为负相关,表明在在河谷内随着海拔高度的增加植被变化的剧烈程度下降,这应该与该地区亚热带河谷气候效应[31]对较高海拔植被的影响逐渐减弱有一定关系。
3.2 群落生物量
花江河谷不同岩生草本植物群落的生物量随海拔变化表现为“单驼峰型”的曲线变化的趋势。在所有样地中样地2的岩生草本植物群落生物量最大,这与在调查的所有样地中该样地的温度和湿度相对适合植物生长密切相关。合适的温度对生物体内代谢反应的进行非常重要,高于或低于生物生长的最适温度,都会对植物的生长产生抑制作用。样地1气温过高,无疑会抑制植物的生长。也有研究表明,随着群落生物量的增加,物种之间对于资源的竞争也随之增加,并因此会导致群落物种多样性下降[32]。样地1多样性最高而生物量较低的情况印证了这种论断。此外,大量研究表明草地生物量与水分呈显著正相关关系,而水分胁迫会在一定程度上促进植物根系生长[33]。在样地4中草地群落地下部分生物量以及根冠比都在所有样地中最大,这与该样地面临程度最高的干旱胁迫有关。同时,在调查中样地2所处的海拔区域也是当地居民主要的农作物种植区域,表明在该海拔区域种植作物能收获最大的生物量。土壤N、P含量与草本植物群落生物量并没有表现出直接的关系,土壤N、P含量最高的样地1并没有获得最大生物量。这表明在花江峡谷地区,土壤N、P含量不是限制草本植物群落生物量的最重要因素。
3.3 氮磷计量特征
REICH等[9]的研究结果显示,全球陆地植物叶片的平均w(N)和w(P)分别约为18.3和1.42 mg·g-1;而HAN等[34]的研究得到中国植物叶片的平均w(N)和w(P)分别约为18.6和1.21 mg·g-1。该研究调查植物的叶片w(N)平均值为 5.27 mg·g-1,叶片w(P)平均值1.06 mg·g-1。在调查样地中,没有发现固N能力强的豆科植物,岩生草本植物群落的生产力也远低于其他植物群落,这些都使研究区植物叶片的N含量远低于世界和中国陆地植物叶片的平均值。根据KOERSELMAN等[35]以及GUSEWELL[12]的研究结果,对于陆生植物来说,如果植物地上部分的N/P比值<14,植物的生长受缺N的限制;如果N/P比值>16,植物的生长受缺P的限制,当植物地上部分的N/P比值介于14~16之间时,植物的生长既受N限制也受P限制。在样地1中物种较多,但82%物种的N/P比值<14,且占据相似的生态位,预示该群落有进一步演化的趋势。而在样地3和样地4中,植物种类严重下降且植物叶片N/P比值<14、>16和介于14~16之间的各占1/3,表明这2个样地中植物生长受营养元素限制的情况不同,在同一群落中占据不同的生态位而得以共存,群落发展到较为稳定的阶段。此外,在花江峡谷各样地中,大多数物种的生长受到缺N的限制。
植物叶片的营养情况,尤其是N和P含量可以反映土壤养分的供给情况;反之,土壤N、P供给情况影响叶片N、P含量。N和P不仅对植物的个体发育和生理功能上起重要作用,还直接影响植物群落组成、结构和生态系统功能和生产力[36-37]。根据全国第二次土壤普查养分的分级标准[38],所调查的4个样地的全P含量均划分为第5级;而样地1全N含量属于第2级,其余3个样地的全N含量为第3级。样地1的N、P含量明显高于其他3个样地,这可能是因为花江水流带来的N、P营养。而随着海拔高度的上升,土壤N、P含量逐渐降低,说明土壤退化程度随海拔上升而加剧。这应该与喀斯特地区土壤N、P元素淋失较强有关。在土壤N、P含量与植物叶片N、P含量的关系上,有2种截然不同的学说。KOERSELMAN等[35]提出植物体中的N/P比值反映了环境中可获取的N和P的相对含量;而TILMAN[39]的资源比例模型假说认为植物体内的N/P比值反映了植物的相对营养需求。该假说认为植物是按照生长所需比例对营养进行吸收的,与养分的供应比例并没有关系。在该研究中大多数植物叶片的N/P比值<14,这与土壤N/P比值的状况相似,表明环境N/P比值对植物叶片N/P比值有重要的影响。但同时在同一样地不同植物叶片的N/P比值有所不同,且与植物的物种重要值强烈相关。这表明植物叶片的N/P比值还与该植物对N、P的生理需要和在该环境中对N、P的获取能力密切相关,具有种属特异性,而这往往会决定该植物在此群落中所占的地位。HE等[40]的研究也表明,在区域尺度上,植物叶面N、P计量学特征的主要是由土壤的N、P含量和群落中物种组成共同决定的。KOERSELMAN假说和TILMAN假说还需要大量的研究,以判断其是否成立或确定其适用范围。
