垂向湍流扩散和光耦合对下沉藻增长的影响——基于内陆混浊湖泊(太湖)分析
2019-02-27赵巧华
周 妍,赵巧华,刘 鹏
垂向湍流扩散和光耦合对下沉藻增长的影响——基于内陆混浊湖泊(太湖)分析
周 妍,赵巧华*,刘 鹏
(南京信息工程大学水文与水资源工程学院,江苏 南京 210044)
在假设温度恒定、弱化营养盐限制作用的条件下,利用太湖背景漫射衰减系数、日变化太阳辐射等数据,通过下沉藻生长与水环境相结合的耦合模型,模拟下沉藻增长过程中垂向湍流扩散和光之间的耦合.结果表明:在相对清洁水体中(背景漫射衰减系数小于1.1/m),下沉藻类无需垂向湍流扩散均可维持增长;混浊水体中(背景漫射衰减系数介于1.1~3.0/m)下沉藻类增长需垂向湍流扩散维持,且最低垂向湍流扩散值随背景漫射衰减系数增大而增大,二者间存在指数函数关系;最低垂向湍流扩散()、水深()与藻类下沉速度()间的佩克莱数应位于0.38~13.89,否则垂向湍流扩散对比其他因素(藻类沉降和光衰减),对水柱中下沉藻类的增长的作用甚小;当背景漫射衰减系数大于3.0/m,水柱平均光能可能难以满足藻类增长,藻类持续消亡.该研究有助于厘清气候变化背景下水生生态系统中的浮游植物种群演替机制.
下沉藻;垂向湍流扩散;背景漫射衰减系数;数值模拟
近几十年来,由于内陆淡水生态系统水华事件频发,使水体环境恶化极大威胁到了淡水系统的水质安全[1].理清藻类水华的发生机制可以为水生生态系统的修复和治理提供相应的理论支持.湖泊中藻类的生长状态是多要素综合反映,主要包括物理、化学和生物因素.其中营养盐是藻类生长的物质基础[2-4];湍流扰动是影响藻类垂向分布的关键物理量,而光是架构物理过程和生物过程的桥梁.近年来,水体的湍流扰动对浮游植物生长的影响逐步得到重视:秦伯强等[5]经过长期的观测得出适当扰动有利于太湖蓝藻水华的形成.Zhou等[6]也证实适当湍流扰动可促进微囊藻生长;Huisman等[7]结合了光照和水动力两个条件,提出湍流扩散和光照对藻类的共同影响机制,从理论上分析藻类生长中扰动的贡献;Cao等[8]以水体流速出发确定微囊藻所需的极限流速;张卓等[9]提出两个主要参数判断光限制弱水体中藻类生长情况.
自然水体中,不同藻类运动特征差异明显:静水中,藻类的密度大于水体密度,藻类呈现下沉运动,反之则为上升运动.这种在静水中多表现为沉降运动的藻类称为下沉型藻类(以下简称下沉藻).微囊藻可通过伪空胞增大浮力,形成上浮运动[5],尤其在光限制强水体中多上浮[10].吴生才[11]对太湖底部栅列藻(绿藻)和微囊藻(蓝藻)的沉降分析中指出太湖栅列藻的沉降普遍强于微囊藻.湍流对藻类垂向分布的影响是湍流与藻类垂向运动耦合的结果[7].光能作为藻类生长的能量来源之一,在垂直水层上逐渐递减,因而下沉藻须受到湍流的裹挟作用[12-13],得以在水柱中重新分布,使其获得更多光能以维持其正向增长[14].太湖中藻类种群以绿藻居多,硅藻和蓝藻紧随其次[15];夏季太湖多蓝藻[16],风浪扰动较强的6月湖心和河道口绿藻占比会有所增高[17].郭文景等[18]通过自回归分析了营养盐,温度和叶绿素等水质参数间的定量关系;赵巧华等[19]证实春季太湖水温较低,藻类生长对营养盐的需求较低,藻类生长主要受温度和光照影响.太湖富营养化的程度比较高,当营养盐的物质条件比较充足,更加凸显了光照、扰动和温度对藻类生长的影响.可见温度恒定时,光能作为藻类生长的重要能量来源,与影响浮游植物垂向分布的湍流间的耦合成为影响下沉藻类生长的关键物理过程.
太湖系典型的大型浅水浑浊湖泊,风浪作用显著.以往的研究多集中在恒定光源下通过定性、统计等方法初步探究湍流、光的耦合对藻类的生长影响,在维持下沉藻正向增长过程中,湍流、光能衰减系数之间有着明显的耦合关系,但其鲜有受到关注.因此,本文基于实测日变化光照强度(非恒量的光源供给),假设温度恒定(藻类最适生长温度),弱化营养盐对藻类生长的限制,拟揭示在大型浅水湖泊中(太湖为例)维持下沉藻临界(藻类不生长不消亡)状况下,垂向湍流扩散和背景漫射衰减之间的耦合关系.
1 数据与方法
1.1 藻类的生长扩散方程
本文意理清垂向湍流扩散和背景漫射衰减衰减对下沉藻类生长影响,故忽略营养盐对藻类生长的限制,设定温度恒定,仅考虑藻类生长与光照、藻类自身运动和水体运动有关.根据藻类生长的因素提出藻类生长对流扩散方程[7]:
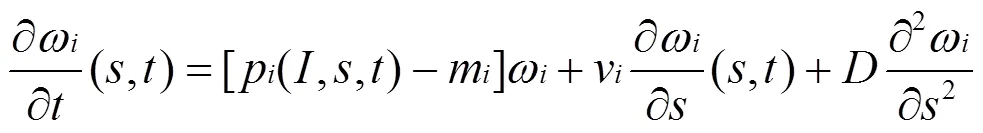
式中:右边第一项为藻类的生长.为物种类型;为深度,m;为时间,h;为某种浮游植物的数密度, cells/m3;藻类的生产率和消耗率的差值分别为净生产率(,,)=p(,,)-m;因对忽略营养盐限制和温度恒定的假设,生产率为光、水深和时间决定的函数,由莫诺特模型(2)给定:

式中:消耗率m是关于温度的函数[20],由于温度恒定故为常数.式(1)右边第二项为物种在静水中的移动.v为藻类的静水速度(m/h,正为上浮,负为下沉).式(1)右第三项为垂向扰动引起的扩散.为垂向湍流扩散系数(m2/h,以下简称垂向扩散系数).max为藻类种的最大生长速率;H为藻类的半饱和常数;为光量子通量密度(二者单位均为μmol/(m2·s).光量子随深度的变化为式(3)所示
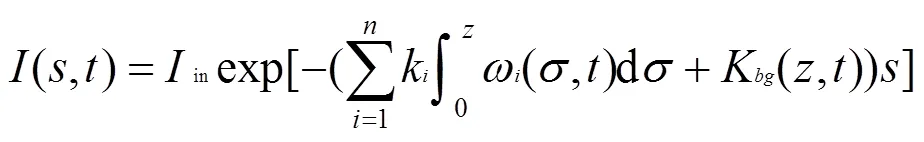
式中:in为进入水体的光合有效辐射光量子通量密度;k为浮游植物引起的光衰减,m2/cells;K(/m)为悬浮物等产生的背景漫射衰减系数(以下简称光衰减系数).为实验水深,m;各参数和出处见表1.

表1 模型参数设置
注:初始数值.
绿藻适宜生长温度范围介于20~25℃[23],而表1中各藻类参数的水体温度为18~22℃[21],基本符合该结论范围.设定水深2.8m,分辨率为2.8cm.模拟时长为15d,采取迎风差分的方式,方法见文献[24].经空间差分处理后得刚性微分方程.用全隐式一阶刚性方程的Gear算法[25]对该微分方程求解.拟定积分步长3.0×10-6h(约等于0.01s).式(1)的边界条件中,对流扩散项在=0和=时为0.
1.2 水体内藻类总生物量和总生物量随时间变化
水柱中藻类总生物量的大小可用(4)描述:
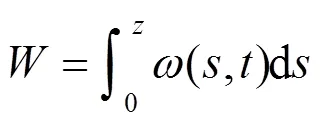
水柱中藻类总生物量的时间变化如下:
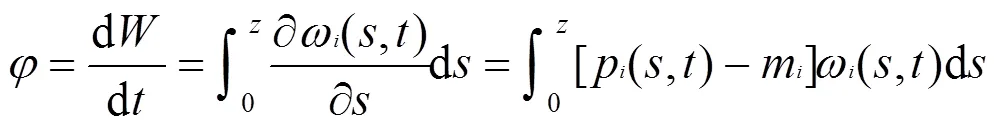
本文以上述两变量来表征水柱中藻类生长的情况.d/d>0且≠0,水柱中藻类存在正向增长;相反水柱中藻类持续消耗;=0,水柱中无藻不发生增长.
1.3 光量子通量密度和水下光衰减系数
入射光上、下行辐照度(u和d)数据采集于2017年11月1日7:30~16:30,中国科学院太湖湖泊生态系统观测研究站,采集频率为每30min一次.辐射数据采集使用德国TRIOS公司生产的RAMSES水下光谱仪.波长为的1mol单色辐射的光量子所具有能量为[26]:
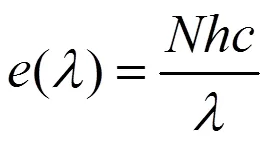
为阿伏加德罗常数,为光速,为普朗克常数.波长为的单位能量所具有的光量子数:
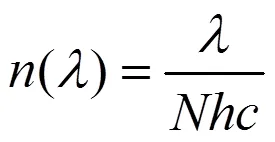
取有效辐射波段(400~700nm)的上、下行辐照度和,可得到光合有效辐射光量子通量密度,
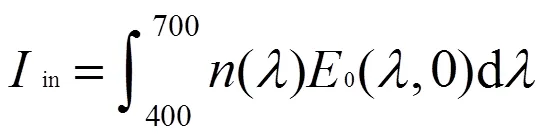
依时间变化进行插值和拟合,得随时间变化的入射光有效辐射光量子通量密度.
据水下辐照水深度廓线计算有效波段内0~150cm(N=16)水体的衰减系数表达式(9),以确定实验设定水下光衰减系数范围
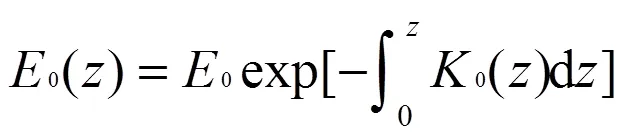
对实测数据指数回归(Origin86回归),当回归2³0.95,深度数N(=16)³3接受值,否则视为无效数据.
1.4 光量子通量密度日变化函数
根据计算得到光量子通量密度随时间的变化的插值结果如图1.从拟合结果看,拟合曲线基本符合一天内光量子通量密度日变化:日照开始于6~7点,符合实测期真实日出时间.正午入射光量子通量密度达到最大,约858.2μmol/(m2·s),17点光源为0.一天拟合结果光暗比近似为10:14,实验光合反应时间小于消耗时间.故设定实验开始时间为早8点,光量子通量密度约300μmol/(m2·s)开始模拟,光变化周期为24h,整个水体内光源供给条件式:
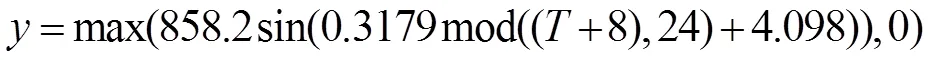
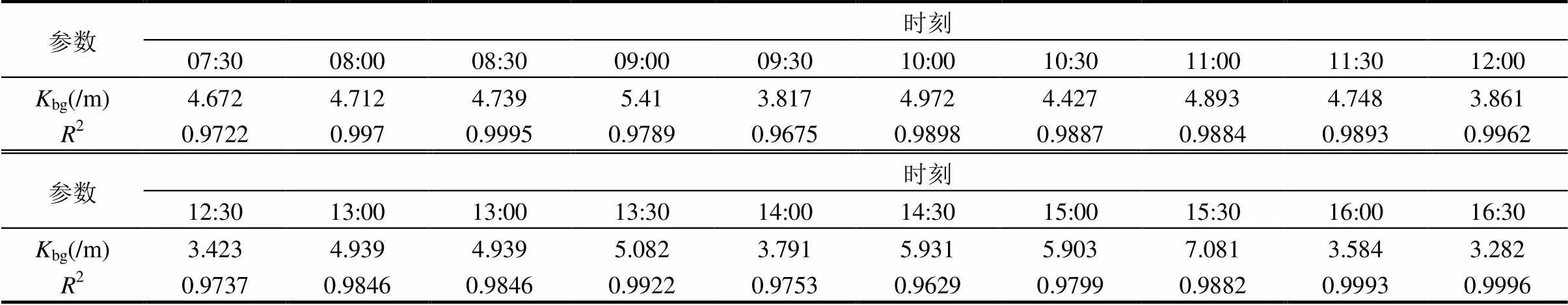
表2 光衰减系数随时间的变化
1.5 水下光衰减系数设定
全天内水下光衰减系数的实测拟合结果如表2.结合本次实测结果和文献数据[27-28],设定水下漫射衰减系数范围为0.5~7.5/m,间隔0.5/m.
2 结果与分析
2.1 光衰减和垂向扩散对不同深度藻类影响
2.1.1 藻类生物量变化过程中光衰减和垂向扩散的耦合作用 垂向扩散改变藻类在水柱中的分布,影响藻类可获取光能的大小,间接影响藻类的生长.图2为不同深度(15cm、120cm、270cm分别代表表层,中层和近底层)、不同时间(1、5、10、15d)藻类生物量数密度随光衰减系数和垂向扩散系数的分布.第1d,扩散系数大于0.01m2/h表层和中层生物量数密度较高;垂向扩散系数为0.001~0.01m2/h时近底层生物量数密度较高.不同水深中生物量数密度随光衰减系数增加而减小,生物量数密度在中层和近底层差异较显著.第5d,数密度高值区域与第1d类似,近表层数密度随光衰减系数变化差异显著.第10、15d,垂向扩散系数大于0.01m2/h光衰减系数小于3.0/m时,表层和中层藻类生物量数密度较高且随光衰减系数变化分布差异明显;垂向扩散系数介于0.001~ 0.01m2/h、光衰减系数小于1.5/m时,近底层藻类生物量数密度较高且分布差异明显.

图2 不同深度藻类生物量数密度随垂向扩散扰动和光衰减系数的分布(列为15、120、270cm水深;行为1、5、10、15d)
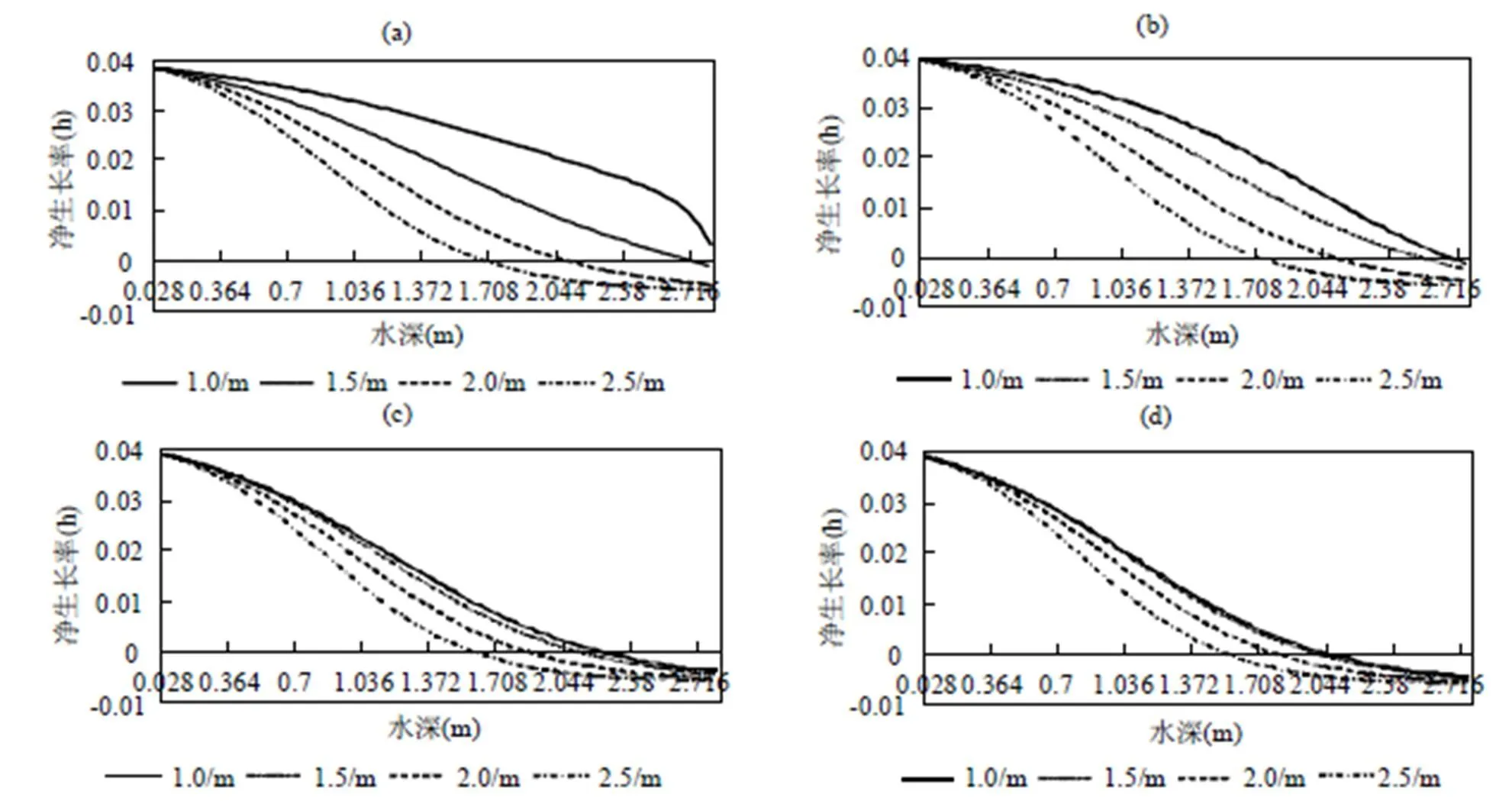
图3 藻类净生长率随水深变化
(a)=0.005m2/h; (b)=0.05m2/h; (c)=5.0m2/h; (d)=100.0m2/h=15d
垂向扩散的存在阻碍了藻类沉降.当垂向扩散系数越大,表层和中层存留的藻类生物量数密度越多;相反垂向扩散系数越小,近底层存留的藻类生物量数密度越多.然而不论何种深度,光衰减系数越大,藻类在同一深度可获得的光能越小.清澈环境中藻类生数密度远高于浑浊环境.
2.1.2 藻类净生产率变化过程中光衰减和垂向扩散的耦合 水柱内藻类生长除了与不同深度藻类数密度分布有关,还取决于藻类的生长率大小.图3给出了不同垂向扩散条件下,第15d藻类净生长率随水深的变化.光衰减系数低值区域,水柱中任意位置藻类保持正向增长(图3a).光衰减系数越大,光能对藻类净生长率限制越明显,藻类净生长率随深度递减率增加.垂向扩散系数越强,不同光衰减系数中藻类垂向生长率曲线变化幅度较小.光衰减系数通过削弱水柱中的光能大小限制藻类生长,而垂向扩散通过裹挟作用改变藻类在水柱中的分布而弱化光衰减对藻类生长的限制程度.垂向扩散和光衰减共同影响了藻类水下净生长率的分布情况.
2.2 水柱中藻类总生物量变化过程中垂向扩散和光衰减的耦合分析
为观察整个水柱内藻类总生物量的变化,本文根据水柱内藻类总生物量()和其时间变率()分析藻类生长过程中垂向扩散和光衰减的耦合效应.图4表示水柱内藻类总生物量时间变率其临界值(d/ d=0)随垂向扩散、光衰减系数的变化.藻类总生物量临界曲线在第3d后达到稳定,4~15d临界曲线基本一致.光衰减系数低于1.1/m的水柱内,藻类生长可不依赖垂向扩散;当光衰减系数逐渐增大,藻类生长受光限制的作用逐渐凸显,需要更大的垂向扩散裹夹,维持水柱内动态生长的平衡,而所需垂向扩散大小随光衰减系数增加而增加;当光衰减系数范围达到某一临界值,不论水柱内垂向扩散如何增大,水柱内藻类总生物量持续消耗.图5给出了水柱中藻类总生物量随光衰减和垂向扩散的分布.与图4总生物量生长临界曲线一致,藻类总生物量随着时间增加逐渐往低光衰减和高垂向扩散区移动.当垂向扩散达到0.1~ 1.0m2/h时,水柱中藻类总生物量较稳定.
结合图4和图5,水柱内藻类正向生长情况可分两种:1、光衰减系数小于1.1/m,无论垂向扩散大小,整个水柱内藻类总生物量均可正向增加,小扩散下总生物量不如大扩散;2、光衰减系数介于1.1~3.0/m,水柱内藻类总生物量正向增长须依赖一定强弱的垂向扩散.藻类总生物量生长所需垂向扩散(临界值)随光衰减系数增大而增大(图4),变化趋势为突增,缓慢增加,突增三阶段.对下沉藻,当水体较清澈、垂向扩散较弱,藻类多沉底但水柱内任意位置净生长率恒为正,水柱内藻类总生物量维持正向增长;水体较清澈但垂向扩散较强,虽然藻类在下底层净生长率为负,但更多的藻类生物量数密度维持在中上层使得整个水柱内藻类生物量也可维持正向增长.当水柱逐渐浑浊,低扩散下整个水柱无法保持净生长率恒为正,积累在下底层藻类逐渐消耗,致使整个水柱内藻类消亡,故此时需要适当的垂向扩散使水柱内更多的藻类停留在真光层获取光能从而维系水柱中的藻类生长.

图4 水柱中下沉藻类总生物量随时间的变化曲线(左边dW/dt³0区域,右边相反)
2.3 垂向扩散和光衰减在维持藻类生物量生长中的耦合
图4光衰减系数介于1.1~3.0/m,整个水柱内藻类总生物量正向增长所需最低垂向扩散随光衰减系数增大而增大,而光衰减系数大于3.0/m,无论垂向扩散强度如何,水柱内藻类总生物量总在消耗.所以水柱内藻类正向增长垂向扩散和光衰减二者共同影响出现在光衰减系数介于1.1~3.0/m间.藻类总生物量生长所需垂向扩散(临界值)随光衰减系数变化的趋势非稳定缓慢的增长,而存在突增变化.本文用佩克莱数Pe[29](Pe»1,沉降作用强):
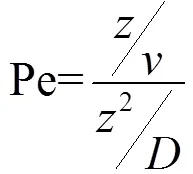
藻类自身移动时间尺度(/)和扩散影响时间尺度(2/)之比来判定水柱中沉降和扩散对藻类迁移影响的强弱.图4中扩散扰动小于0.01m2/h(Pe= 13.89>>1)时,出现第一次突增.Huisman的模拟[21]Pe³13.9(图4虚线)指出过强的沉降(对流)对藻类迁移的影响远大于垂向扩散,导致后者对藻类裹挟能力弱难以抵消藻类自身沉降的光能获取劣势,故而出现垂向扩散急增变化.Pe<1(图4实线以上)垂向扩散开始占主导,但浅水湖泊深度有限,垂向扩散增强藻类混合越趋于均匀,当垂向扩散达到Pe£0.38[21](图4点划线),藻类垂向分布均匀且垂向净生长率变化不显著,藻类生长情况稳定,图5中垂向扩散大于0.4m2/h藻类生物量差异变化不大.伴随光衰减系数增大,所需最低垂向扩散使得水柱内藻类分布越均匀,光的过强衰减对藻类生长影响更大,最低垂向扩散出现第二次突增变化直至与光衰减系数垂直.
Huisman在不考虑光衰减系数大小下给出最低扰动的数值解[24],该数值解与藻类沉降速度与入射光强度有关.本文在其基础上引入光衰减系数,选取最低垂向扩散随光衰减系数缓慢增加的范围(0.38£Pe£13.89)探讨下沉藻临界态下最低垂向扩散随光衰减系数的变化关系(式12):
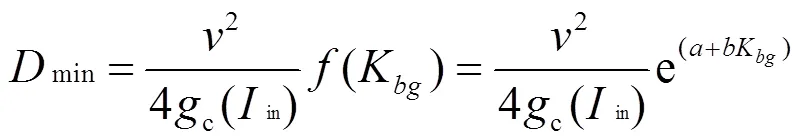

图5 水柱内藻类总生物量随光衰减和扩散扰动分布
色谱柱最低值未标注,因低值并不为零
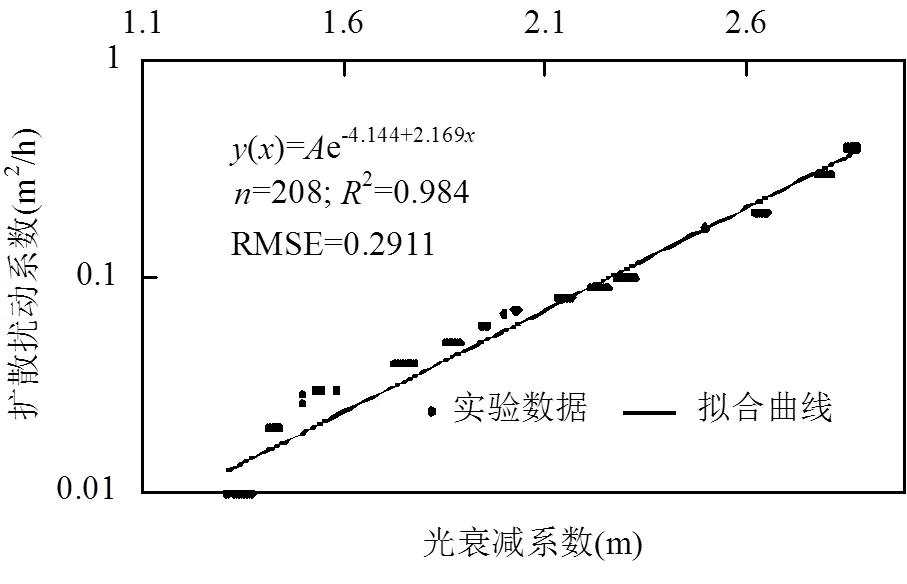
图6 最低垂向扩散系数随光衰减系数的拟合(其中 A=v2/4g(Iin))
式(12)中:为藻类的沉降速率,g(in)为平均入射光源下藻类净生产率.因生物量时间变化率一般在3d后差异较小(图4),取3~15d生长临界曲线数据做最低垂向扩散和光衰减系数间的拟合(Spss 21.0),结果如图6.当藻类沉降速度越小,停留在真光层时间越久,此时藻类所需的最低垂向扩散越小;相反,当光衰减系数不变,入射光源越强,水柱内同一位置藻类可获取光能越多,藻类生长对扩散扰动的依赖而降低,所需最低扩散扰动也有所降低.因光衰减系数的存在,水下光场呈指数递减,当水下光衰减剧烈,若仅靠藻类自身的迁移,水柱内多数下沉藻类集中于水柱底部(图2),在底部藻类因获取的光能有限,呈现消耗状态(图3).越来越多的藻类沉底消耗,整个水柱的藻类种群将持续消耗直至消亡.可见,在光限制水体中,水体的垂向扩散是下沉藻维持正向增长的必要条件, 垂向扩散的存在促使多数沉降藻类维持在真光层区域,以减少因自身沉降的而带来的种群消耗.而随光衰减系数的增大,藻类种群所需借助的外力作用将越来越强.
3 讨论
光能的获取是影响藻类生长的重要因素之一.而其他因素诸如温度[30-31]、营养盐[32]和水动力[33-34]也会影响藻类的生长.其中水动力主要是通过调整藻类在水体中的位置[7]和营养物质的释放[35]影响藻类的生长.
假设水体温度恒定不变、弱化营养盐对藻类的限制,清澈水柱中光衰减缓慢水柱中平均光能可以满足具有下沉特性的藻类正向增长;当水柱光衰减剧烈,下沉藻类需要一定外力作用维持藻类位于真光层区域.式(3)中,越接近底层光能越小,根据式(2),藻类净生长率较低,在光衰减过强时呈消耗状态(图3),这并不利于藻类种群的生长.当水柱内垂向扩散较大,表层和中层的藻类生物量数密度远高于垂向扩散较状态下生物量数密度(图2),下沉藻类依赖垂向扩散使更多藻类移动至真光层,水柱内藻类避免持续消耗,维持了种群的增长(图4和图5).大多数值模拟[9,36-37]也指出一些以沉降为主的藻类种需要一定大小的垂向扩散才能维持藻类的持续生长.
垂向扩散是否影响藻类的生长主要取决于藻类对水下光能的获取.本文中背景光衰减系数较小时藻类永远保持正向增长,与垂向扩散强弱无关;背景光衰减系数增大,藻类依赖垂向扩散才能维持正向的增长.但当背景光衰减系数超过一定限度,垂向扩散并不能抵消光限制对藻类增长影响(图4),所以水柱内藻类总生物量生长是否依赖于垂向扩散与背景光衰减系数有关.以往的研究多集中一定大小的垂向扩散和光衰减是否会引起藻类生长的定性研究,缺乏二者之间的定量分析.Huisman等[24]虽给出沉降藻类所需最低垂向扩散的数值表达式,但该表达式并未考虑背景光衰减系数的影响,图4和图6体现当光衰减系数增加,藻类所需最低垂向扩散会增大,所以最低垂向扩散应是藻类速率、入射光强度和背景光衰减系数共同决定.
但垂向扩散是没有方向性的, 垂向扩散过强,延缓下沉藻沉降同时也会带动一定数量的藻类进入水柱无光区,这样反而不利于整个水柱内藻类生长[7].Huisman等[21]和Portalier等[37]均证实下沉藻类的正向生长须存在一个上限和一个下限扩散值.但本文仅存一个下限扩散值,与二者结论略不同.在二者研究中藻类移动速率较小,水深设定较大,藻类沉降能力并不凸显;鉴于本文研究对象区域是大型浅水湖泊,水深较浅,从而凸现了藻类沉降效应.Huisman等[24]也验证当藻类移动速率相对于水深较快,上限扩散值减小下限扩散值增加,导致两个扩散限度相融合,最后仅存在一条临界曲线(图4).所以浅水区域,沉降能力强的藻类仅存在一个下限扩散值,即可确保整个水柱内藻类种群的正向增长.
4 结论
4.1 在水深2.8m,日变化供给光源光暗比为10:14条件下,水中背景光衰减系数小于1.1/m,水中光限制作用较小,下沉藻类从表层至底层可保持非消耗状态,水柱内藻类不需要垂向扩散可保持种群的正向增长;水中背景光衰减系数介于1.1~3.0/m时,水柱内藻类种群的正向增长须借助一定大小的垂向扩散维持,且垂向扩散强弱与光衰减大小有关;水中背景光衰减系数大于3.0/m,水中光限制过强,即便存在高强度的垂向扩散,水柱内下沉藻类种群依旧无法维持正向增长,生物量逐渐消亡.
4.2 在不考虑营养盐限制和假设温度恒定条件下,下沉藻类生长主要受生长、对流和扩散三方面影响.所需最低垂向扩散强度应与藻类沉降速率,入射光源大小和水下光衰减三方面因素有关.
即最低垂向扩散应与藻类沉降速率正向相关,藻类沉降越慢,留在真光层的时间越久,不需强扩散即可正向增长;当入射光小,水下藻类获取光能有限,需要强扩散使藻类移动至光能较大区域使藻类得以正向增长;同理水下背景漫射光衰减系数与扩散正向相关.但该拟合结果须满足0.38£Pe=/£13.89(代表水深),否则垂向扩散对藻类增长的影响较小.前者因浅水湖泊中,过高的扩散使水柱内藻类分布均匀,决定水柱内藻类增长的主要因素为光的衰减;后者则因藻类自身沉降过强,过低的扩散无法抵消藻类自身的沉降消耗所致.
[1] 秦伯强,王小冬,汤祥明,等.太湖富营养化与蓝藻水华引起的饮用水危机——原因与对策 [J]. 地球科学进展, 2007,22(9):896-906. Qin B, Wang X, Tang X, et al. Drinking water crisis caused by eutrophication and cyanobacterial bloom in Lake Taihu: cause and measurement [J]. Advances in Earth Science, 2007,22(9):896-906.
[2] Chen M, Fan M, Liu R, et al. The dynamics of temperature and light on the growth of phytoplankton [J]. Journal of Theoretical Biology, 2015,385:8-19.
[3] Zhang M, Duan H, Shi X, et al. Contributions of meteorology to the phenology of cyanobacterial blooms: implications for future climate change [J]. Water Research, 2012,46(2):442-452.
[4] Huisman J, Weissing F J. Light-Limited Growth and Competition for Light in Well-Mixed Aquatic Environments: An Elementary Model [J]. Ecology, 1994,75(2):507-520.
[5] 秦伯强,杨桂军,马健荣,等.太湖蓝藻水华“暴发”的动态特征及其机制 [J]. 科学通报, 2016,61(7):759-770. Qin B, Yang G, Ma J, et al. Dynamics of variability and mechanism of harmful cyanobacteria bloom in Lake Taihu, China [J]. Chinese Science Bulletin2016,61(7):759-770.
[6] Zhou J, Qin B, Han X, et al. Turbulence increases the risk of microcystin exposure in a eutrophic lake (Lake Taihu) during cyanobacterial bloom periods [J]. Harmful Algae, 2016,55:213-220.
[7] Huisman J, Van Oostveen P, Weissing F J. Critical depth and critical turbulence: Two different mechanisms for the development of phytoplankton blooms [J]. Limnology & Oceanography, 1999,44(7): 1781-1787.
[8] Cao H, Kong F, Luo L, et al. Effects of Wind and Wind-Induced Waves on Vertical Phytoplankton Distribution and Surface Blooms of Microcystis aeruginosa in Lake Taihu [J]. Journal of Freshwater Ecology, 2006,21(2):231-238.
[9] 张 卓,宋志尧,黄昌春,等.水藻暴发的影响因素定量化研究初步 [J]. 环境科学, 2013,34(7):2603-2610. Zhang Z, Song Z, Huang C, et al. Elementary Quantitative Study on Factors of Phytoplankton Bloom [J]. Environmental Science, 2013, 34(7):2603-2610.
[10] 俞 茜,陈永灿,刘昭伟.静止水体中微囊藻属迁移轨迹的数值模拟 [J]. 中国环境科学, 2017,37(5):1915-1921. Yu Q, Chen Y, Liu Z. Modelling vertical migration trajectory of Microcystis in calm water [J]. China Environmental Science, 2017, 37(5):1915-1921.
[11] 吴生才.太湖水华藻类越冬生态机制和浮游植物的研究 [D]. 南京:中国科学院南京地理与湖泊研究所, 2004. Wu S. Study on ecological mechanism of bloom alga overwintering and phytoplankton in Lake Taihu [D]. Nanjing: Nanjing Institute of Geography and Limnology, Chinese Academy of Sciences, 2004.
[12] Macias D, Santana A R, Romero E R, et al. Turbulence as a driver for vertical plankton distribution in the subsurface upper ocean [J]. Scientia Marina, 2013,77(4):541-549.
[13] 吴挺峰,朱广伟,秦伯强,等.前期风场控制的太湖北部湖湾水动力及对蓝藻水华影响 [J]. 湖泊科学, 2012,24(3):409-415. Wu T, Zhu G, Qin B, et al. Prior wind field induced hydrodynamics and its influence on cyanobacterial bloom in northern bays of Lake Taihu, China [J]. Journal of Lake Sciences, 2012,24(3):409-415.
[14] 俞 茜,陈永灿,刘昭伟,等.藻类光竞争模型构建及水体紊动对竞争的影响 [J]. 中国环境科学, 2018,38(7):2665-2670. Yu Q, Chen Y, Liu Z , et al. Development of competition model of algae for light and the impact of turbulence on algal competition [J]. China Environmental Science, 2018,38(7):2665-2670.
[15] 袁信芳,施华宏,王晓蓉.太湖着生藻类的时空分布特征 [J]. 农业环境科学学报, 2006,25(4):1035-1040. Yuan X, Shi H, Wang X. Temporaland spatial distributionsof periphytic algae in Taihu Lake [J]. Journal of Agro-Environment Science, 2006,25(4):1035-1040.
[16] 虞锐鹏,何恩奇,钮伟民,等.2010年度太湖水域藻密度和叶绿素时空分布特征的研究 [C]. 2011中国环境科学学会学术年会论文集(第一卷): 367-371. Yu R, He E, Niu W, et al. Study on the characteristics of algal density andspatial and temporal distribution in Lake Taihu in 2010 [C]. Proceedings of the 2011 annual conference of the Chinese Society of Environmental Sciences (Volume I):367-371.
[17] 邢 鹏,孔繁翔,曹焕生,等.太湖浮游细菌与春末浮游藻类群落结构演替的相关分析 [J]. 生态学报, 2007,27(5):1696-1702. Xing P, Kong F, Cao H, et al. Relationship between bacterioplankton and phytoplankton community dynamics during late spring and early summer in Lake Taihu [J]. Acta Ecologica Sinica, 2007,27(5):1696- 1702.
[18] 郭文景,符志友,汪 浩,等.水华过程水质参数与浮游植物定量关系的研究--以太湖梅梁湾为例 [J]. 中国环境科学, 2018,38(4): 1517-1525. Guo W, Fu Z, Wang H, et al. The quantitative relation of aquatic parameters and phytoplankton biomass in the process of algal blooms—the case of Meiliang Bay in Taihu Lake [J]. China Environmental Science, 2018,38(4):1517-1525.
[19] 赵巧华,孙国栋,王健健,等.水温、光能对春季太湖藻类生长的耦合影响 [J]. 湖泊科学, 2018,30(2):385-393. Zhao Q, Sun G, Wang J, et al. Coupling effect of water temperature and light energy on the algal growth in Lake Taihu [J]. Journal of Lake Sciences, 2018,30(2):385-393.
[20] 许秋瑾,秦伯强,陈伟民,等.太湖藻类生长模型研究 [J]. 湖泊科学, 2001,13(2):149-157. Xu Q, Qin B, Chen W, et al. Ecological simulation of algae growth in Taihu Lake [J]. Journal of Lake Science, 2001,13(2):149-157.
[21] Huisman J, Sharples J, Stroom J M, et al. Changes in turbulent mixing shift competition for light between phytoplankton species [J]. Ecology, 2004,85(11):2960-2970.
[22] 李春华,叶 春,张 咏,等.太湖湖滨带藻密度与水质、风作用的分布特征及相关关系 [J]. 环境科学研究, 2013,26(12):1290-1300. Li C, Ye C, Zhang Y, et al. Temporal and spatial distribution of algal density and its relationship with water quality and wind factor in the littoral zone of Lake Taihu [J]. Research of Environmental Sciences, 2013,26(12):1290-1300.
[23] Liu X, Lu X, Chen Y. The effects of temperature and nutrient ratios on Microcystis blooms in Lake Taihu, China: An 11-year investigation [J]. Harmful Algae, 2011,10(3):337-343.
[24] Huisman J, Arrayás M, Ebert U, et al. How do sinking phytoplankton species manage to persist? [J]. American Naturalist, 2002,159(3):245- 254.
[25] 徐士良. FORTRAN常用算法程序集 [M]. 清华大学出版社, 1992:321-331. Xu S. FORTRAN common algorithm assembly [M]. Tsinghua University Press, 1992:321-331.
[26] 周允华,项月琴.光合有效量子通量密度的气候学计算 [J]. 气象学报, 1996,4:447-455. Zhou Y, Xiang Y. Climatological estimaton of quantum flux densities [J]. Acta Meteorologica Sinica, 1996,4:447-455.
[27] 张运林,秦伯强,陈伟民,等.太湖梅梁湾沿岸带水体生物学与光学特性 [J]. 生态学报, 2005,25(3):454-460. Zhang Y, Qin B, Chen W, et al. Biological and optical properties of Meiliang Bay in Lake Taihu [J]. Acta Ecologica Sinica, 2005,25(3): 454-460.
[28] 张运林,秦伯强,陈伟民,等.不同风浪条件下太湖梅梁湾光合有效辐射的衰减 [J]. 应用生态学报, 2005,16(6):1133-1137. Zhang Y, Qin B, Chen W, et al. Attenuation of photosynthetically available radiation( PAR)in Meiliang Bay under different winds and waves [J]. Chinese Journal of Applied Ecology, 2005,16(6):1133- 1137.
[29] Visser P M, Ibelings B W, Bormans M, et al. Artificial mixing to control cyanobacterial blooms: a review [J]. Aquatic Ecology, 2016, 50(3):423-441.
[30] 吴 攀,邓建明,秦伯强,等.水温和营养盐增加对太湖冬、春季节藻类生长的影响 [J]. 环境科学研究, 2013,26(10):1064-1071. Wu P, Deng J, Qin B, et al. Effects of enhanced water temperature and nutrient concentration on algal growth in winter and spring season in Lake Taihu, China [J]. Research of Environmental Sciences, 2013, 26(10):1064-1071.
[31] 谭 啸,孔繁翔,于 洋,等.升温过程对藻类复苏和群落演替的影响 [J]. 中国环境科学, 2009,29(6):578-582. Tan X, Kong F, Yu Y, et al. Effects of enhanced temperature on algae recruitment and phytoplankton community succession [J]. China Environmental Science, 2009,29(6):578-582.
[32] 吴雅丽,许 海,杨桂军,等.太湖春季藻类生长的磷营养盐阈值研究 [J]. 中国环境科学, 2013,33(9):1622-1629. Wu Y, Xu H, Yang G, et al. Developing the critical phosphorus threshold for spring algal growth in Lake Taihu, China [J]. China Environmental Science, 2013,33(9):1622-1629.
[33] 陈伟民,陈宇炜,秦伯强,等.模拟水动力对湖泊生物群落演替的实验 [J]. 湖泊科学, 2000,12(4):343-352. Chen W, Chen Y, Qin B, et al. Experimental Study on the Biological Community Succession Caused by Water Flow [J]. Journal of Lake Science, 2000,12(4):343-352.
[34] Huisman J, Codd G A, Paerl H W,et al. Cyanobacterial blooms [J]. Nature Reviews Microbiology, 2018,16(8):471-483.
[35] 朱广伟,秦伯强,高 光.强弱风浪扰动下太湖的营养盐垂向分布特征 [J]. 水科学进展, 2004,15(6):775-780. Zhu G, Qin B, Gao G, et al. Vertical distribution of the concentrations of phosphorus and suspended solid in Taihu lake affected by wind-induced wave [J]. Advances in Water Science, 2004,15(6): 775-780.
[36] Bengfort M, Malchow H. Vertical mixing and hysteresis in the competition of buoyant and non-buoyant plankton prey species in a shallow lake [J]. Ecological Modelling, 2016,323:51-60.
[37] Portalier S M J, Cherif M, Zhang L,et al. Size-related effects of physical factors on phytoplankton communities [J]. Ecological Modelling, 2016,323:41-50.
致谢:本文的英文摘要润色工作由唐德才老师协助完成,在此表示感谢.
Effect of vertical turbulent diffusion and light coupling on the growth of sinking algae——Analysis based on inland turbid lakes (Lake Taihu).
ZHOU Yan, ZHAO Qiaohua*, LIU Peng
(School of Hydrology and Water Resources, Nanjing University of Information Science and Technology, Nanjing 210044, China)., 2019,39(2):792~801
Based on the assumption of constant temperature and no nutrient salt limitation, a mathematical model coupling sinking algae growth and water environment of Lake Taihu was used to investigate the effect between the vertical turbulent diffusion and background diffused attenuation coefficient(K) on the growth of sinking algae. The simulation results showed that the total biomass growth of the sinking algae could be sustained without vertical turbulent diffusion in the relatively clean water (Kwas less than 1.1/m); in turbid water (Kwas between 1.1~3.0/m), the growth required vertical turbulent diffusion to maintain, and the minimum vertical turbulence diffusion increased with theK. The Peclet number between the minimum vertical turbulence diffusion(), water depth() and the algae sinking speed() should between 0.38~13.89, otherwise the minimum vertical turbulence would have little effect on the growth than other factors (for example, algae sinking speed or light attenuation). When theKwas greater than 3.0/m, the light intensity of the water column was too low to maintain the total biomass growth of algae. This paper helped to clarify the phytoplankton population succession mechanism in aquatic ecosystems under climate change.
sinking algae;vertical turbulence diffusion;background diffused attenuation coefficient;numerical simulation
X524
A
1000-6923(2019)02-0792-10
周 妍(1994-),女,安徽安庆人,南京信息工程大学硕士研究生,主要从事湖泊动力与藻类生长研究.
2018-07-04
国家自然科学项目(41371222)
* 责任作者, 教授, qhzhao@nuist.edu.cn
