外阻对三室MFC产电性能和Cu迁移特性的影响
2019-02-27朱丹丹张婧然李先宁
朱丹丹,张婧然,周 璇,王 辉,李先宁
外阻对三室MFC产电性能和Cu迁移特性的影响
朱丹丹,张婧然,周 璇,王 辉,李先宁*
(东南大学能源与环境学院,南京 江苏 210096)
构建一种新型的三室微生物燃料电池(microbial fuel cells, MFCs)对重金属Cu污染的土壤进行修复,研究不同外阻条件下MFC的产电性能和土壤中Cu的迁移去除情况.结果表明,当外接电阻从100Ω增大到1000Ω时,三室MFC的输出电压从0.1V提高到0.4V,最大功率密度从1.10W/m3降低到0.71W/m3,且阴极极化现象也随外阻增大而更加显著.装置运行63d后,MFC外接电阻越大,近阳极土壤区的Cu的去除率越高,外阻为1000Ω的MFC近阳极土壤区的 Cu去除率达到39.7%.通过改进欧共体标准(BCR)连续提取法分析重金属的形态,发现乙酸可提取态和可还原态为Cu迁移的两种主要形态.此外,土壤的性质也发生变化, pH值呈现由阳极到阴极逐渐升高的趋势,而电导率则相反.阴极电极的扫描电镜(SEM)和X射线衍射(XRD)结果也表明部分迁移到阴极的Cu(II)被还原成单质Cu.
微生物燃料电池(MFCs);外接电阻;土壤修复;Cu迁移
重金属是自然界广泛存在的微量元素,但是随着矿山开采、金属冶炼加工、农药化肥产业、造纸行业的迅猛发展以及电池、污泥等固体废弃物处置不当,导致土壤中重金属含量超过其背景值[1-2].与土壤中的有机污染物不同,重金属大多是不可生物降解的,因此在土壤中长期存在并对土壤中微生物的群落结构、植物生长产生重大影响,最终通过食物链危害人类健康[1-3].传统的处理方法存在工程量较大、实施成本较高、且易产生二次污染、土壤肥力损失等问题[4-6].因此,近年来研究者致力于寻求高效经济、无二次污染、原位修复的创新型技术.
近十几年来,微生物燃料电池(microbial fuel cells, MFCs)作为一种新型的污染物处理技术得到迅速发展,其利用微生物作为催化剂氧化有机和无机物质并且产生电能,具有无需能量输入、能量转化效率高、成本低、条件温和、环境友好、可持续性等优点[7-9]. 土壤中含有丰富的有机质和大量的微生物,将电极埋于土壤中,微生物可以利用有机质产生电子、质子和二氧化碳[10-11].产生的电子被阳极接受、收集并通过外电路经负载到达阴极;产生的质子可以释放到土壤中并迁移到阴极;空气中的O2作为阴极的电子受体接受电子并与阳极扩散过来的质子相结合生成水.除了O2之外,氧化还原电位较高的金属离子也可作为阴极的电子受体被还原,从而转化成低价态的低毒物质,甚至彻底被去除.例如, Habibul等[12]利用植物MFC处理含Cr(VI)废水,阳极以植物根系分泌物为碳源,阴极将剧毒的Cr(VI)还原成无毒的Cr(III),并以Cr(OH)3的形式沉淀或吸附在阴极电极板上,郝小旋等[13]以污泥为阳极底物,利用MFC的阴极还原能力处理含Cr废水,Cr(VI)去除速率达0.0514h-1,而Huang等[14]则采用生物阴极MFC处理低浓度Cr(VI)废水,利用阴极的Cr(VI)还原菌将Cr(VI)还原成Cr(III),还原速率达到2.4mg/(g VSS·h);Qiu等[15]利用MFC处理200mg/L的V(V)废水,7d后,中度毒性的V(V)几乎全部在阴极被还原成毒性更低的V(IV);Heijne等[16]和Wang等[17]发现废水中的Cu(II)可在MFC阴极的还原作用下被还原成单质Cu从而被回收去除,且Cu(II)的还原程度和MFC产生的电流以及阴极液pH值相关.除阳极产生的质子之外,有研究表明,其他阳离子也可以在MFC的低电场作用下向阴极区域迁移并在阴极室富集[18].已有的研究结果表明金属离子可以在MFC低电场下实现迁移,并在阴极中还原.但是目前关于MFC处理重金属的研究基本局限在水处理领域,在土壤修复领域的研究十分有限[19].
因此,本研究在土壤中构造一种新型三室微生物燃料电池, 以MFC自身产生的电能驱动Cu在土壤中的迁移,同时利用MFC阴极的还原能力实现迁移的Cu在阴极的进一步还原回收,具有无能耗、无二次污染等优点.此外,本文研究外接电阻对三室MFC产电性能的影响和外接电阻对土壤中Cu迁移、形态转化以及土壤性质的影响,为进一步提高MFC对土壤重金属的去除及还原提供有力的技术支持.
1 材料与方法
1.1 土壤样品的采集和制备
称取一定量的CuSO4·5H2O(称取量根据总土量计算得出),溶于超纯水后混入土壤中,并搅拌均匀,自然风干后即制备成污染土壤样品.土壤中总Cu的理论浓度为500mg/kg.土壤存于密封箱中备用.未污染土壤和制备污染土壤的Cu的形态分析如表2所示.
实验用土采自中国南京扬子江附近的农业林地,采集时取0~20cm表层的土壤,并剔除植物残体、石子等杂物,风干后过孔径为2mm筛子,室温下保存.实验用土的基本理化性质见表1.

表1 土壤的基本理化性质

表2 未污染土壤和制备污染土壤的Cu形态分析
注:浓度单位为mg/kg.
1.2 MFC的构建与运行
用于修复重金属污染土壤的新型微生物燃料电池是一个三室MFC,由阳极室、土壤修复室和阴极室构成,具体构造如图1所示. 整个装置材料采用的是有机玻璃,阳极室和阴极室是长宽高均为60mm的立方体构型,中间土壤修复室是长宽高分别为100mm、60mm、60mm.阳极室和土壤修复室由质子交换膜(PEM)分隔开,阴极室和土壤修复室用阳离子交换膜(CEM)隔开;阳极采用60(长)× 60(宽)×5(厚)mm的碳毡作为电极,阴极采用60(长)×60(宽)× 1(厚)mm的不锈钢片作为电极,然后用钛丝分别从阳极、阴极导出,连接一定阻值的电阻构成回路.

图1 MFC构造示意
每个装置的阳极室加入10mL的接种液(混合液悬浮固体浓度约为50g/L),用氮吹处理过后的营养液充满阳极室.每升营养液成分具体如下: CH3COONa(2g)、NH4Cl(0.31)、KCl(0.12g)、NaH2PO4(3.32g)、Na2HPO4(10.32g)、(NH4)2SO4(0.56g)和1mL微量元素溶液[20].土壤修复室填充了360g Cu污染土壤和300mL的纯水,在实验中,每2d从土壤修复室的顶部注入纯水,保持土壤始终处于水饱和状态.阴极室填充了210mL磷酸盐缓冲溶液 (pH值为3);静置3d后,待系统稳定,即可开始连接外接电阻开始实验.所有的实验都是在(30±1)℃下进行的.
1.3 实验设置
本文中设有两组实验,一组是实验组,设置不同外接电阻为100、510、1000Ω;另一组是开路对照组,两组实验的MFC的阴阳极间距均为10cm;从而研究重金属在MFC电极间距为10cm时,在不同外接电阻条件下的迁移与去除.装置运行过程中,阳极室每7d更换一次含有乙酸钠的营养液.对于阴极室,前12d每天定时测量阴极液的pH值,如果阴极液pH值超过3就用20%的盐酸将其调至(3±0.2),后期每7d调节溶液的pH值至(3±0.2).对于土壤修复室,每7d分段取一次土样,从阳极室至阴极室依次标记为S1-S4.
所有实验均设置两个平行组,实验结果取平均值.
1.4 分析方法
1.4.1 电化学特性的测定 每隔30min通过数据采集器(DAM-3057和DAM-3210,中国阿尔泰科技有限公司)采集一次MFC所产生的电压,并保存于电脑内.利用欧姆定律计算得到电流,电流密度=/An,功率密度=2/An,其中An为阳极室有效容积[21].本实验采用饱和甘汞电极为参比电极测量MFC的阴、阳极电势.
极化曲线采用稳态放电法测量,在MFC具有充足燃料,并且产电性能最佳时,使MFC在断路情况下稳定12h.实验过程中,不断改变负载电阻值,从10000Ω逐渐降到50Ω,在每个阻值下稳定约1h后记录电池电压.利用公式计算电流、电流密度和功率密度后,将电压和功率密度对电流密度分别作图,得到极化曲线和功率密度曲线.MFC的内阻根据极化曲线的斜率计算而得,因为当MFC以欧姆内阻为主时,极化曲线会近似于一条直线[22].
1.4.2 分析测定方法 测量土壤pH值和电导率时,将土样和无CO2水以1:2.5的比例混合,分别用pH计(Sartorius,PB-10,Germany)和电导率测定仪(Sanxin,MP513,Shanghai)进行测定.将土样冷冻干燥后,称取1g土样,通过改进BCR连续提取法[23-24]提取土样中不同形态Cu.具体步骤简述如下:(1)水溶态:去离子水(20mL,振荡16h) (2)酸可提取态: CH3COOH(40mL,0.11mol/L,振荡16h) (3)可还原态: NH2OH·HCl(40mL,0.5mol/L, pH值为2,振荡16h)(4)可氧化态: H2O2(10mL,8.8mol/L,1h, 85°C),H2O2(再加10mL,1h,85°C), NH4COOCH3(40mL,1mol/L,振荡16h) (5)残渣态(0.1g残余土,王水,微波消解).土样中总Cu的测量采用的是EPA方法3051A,将0.1g的土样与王水混合,然后用微波消解仪(MDS-6G, Sineo,China)进行消解.上述步骤的上清液过滤后再用原子吸收光谱仪(Perkin-Elmer AAS400)进行定量分析.文中用剩余总Cu浓度(C)与初始总Cu浓度(C0)的比值表示MFC修复后的Cu标准化浓度(C/C0).
实验结束时,利用扫描电镜(SEM)和X射线衍射(XRD)对阴极电极进行检测,分析阴极电极上所发生的电化学反应.
2 结果与讨论
2.1 不同外阻对MFC产电性能的影响
从图2(a)可以看出,MFC的输出电压在实验进行的前12d中,连接不同外阻(100、510、1000Ω)的实验组和断路对照组的电压逐渐上升并趋于平稳.外阻为100~1000Ω的实验组和断路对照组的电压分别稳定在0.1、0.3、0.4和0.8V左右.在第2和第7d对阳极进行了营养液的更换,实验组和对照组电压有明显的波动.由图2(b)可以发现,外阻越大,MFC的输出电压越高[25],但是存在着相同的产电规律,主要是因为各组MFC的运行条件和营养液更换周期等条件一致[26].每更换一次新的营养液,实验组和对照组的电压都会迅速升高,随着营养物质的耗竭,电压又会逐渐下降.
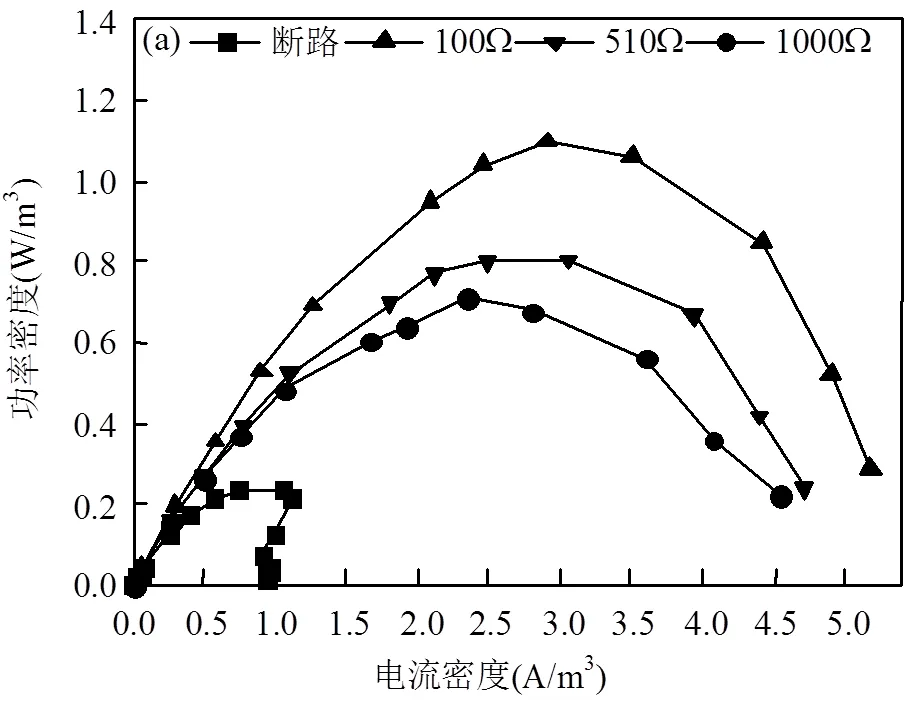
图3为不同外阻条件下的MFC的极化情况. 图3(a)表示的是不同外阻条件下MFC的功率密度曲线,可以发现随着外阻的增加,MFC的最大功率密度随之下降,外阻为100Ω时的最大功率密度为1.10W/ m3,外阻为1000Ω的最大功率密度为0.71W/m3.图3(b)是不同外阻条件下的极化曲线图,通过对极化曲线进行线性拟合,得到外阻为100、510和1000Ω的MFC的内阻分别为536Ω、522Ω、563Ω,内阻相差不大,这主要是由于不同外阻的MFC的构型、采用的阴阳极材料、阴阳极间距等条件均相同.图3(c)为不同外阻条件下MFC阴阳极的电极极化曲线变化图,可以发现当外阻条件变化时,阳极电势几乎不受影响,基本在-0.43~-0.5V之间波动,而阴极电势则变化十分显著,外阻越大,阴极极化现象越严重,即外阻为1000Ω的MFC阴极极化最严重,其次是510Ω、100Ω.这与最大功率密度的规律是一致的,100Ω的MFC最大功率密度最大,1000Ω的最大功率密度最小.由此可见,阴极极化是外阻对MFC产电性能产生影响的根本原因,即阴极性能是MFC产电的限制性因素.
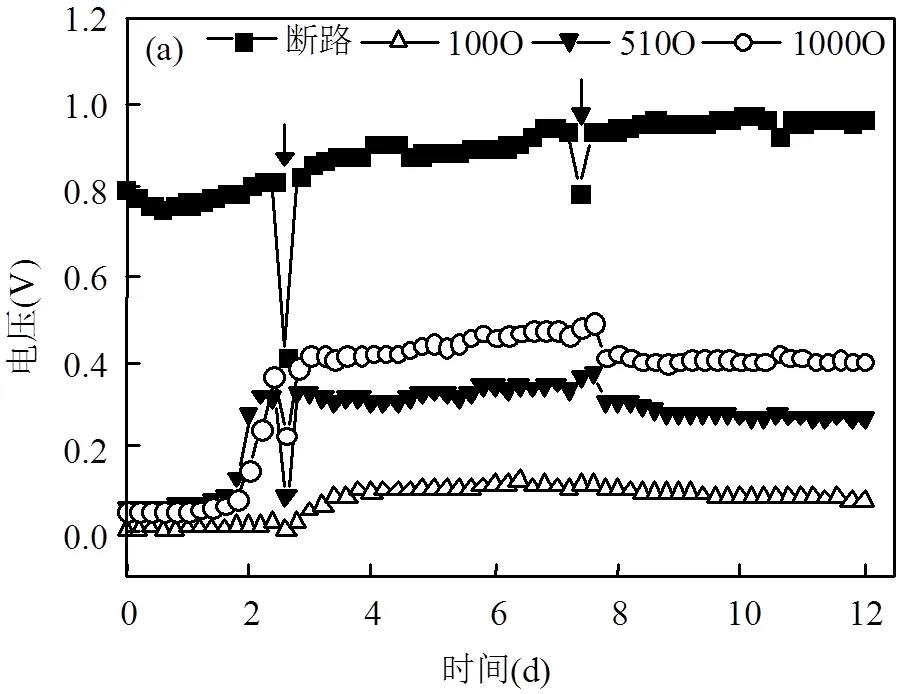
箭头表示更换营养液的时间点
2.2 不同外阻下各段土壤pH值和电导率变化
土壤室的土壤经MFC修复后从阳极到阴极的pH值和电导率变化趋势如图4所示.
根据断路对照组pH值(图4a)可知,实验结束后,土壤pH值大约为7.6且在整个中间土壤室分布均匀.经过63d的修复,不同外阻条件下的MFC土壤室的土壤pH值均呈现由阳极到阴极逐渐升高的趋势,靠近阳极区域的S1段pH<7,呈酸性,靠近阴极区域的S4段pH>8.5,呈碱性.出现这种现象的原因主要是阳极室氧化有机物的同时会产生H+,而阴极室的O2还原会消耗H+(O2+2H2O+4e−=4OH−).由于H+迁移速率的限制,最终导致土壤pH值从阳极到阴极逐渐升高[27].从图4(a)还可以发现MFC连接的外阻越小,从阳极到阴极pH值变化就越显著.当外阻为100Ω时,pH值从6.5(S1)增长到9.12(S4),显著增长了2.62个单位,原因可能有两点,一是外阻越小,MFC施加的电场力越小,从而导致H+迁移速率缓慢,二是外阻越小,阴极可利用的电子越多, H+在阴极的消耗速率越大,消耗H+的同时产生的大量OH−,此外OH−的迁移方向与电渗流方向(从阳极到阴极)相反[27-28],最终导致阴极区域附近OH−的累积.
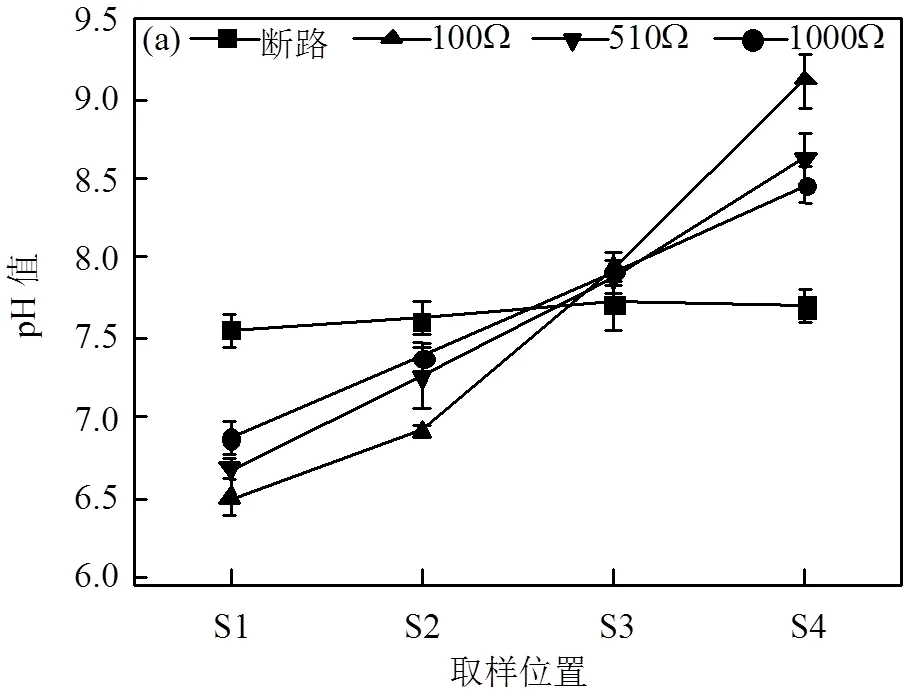
图4(b)展示了不同外阻条件下经过修复土壤室土壤电导率的变化情况.从靠近阳极区域的S1区到靠近阴极区域的S4区,土壤的电导率表现出一个明显的下降趋势.土壤电导率与土壤pH值是相关的,较低的pH值可以促进土壤中矿物以及金属的离子化,从而增加土壤的电导率[29].在阳极附近的S1区,100Ω、510Ω、1000Ω土壤的电导率较原土分别增长了23%、72%、84%,而S1区土壤pH值分别下降了14%、12%、9%,这说明电导率和pH值有一定的关联.除了100Ω的MFC,阴极附近的S4区的电导率较断路组均降低,原因可能是这一区域pH值均大于8.5,产生了大量的Cu(OH)2沉淀和Cu2CO3(OH)2沉淀[30-31],导致土壤的导电能力下降.
2.3 修复室土壤中Cu的迁移情况
本研究通过构建一种新型的三室MFC,验证三室MFC修复Cu污染土壤的可行性,进一步研究不同外阻条件对Cu迁移的影响.Habibul等[32]研究了双室MFC修复Cd和Pb污染土壤,发现土壤中Cd和Pb在MFC 产生的弱电场作用下向阴极区域迁移.实验表明,构建的三室MFC产生的低电场可以促进重金属在土壤中的迁移.实验结束后的总Cu在S1~S4的分布情况如图5所示. 结果显示,在不同外阻条件下,中间土壤中的Cu从阳极附近的S1区到阴极附近的S4区的总Cu浓度呈现逐渐增高的类似趋势,也就是说中间土壤中的Cu在MFC产生的低电场下发生了从阳极到阴极的迁移;但是不同外阻条件下,Cu的去除率是不同的.在断路对照组,总Cu在S1~S4区是分布均匀的,浓度为(500±4.0)mg/kg.而经过MFC修复后,靠近阳极的S1区,总Cu浓度分别下降为449mg/kg(100Ω)、408mg/kg(510Ω)、301.5mg/kg(1000Ω),这表明阳极附近土壤区中大约有10.2%(100Ω)、18.4%(510Ω)、39.7%(1000Ω)的总Cu被去除.不同外阻下,阴极附近的S4区的Cu富集量分别达到550mg/kg (100Ω)、 620mg/kg(510Ω)、775mg/kg(1000Ω).对比不同外阻下总Cu的迁移情况,可以发现外阻越大,靠近阳极的土壤区Cu的去除率越高,靠近阴极土壤区的Cu富集量越高.这是因为外阻越大,MFC产生的电压越大,随着电压增大,在相同的处理时间内,迁移完全,大部分迁移到阴极附近的土壤,从而阳极附近土壤的Cu去除效率较高[33].研究表明实验构造的三室MFC可以通过在阴极附近富集Cu,从而减少处理的污染土壤量,可以结合其他物理化学技术进一步处理阴极附近的土壤.
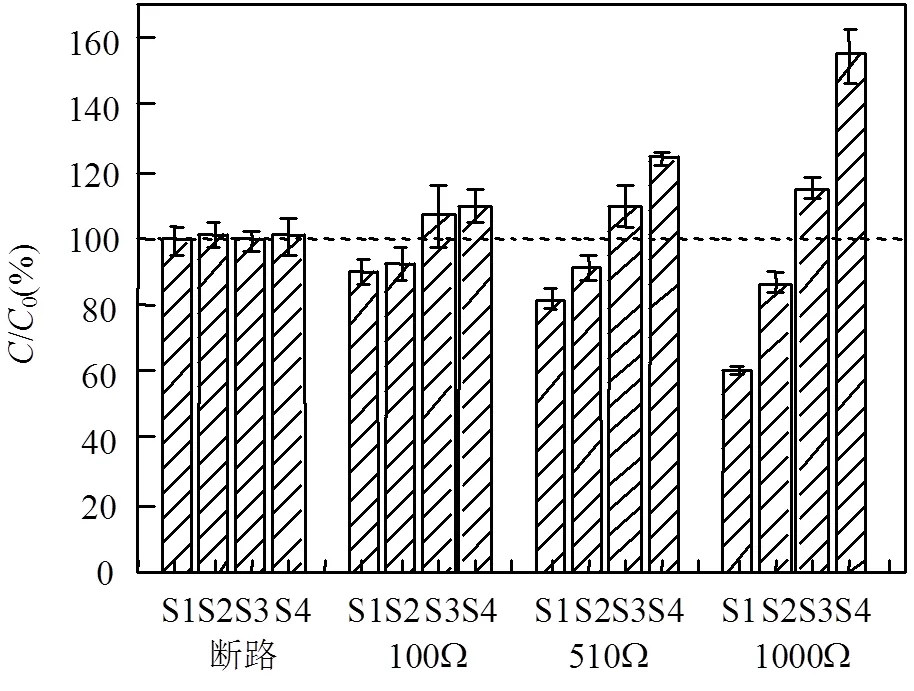
图5 不同外阻条件下总Cu的迁移情况
利用改进BCR连续提取法对MFC修复后的土壤进行提取,结果如图6所示.从图6中可以发现,土壤中水溶态含量极低,浓度接近于0mg/kg,而残渣态Cu的浓度修复前后无明显变化,土壤中的Cu主要以乙酸可提取态、可还原态和可氧化态三种形式存在.不论MFC连接外阻的大小,乙酸可提取态和还原态从S1~S4呈现逐渐升高的趋势,其中乙酸可提取态迁移程度最大.乙酸提取态Cu主要为与碳酸盐结合的Cu,生物可利用性最大,是5种形态中生态风险最高的一种形态[34],因此去除土壤中Cu的关键在于去除乙酸提取态Cu.当外阻为100Ω、510Ω、1000Ω时,S1区乙酸可提取态Cu的浓度分别为95.8mg/kg、89mg/kg、57.3mg/kg,即阳极附近土壤区的乙酸可提取态Cu的去除率分别达到31.5%、36.4%、59%.可还原态Cu的迁移较为缓慢,阳极附近S1区的去除率仅为13.2%(100Ω)、16.3%(510Ω)和46% (1000Ω).实验表明乙酸可提取态是三室土壤MFC中最易迁移的重金属形态,其次是可还原态.Chen等[35]研究Zn和Cd在MFC的迁移情况也有类似的结果.对比不同外阻条件下乙酸可提取态和还原态的变化,可以发现当外阻达到1000Ω时,阳极附近S1区乙酸可提取态和可还原态的去除率显著提高,分别是100Ω的1.9和3.5倍.说明,连接高阻值电阻有利于去除乙酸可提取态Cu,从而降低Cu在土壤中产生的危害.
在新型的三室MFC中, 土壤pH值对土壤室的重金属迁移和分布有着显著的影响.有研究表明, pH值是控制沉积物中重金属迁移行为的关键性因素,在pH值较低的条件下,H+与金属离子对配体(例如OH-,CO32-,SO42-,Cl-,S2-和磷酸盐)产生的竞争显着[36],即pH值越低,土壤释放出来的Cu越多.在装置运行过程中,阳极通过不断氧化乙酸钠产生H+,导致靠近阳极土壤吸附的Cu不断释放出来,带正电荷的Cu在电场力的作用下向阴极方向迁移,并最终在近阴极区域形成累积.从图5可以看出,靠近阴极的区域的总Cu浓度分别增加了10%(100Ω)、 24%(510Ω)和55%(1000Ω). 研究表明,靠近阳极区的低pH值为重金属的迁移提供了可能性.虽然在低电阻条件下,近阳极土壤pH值较低,Cu具有更好的迁移能力 ,但是100Ω下的Cu迁移量却较低,这表明Cu的迁移主要是受MFC产生的电场强度影响而与pH值的关系较小.结合图4和图6,可以发现pH值对重金属的形态分布也有重要的影响.随着阳极到阴极pH值逐渐升高,酸可提取态含量明显上升,可还原态含量上升,其他形态的含量略微波动.这一部分与Cu的迁移有关,一部分与pH值有关.酸可提取态Cu主要是吸附在碳酸盐表面或与碳酸盐形成共沉淀的Cu,而可还原态Cu是被铁锰吸附的Cu和一些弱酸条件下可溶的Cu的氢氧化物[37].pH值升高,H+浓度降低,竞争吸附、溶解解吸作用均减弱[38],即H+不会与Cu 竞争碳酸盐和铁锰氧化物,因此酸可提取态含量和可还原态均升高.

图6 不同外阻条件下5种形态Cu的迁移情况
2.4 阴极室Cu的还原情况
实验将MFC设置成三室的构型,目的是期望在实现土壤的迁移的同时,实现金属离子在阴极的还原.Wang等[39]采用玻璃圆筒构建单室土壤MFC实现了Cu在土壤中的迁移和Cu在阴极区域的富集,但是由于阴极区域的pH值大于9,Cu(II)在阴极不能被还原.有研究表明,如果要在阴极还原回收Cu,要保持阴极液pH值保持在3左右[40].装置运行过程中,调节阴极液pH值,保持其维持在3左右,从而提供一个Cu(II)还原的环境.装置运行63d后,发现外阻为1000Ω的阴极电极片上有少量红褐色颗粒物,而外阻为100Ω、510Ω的阴极电极片上则没有沉淀物质.对1000Ω和对照组的阴极电极进行SEM和XRD测试,SEM结果如图7所示,可以发现没有电流通过的断路对照组的阴极电极表面较为平整,且没有任何物质覆盖(图7a,7b).而实验组MFC(图7c,7d)的阴极电极表面有明显的不规则物质沉积,结合实验结束后阴极电极片呈现的红褐色,推测可能是Cu(II)在阴极被还原成了Cu单质.

图7 三室MFC阴极电极SEM图,(a) 断路, 50μm, (b)断路, 10μm, (c)1000 Ω, 50μm, (d)1000 Ω, 10μm
为了确定阴极电极片上沉积物质的化学形态,对实验组阴极电极片上的沉淀物质进一步进行XRD检测.在X 射线衍射仪上以0. 02°的步距从40°连续扫描至80°,得其XRD图谱如图8所示.
从图8中可以看出,1000Ω的实验组阴极板上的沉积物衍射谱线在2为43.3°、50.5°、74.2°处均出现尖锐衍射峰,经计算机检索与单质Cu的特征衍射峰一致,由此可以确定1000Ω的阴极电极板上的沉淀物质是单质Cu,即部分Cu从土壤迁移到了阴极室并实现了还原(Cu2++2e-→Cu).然而,100Ω、510Ω的实验组的阴极电极片表面没有物质沉淀,说明这两个电阻下没有实现Cu的还原,这主要是因为修复室土壤中的Cu没有进一步向阴极室的水溶液中迁移,阻止Cu进一步迁移的原因有两点,一是这两组实验的Cu迁移量较低说明MFC的电场驱动力较小,不利于Cu继续向水溶液中迁移;二是这两组靠近阴极区域的pH值分别为9.12和8.62,Cu2+与OH−结合,Cu大多以Cu(OH)2的沉淀形式存在,即高pH值的土壤对Cu的吸附能更强[41],最终导致Cu累积在阳离子交换膜的土壤一侧,不能进一步向阴极室的水溶液中迁移.

图8 1000Ω的阴极片沉积物质的XRD图谱
3 结论
3.1 在不同外阻条件下的三室MFC中,外接电阻增大,MFC的输出电压也随之增大.外阻对三室MFC产电的影响主要是通过阴极极化来体现的,而非MFC内阻,外阻越大,阴极极化现象越严重.
3.2 土壤的性质在MFC作用下也发生变化,不同外阻条件下,MFC土壤的pH值均呈现由阳极到阴极逐渐升高的趋势,而电导率则完全相反.
3.3 在不同外阻条件下,中间室土壤中的总Cu浓度呈现从阳极到阴极逐渐增高的类似趋势,也就是说土壤中的Cu在MFC产生的低电场下发生了从阳极到阴极的迁移;但是不同外阻条件下,Cu的去除率是不同的,外阻越大,靠近阳极的土壤区Cu的去除率越高,靠近阴极的土壤区Cu富集量越高.土壤中的Cu主要以乙酸可提取态、可还原态和可氧化态三种形式存在,其中乙酸可提取态迁移程度最大.
3.4 实验证明,三室MFC除了能实现Cu的迁移之外,还可以使部分Cu(II)迁移到达阴极,并实现还原.
[1] Bolan N, Kunhikrishnan A, Thangarajan R, et al. Remediation of heavy metal(loid)s contaminated soils--to mobilize or to immobilize? [J]. Journal of Hazardous Materials, 2014,266(4):141-166.
[2] Khalid S, Shahid M, Niazi N K, et al. A comparison of technologies for remediation of heavy metal contaminated soils [J]. Journal of Geochemical Exploration, 2017,182(Part B):247-268.
[3] Lu K, Yang X, Gielen G, et al. Effect of bamboo and rice straw biochars on the mobility and redistribution of heavy metals (Cd, Cu, Pb and Zn) in contaminated soil [J]. Journal of Environmental Management, 2017,186(Pt 2):285-292.
[4] Emenike C U, Agamuthu P, Fauziah S. Sustainable remediation of heavy metal polluted soil: A biotechnical interaction with selected bacteria species [J]. Journal of Geochemical Exploration, 2016.
[5] Sharma S, Tiwari S, Hasan A, et al. Recent advances in conventional and contemporary methods for remediation of heavy metal- contaminated soils [J]. Biotech, 2018,8(4):216.
[6] 串丽敏,赵同科,郑怀国,等.土壤重金属污染修复技术研究进展 [J]. 环境科学与技术, 2014,(S2):213-222. Chuan Limin, Zhao Tongke, Zheng Huaiguo, et al. Research advances in remediation of heavy metal contaminated soils [J]. Environmental Science & Technology, 2014,(S2):213-222.
[7] Bruce E. Logan, Bert Hamelers, René Rozendal, et al. Microbial fuel cells: Methodology and technology [J]. Environmental Science & Technology, 2006,40(17):5181.
[8] 李云龙,张宝刚,程 铭,等.微生物燃料电池技术治理重金属污染的研究进展 [J]. 环境科学与技术, 2015,(S1):254-258. Li Yunlong, Zhang Baogang, Cheng Ming, et al. Research progress on microbial fuel cells for heavy metal removals [J]. Environmental Science & Technology, 2015,(S1):254-258.
[9] Li X, Wang X, Weng L, et al. Microbial fuel cells for organic- contaminated soil remedial applications: A review [J]. Energy Technology, 2017,5(8):1156-1164.
[10] Chen Z, Huang Y C, Liang J H, et al. A novel sediment microbial fuel cell with a biocathode in the rice rhizosphere [J]. Bioresource Technology, 2012,108(1):55-59.
[11] Tender L M, Reimers C E, Stecher Haholmes D E, et al. Harnessing microbially generated power on the seafloor [J]. Nature Biotechnology, 2002,20(8):821.
[12] Habibul N, Yi H, Wang Y K, et al. Bioelectrochemical chromium (VI) removal in plant-microbial fuel cells [J]. Environmental Science & Technology, 2016,50(7):3882.
[13] 郝小旋,周秀秀,张 姣,等.厌氧发酵污泥燃料电池处理含铬废水的效能及机理 [J]. 中国环境科学, 2014,34(10):2581-2587. Hao Xiao-Xuan, Zhou Xiu-Xiu, Zhang Jiao, et al. Efficacy and mechanism of microbial fuel cell treating Cr(Ⅵ)-containing wastewater with anaerobically fermented sludge as substrate [J]. China Environmental Science, 2014,34(10):2581-2587.
[14] Huang L, Chen J, Quan X, et al. Enhancement of hexavalent chromium reduction and electricity production from a biocathode microbial fuel cell [J]. Bioprocess & Biosystems Engineering, 2010, 33(8):937.
[15] Qiu R, Zhang B, Li J, et al. Enhanced vanadium (V) reduction and bioelectricity generation in microbial fuel cells with biocathode [J]. 2017.
[16] Heijne A T, Liu F, Rv W, et al. Copper recovery combined with electricity production in a microbial fuel cell [J]. Environmental Science & Technology, 2010,44(11):4376.
[17] Wang Z, Lim B, Lu H, et al. Cathodic reduction of Cu2+and electric power eneration using a microbial fuel cell [J]. Bulletin- Korean Chemical Society, 2010,31(31):2025-2030.
[18] Rozendal R A, Buisman C J N. Effects of Membrane Cation Transport on pH and Microbial Fuel Cell Performance† [J]. Environmental Science & Technology, 2006,40(17):5206-5211.
[19] 杨政伟,顾莹莹,赵朝成,等.土壤微生物燃料电池的研究进展及展望 [J]. 化工学报, 2017,68(11):3995-4004. Yang Zhengwei, Gu Yingying, Zhao Chaocheng, et al. Research progress and prospect of soil microbial fuel cells [J]. CIESC Journal, 2017.
[20] Klass D L. Biomass for Renewable Energy, Fuels, and Chemicals [M]. City, 2000.
[21] 周秀秀,顾早立,郝小旋,等.剩余污泥燃料电池处理含铬废水的效能及机理 [J]. 中国环境科学, 2014,34(9):2245-2251. Zhou XiuXiu, Gu ZaoLi, Hao XiaoXuan, et al. Efficacy and mechanism of microbial fuel cell treating Cr(VI)-containing wastewater with excess sludge as substrate [J]. China Environmental Science, 2014,34(9): 2245-2251.
[22] 杨 芳,李兆华,肖本益.微生物燃料电池内阻及其影响因素分析 [J]. 微生物学通报, 2011,38(7):1098-1105. Yang Fang, Li Zhaohua, Xiao benyi. Analysis of internal resistance and its influencing factors of MFC [J]. Microbiology China, 2011,38(7):1098-1105.
[23] Rauret G, Lópezsánchez J F, Sahuquillo A, et al. Improvement of the BCR three step sequential extraction procedure prior to the certification of new sediment and soil reference materials [J]. Journal of Environmental Monitoring Jem, 1999,1(1):57.
[24] Ure A M, Quevauviller P, Muntau H, et al. Speciation of heavy metals in soils and sediments. An account of the improvement and harmonization of extraction techniques undertaken under the auspices of the BCR of the commission of the European communities [J]. International Journal of Environmental Analytical Chemistry, 1993,51(1-4):135-151.
[25] Sajana T K, Ghangrekar M M, Mitra A. Effect of operating parameters on the performance of sediment microbial fuel cell treating aquaculture water [J]. Aquacultural Engineering, 2014,61(8):17-26.
[26] 陈 青,周顺桂,袁 勇,等.外阻对污泥微生物燃料电池产电以及有机物降解的影响 [J]. 生态环境学报, 2011,20(5):946-950. Chen Qing, Zhou Shungui, Yuan Yong, et al. Effect of external resistance on electricity production and degradation of organic matter in sludge microbial fuel cells [J]. Ecology and Environmental Sciences, 2011, 20(5):946-950.
[27] Alhamdan A Z, Reddy K R. Transient behavior of heavy metals in soils during electrokinetic remediation [J]. Chemosphere, 2008,71(5): 860-871.
[28] Yeung A T, Gu Y Y. A review on techniques to enhance electrochemical remediation of contaminated soils [J]. Journal of Hazardous Materials, 2011,195(52):11.
[29] Kim S O, Kim K W. Monitoring of electrokinetic removal of heavy metals in tailing-soils using sequential extraction analysis [J]. Journal of Hazardous Materials, 2001,85(3):195.
[30] 陈 明. pH值对土壤吸附铜的影响分析 [J]. 四川环境, 2012, 31(6):13-15. Ming C. Effect of pH Value on Soil Adsorption of Copper [J]. Sichuan Environment, 2012,31(6):13-15.
[31] Ottosen L M, Hansen H K, Ribeiro A B, et al. Removal of Cu, Pb and Zn in an applied electric field in calcareous and non-calcareous soils [J]. Journal of Hazardous Materials, 2001,85(3):291.
[32] Habibul N, Hu Y, Sheng G-P. Microbial fuel cell driving electrokinetic remediation of toxic metal contaminated soils [J]. Journal of Hazardous Materials, 2016,318(Supplement C):9-14.
[33] 童君君.土壤重金属污染(Cu/Cr)电动修复基础研究 [D]. 合肥:合肥工业大学, 2013. Tong Junjun. Fundamental study on electrokinetic remedation of soils polluted by Cu/Cr [D]. Hefei: Hefei University of Technology, 2013.
[34] 滕彦国,刘 晶,崔艳芳,等.德兴矿区土壤中铜的地球化学形态及影响因素 [J]. 矿物岩石, 2007,27(2):59-63. Teng Y G, Liu J, Cui Y F, et al. Geochemical speciation and affacting factors of copper in the soil in Dexing mining area [J]. Journal of Mineralogy & Petrology, 2007,27(2):59-63.
[35] Chen Z, Zhu B K, Jia W F, et al. Can electrokinetic removal of metals from contaminated paddy soils be powered by microbial fuel cells? [J]. Environmental Technology & Innovation, 2015,3:63-67.
[36] Peng J F, Song Y H, Yuan P, et al. The remediation of heavy metals contaminated sediment [J]. Journal of Hazardous Materials, 2009,161 (2):633-640.
[37] 袁时珏,张道方. pH和溶解氧对上海蕴藻浜河道沉积物重金属的影响 [J]. 能源研究与信息, 2016,32(2):63-70. Shijue Y, Daofang Z. Effects of pH and dissolved oxygen on the release of heavy metals in the sediment from Yunzaobang River [J]. Energy Research & Information, 2016,32(2):63-70.
[38] 姚 敏,张宇峰,崔志强,等.pH和有机配体对Cu-Pb复合污染土壤中Cu的解吸行为的影响 [J]. 南京工业大学学报(自然科学版), 2006, 28(4):9-12. Yao M, Zhang Y, Cui Z, et al. Influence of pH and organic chelators on desorption of copper from copper-lead complex contam inated soil [J]. Journal of NanJing University of Technology, 2006, 28(4):9-12.
[39] Wang H, Song H, Yu R, et al. New process for copper migration by bioelectricity generation in soil microbial fuel cells [J]. Environmental Science & Pollution Research, 2016,23(13):13147-13154.
[40] Tao H C, Liang M, Li W, et al. Removal of copper from aqueous solution by electrodeposition in cathode chamber of microbial fuel cell [J]. Journal of Hazardous Materials, 2011,189(1):186-192.
[41] Elbana T A, Magdi Selim H, Akrami N, et al. Freundlich sorption parameters for cadmium, copper, nickel, lead, and zinc for different soils: Influence of kinetics [J]. Geoderma, 2018,324:80-88.
Influence of external resistance on the bioelectricity generation and the migration of Cu in a three-chamber microbial fuel cell.
ZHU Dan-dan, ZHANG Jing-ran, ZHOU Xuan, WANG Hui, LI Xian-ning*
(Department of Environmental Science, Southeast University, Nanjing 210096, China)., 2019,39(2):732~740
In this study, a novel three-chamber microbial fuel cell (MFC) was constructed in the soil contaminated with Cu, the performance of bioelectricity generation and the migration of Cu in MFC with different external resistance conditions were investigated. The results revealed that the output voltage of the three-chamber MFC increased from 0.1V to 0.4V with the external resistance increased from 100Ω to 1000Ω, and the maximum power density decreased from 1.10W/m3to 0.71W/m3. The phenomenon of cathode polarization was more obvious with the increase of external resistance. Experimental results showed that the electricity generated by MFCs could significantly facilitate metal removal, the removal efficiency of Cu in soil near anode reached 39.7% with the external resistance of 1000Ω after 63 days. Meanwhile, the modified Community Bureau of Reference (BCR) sequential extraction procedure was applied to characterize the five fractions of heavy metals. It showed that acid extractable and reducible fractions were the two main fractions of Cu migration. In addition, the pHincreased gradually from the anode to the cathode in Cu-contaminated soil while the conductivity was opposite. The results of the scanning electron microscope (SEM) and X-ray diffraction (XRD) demonstrated that the Cu (II) which partially migrated to the cathode was reduced to the metal copper.
microbial fuel cells (MFCs);external resistance;soil remediation;Cu migration
X53
A
1000-6923(2019)02-0732-09
朱丹丹(1995-),女,江苏泰州人,东南大学硕士研究生,主要研究方向为水污染控制.
2018-07-20
江苏省自然科学基金资助项目(BK20171351);中央高校基本科研业务费专项资金资助项目(2242016K41042)
* 责任作者, 教授, lxnseu@163.com
