高危型人乳头瘤病毒载量对不同宫颈病变调节性T淋巴细胞表达的影响研究
2019-02-27余杨付艳丽孙翔
余杨,付艳丽,孙翔
高危型人乳头瘤病毒(HR-HPV)持续性感染是导致宫颈上皮内瘤变(CIN)及宫颈癌的主要病因[1-4]。发达国家建立的完善筛查体系,使宫颈癌的发病率和病死率显著下降,新发病例居于全身恶性肿瘤的第10位,而在发展中国家,新发病例位于第2位[5]。由此可见,基于HR-HPV建立可进一步分选出高级别CIN和宫颈癌高危人群的合理筛查体系很重要和迫切。肿瘤是多种因素共同作用的结果,HR-HPV持续性感染是宫颈癌发生的必要条件,却非唯一致病条件,HR-HPV感染后诱发的宫颈病变转归与机体免疫功能,尤其是宫颈局部微环境免疫功能密切相关[6]。机体免疫调控复杂多样,免疫细胞之间,外来抗原HR-HPV和免疫细胞之间,HR-HPV、免疫细胞与局部微环境之间均存在相互制约、相互调节的交互作用和交联影响。免疫抑制细胞构筑的免疫抑制微环境通过免疫耐受、免疫逃逸等机制促进宫颈病变的进展[7],调节性T淋巴细胞(Treg)是一群发挥免疫抑制功能的独特辅助性T淋巴细胞亚群,叉头翼状螺旋转录因子3(Foxp3)是Treg的特征性分子标志,可对肿瘤免疫应答从启动到效应的整个阶段全程调控。本研究同步监测宫颈局部微环境HR-HPV载量和Treg变化,探讨其与宫颈病变进程的联系和发展趋势,为HR-HPV持续性感染者更深入地分流诊治提供临床依据。
本研究背景:
宫颈癌的发生、发展是多种因素参与调控的复杂过程,仅高危型人乳头瘤病毒(HR-HPV)诱导细胞内DNA突变是不够的,还需在慢性炎症的持续刺激下不断累积变异,再加上微环境改变肿瘤细胞的生物学特性,发生恶性特征转化的强大激活信号,基因组、微环境、炎症和免疫体系发生改变的综合结果导致了癌变的风险,因此,HR-HPV持续性感染是宫颈癌发生的必要条件而非充分条件,基于HR-HPV感染并能方便、无创、准确量化地反映宫颈癌生物学行为变化的标志物是临床重点。目前宫颈局部微环境中HR-HPV载量对调节性T淋巴细胞(Treg)表达的影响及其两者同时在HR-HPV免疫逃逸和宫颈病变进程中相互作用的报道较少。本研究围绕HR-HPV抗原既可激发免疫反应又可负向抑制免疫反应的特点,探讨不同微环境诱导的Treg表达差异对宫颈病变进程或促进或抑制的双向影响,为宫颈癌前病变以及宫颈癌个性化诊疗方案提供实验指导和临床思路。
1 资料与方法
1.1 临床资料 选取2012年1月—2015年7月河南理工大学第一附属医院经液基薄层细胞检测技术(TCT)筛查、HR-HPV基因分型检测〔聚合酶链式反应(PCR)-反向点杂交法〕,最终经阴道镜下宫颈多点病理活检确诊的HR-HPV持续性感染的不同宫颈病变患者342例,年龄38~55岁;其中慢性宫颈炎55例、CINⅠ级73例、CINⅡ级71例、CINⅢ级72例、宫颈癌71例。纳入标准:(1)有1年以上性生活史;(2)经2名以上有经验病理科医师确诊;(3)患者本人知情同意。排除标准:(1)妊娠期妇女;(2)合并其他恶性肿瘤或自身免疫性疾病;(3)近期使用过免疫抑制类药物;(4)人类免疫缺陷病毒(HIV)阳性;(5)有放化疗史;(6)2周内接受过局部或全身抗病毒药物治疗。HR-HPV持续性感染的定义:HR-HPV感染者随访1次/6个月,在间隔6~12个月相邻两次随访中,同一例患者宫颈检测样本均显示HR-HPV阳性且为同种类型,修改为第1年随访1次/4个月,以后至少1次/6个月(依据病情动态监测),持续时间均在2年以上[8-9]。
1.2 主要仪器与试剂 流式细胞仪购自美国BD FACS Calibur,配有BD CellQuest软件。试剂:鼠抗人异硫氰酸荧光素(FITC)-CD4单克隆抗体、鼠抗人PE-CD25单克隆抗体、鼠抗人PE-Cy5-Foxp3单克隆抗体均购自美国eBioscience公司。PCR扩增仪DA7600型和HRHPV核酸定量(16、18、31、33、45、52、56、58共8个型)检测试剂盒均由中山大学达安基因股份有限公司提供。
1.3 方法
1.3.1 采用宫颈刷取物制备宫颈病变单细胞悬液 采用阴道窥器暴露宫颈,干棉球拭净宫颈口过多分泌物,观察宫颈,将刷头插入宫颈管,中央较长的刷丝针对准新鲜病变部位,顺时针或逆时针旋转3~5圈,取下刷头,并将其浸泡在含液基细胞学保存液的瓶中,300目尼龙网过滤杂质,取10 ml保存液转入15 ml试管,402×g离心5 min,弃上清液,取2 ml沉淀液,以磷酸盐缓冲液(PBS)漂洗2~3次,45×g离心沉淀1~2 min,进行细胞计数,不少于106个。
1.3.2 流式细胞仪检测单细胞悬液中Treg 调整细胞浓度至(1~2)×107个/ml,用PBS洗涤、重悬,取上述细胞100 μl,加入鼠抗人FITC-CD4单克隆抗体、鼠抗人PE-CD25单克隆抗体各5 μl,混匀,室温避光20 min,加冷固定破膜剂1 ml,4 ℃避光孵育30 min,加破膜缓冲液2 ml,洗涤2次,弃上清液,加鼠抗人PE-Cy5-Foxp3单克隆抗体进行细胞内染色,4 h内进行流式细胞仪检测。用空白管调节电压,以CD25同型对照调节补偿,确定细胞群,再以细胞设门,以Foxp3同型对照确定阳性信号,最后测定C管,检测Foxp3+细胞占C细胞的百分比。
1.3.3 HR-HPV载量检测 无菌条件下采用宫颈刷插入宫颈内,旋转数圈后停留片刻取出,将宫颈刷置入无菌管,采集的宫颈分泌物及时送检或4 ℃保存1周内检测。DNA提取和PCR扩增按其说明书(PCR荧光法)进行具体操作。根据HR-HPV载量拷贝数分为4组:低载量组(104~105copies/ml)69例、中载量组(>105~106copies/ml)90例、高载量组(>106~107copies/ml)106例、超高载量组(>107copies/ml)77例。
1.4 统计学方法 采用SPSS 17.0软件进行统计学处理。计量资料以M(P25,P75)表示,HR-HPV载量经对数转换,多组间比较采用秩和检验,组间两两比较采用Mann-Whitney U检验;计数资料比较采用χ2检验;相关性分析采用Pearson简单相关分析及偏相关分析;选用简单和复式箱型图解析数据分布,绘制散点图加趋势拟合线描述线性关系。以P<0.05为差异有统计学意义。
2 结果
2.1 绘制HR-HPV载量标准曲线 PCR荧光法阈值设定原则是值线刚好超过正常阴性样品扩增曲线的最高点,且循环阈值(Ct)不出现任何数值。以标准品4个浓度(1×103~1×106copies/ml)的对数值为横坐标,Ct为纵坐标,绘制标准曲线(见图1)。Ct与样本起始模板的拷贝数呈正相关,与起始模板拷贝数对数值间有严格的线性反比关系。
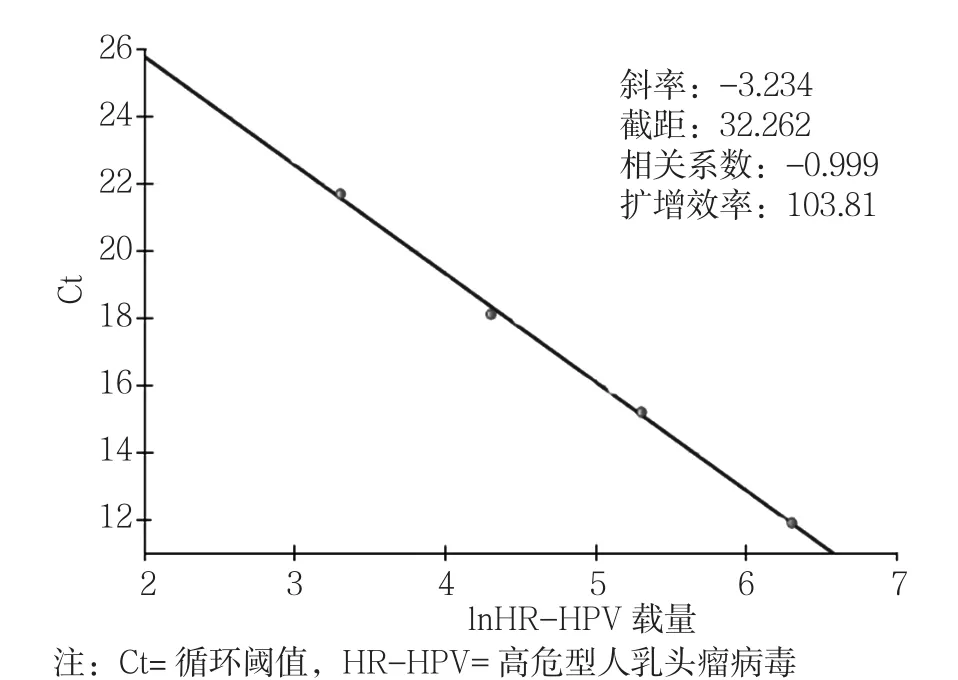
图1 PCR荧光法检测HR-HPV载量的标准曲线Figure 1 Standard curve of HR-HPV load detected by QF-PCR
2.2 低载量组、中载量组、高载量组、超高载量组患者年龄及Treg比较 低载量组、中载量组、高载量组、超高载量组患者年龄比较,差异无统计学意义(P>0.05)。低载量组、中载量组、高载量组、超高载量组患者Treg比较,差异有统计学意义(P<0.05);其中中载量组、高载量组、超高载量组患者Treg较低载量组升高,高载量组、超高载量组患者Treg较中载量组升高,超高载量组患者Treg较高载量组升高,差异均有统计学意义(P<0.05,见表1)。复式箱型图显示各组均无异常值,HR-HPV载量逐步增加,Treg分布愈加分散,超高载量组Treg分布最分散,低、中载量组Treg分布较为集中(见图2)。
2.3 慢性宫颈炎、CINⅠ级、CINⅡ级、CINⅢ级、宫颈癌患者年龄、Treg及HR-HPV载量比较 慢性宫颈炎、CINⅠ级、CINⅡ级、CINⅢ级、宫颈癌患者年龄比较,差异无统计学意义(P>0.05)。慢性宫颈炎、CINⅠ级、CINⅡ级、CINⅢ级、宫颈癌患者Treg、HR-HPV载量比较,差异均有统计学意义(P<0.05);其中CINⅠ级患者Treg较慢性宫颈炎升高,CINⅡ级、CINⅢ级、宫颈癌患者Treg、HR-HPV载量较慢性宫颈炎、CINⅠ级升高,CINⅢ级患者Treg较CINⅡ级升高,宫颈癌患者Treg、HR-HPV载量较CINⅡ级、CINⅢ级升高,差异均有统计学意义(P<0.05,见表2)。复式箱型图显示在慢性宫颈炎中有1个温和的异常值,其余病变组无异常值,随宫颈病变程度的加重,Treg分布愈加分散,宫颈癌组Treg分布最分散,低宫颈病变Treg分布较为集中(见图3);在慢性宫颈炎和宫颈癌中共有3个温和的异常值,其余病变组无异常值,随宫颈病变程度的加重,HR-HPV载量分布趋向分散,宫颈癌组HRHPV载量分布最分散,低宫颈病变HR-HPV载量分布较为集中(见图4)。

表1 低载量组、中载量组、高载量组、超高载量组患者年龄及Treg比较〔M(P25,P75)〕Table 1 Comparison of age and number of Treg in patients with different cervical lesions by HR-HPV load
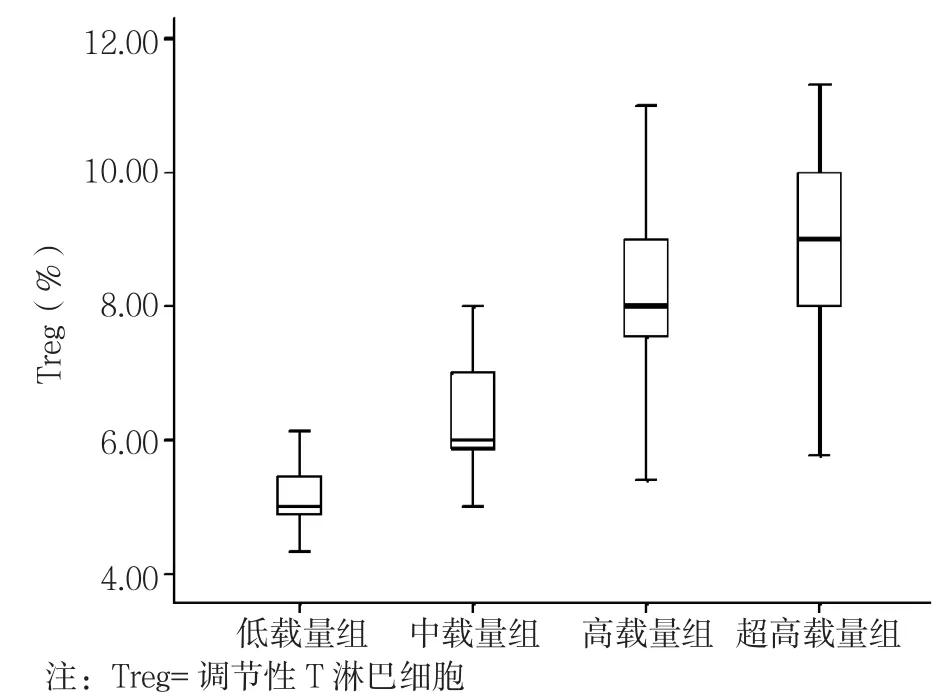
图2 低载量组、中载量组、高载量组、超高载量组患者Treg分布Figure 2 Distribution of the number of Treg in patients with different cervical lesions by HR-HPV load
2.4 低载量组、中载量组、高载量组、超高载量组不同病变患者分布 低载量组、中载量组、高载量组、超高载量组宫颈病变分布比较,差异有统计学意义(P<0.05,见表3)。复式箱型图显示,在低、中载量组不同宫颈病变的Treg分布较为集中,高、超高载量组不同宫颈病变的Treg分布更加分散,特别是宫颈癌组数值波动幅度较大;低级别宫颈病变不同载量组中Treg集中分布趋势明显,仅CINⅠ级在高载量组有小幅波动,高级别CIN和宫颈癌在低、中载量组Treg分布较为集中,在高、超高载量组数据分散,波动明显,幅度较大(见图5)。
2.5 相关性分析 简单相关分析显示,HR-HPV载量与宫颈病变、Treg呈正相关(r=0.631、0.683,P<0.05),组别与宫颈病变、Treg呈正相关(r=0.612、0.686,P<0.05),宫颈病变与Treg呈正相关(r=0.863,P<0.05)。控制组别后,偏相关分析显示,HR-HPV载量与宫颈病变、Treg呈正相关(r=0.204、0.137,P<0.05), 宫 颈 病 变 与 Treg呈 正 相 关(r=0.770,P<0.05)。控制Treg后,偏相关分析显示,宫颈病变与HR-HPV载量呈正相关(r=0.114,P<0.05),组别与宫颈病变无直线相关关系(r=0.053,P>0.05)。以组别为横坐标,Treg为纵坐标,宫颈病变作为点标签绘制散点图并添加总体趋势拟合线(R2=0.572),结果显示,此三变量之间存在线性关系,子变量慢性宫颈炎、CINⅠ级、CINⅡ级、CINⅢ级、宫颈癌的趋势拟合线决定系数R2依次为0.559、0.339、0.653、0.546、0.085。不同宫颈病变与HR-HPV载量、Treg的拟合线决定系数R2分别为0.399和0.789(见图6)。
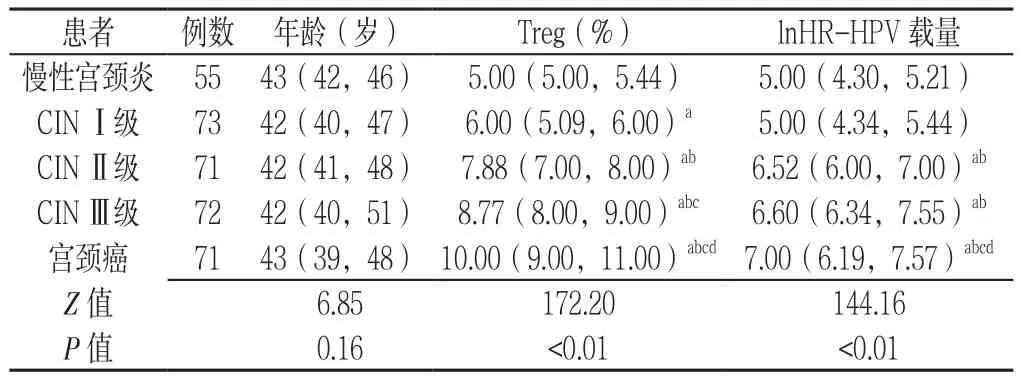
表2 慢性宫颈炎、CINⅠ级、CINⅡ级、CINⅢ级、宫颈癌患者年龄、Treg及HR-HPV载量比较〔M(P25,P75)〕Table 2 Comparison of age,number of Treg and HR-HPV load in patients with chronic cervicitis,CINⅠ,CINⅡ,CINⅢ and squamous carcinoma of the cervix
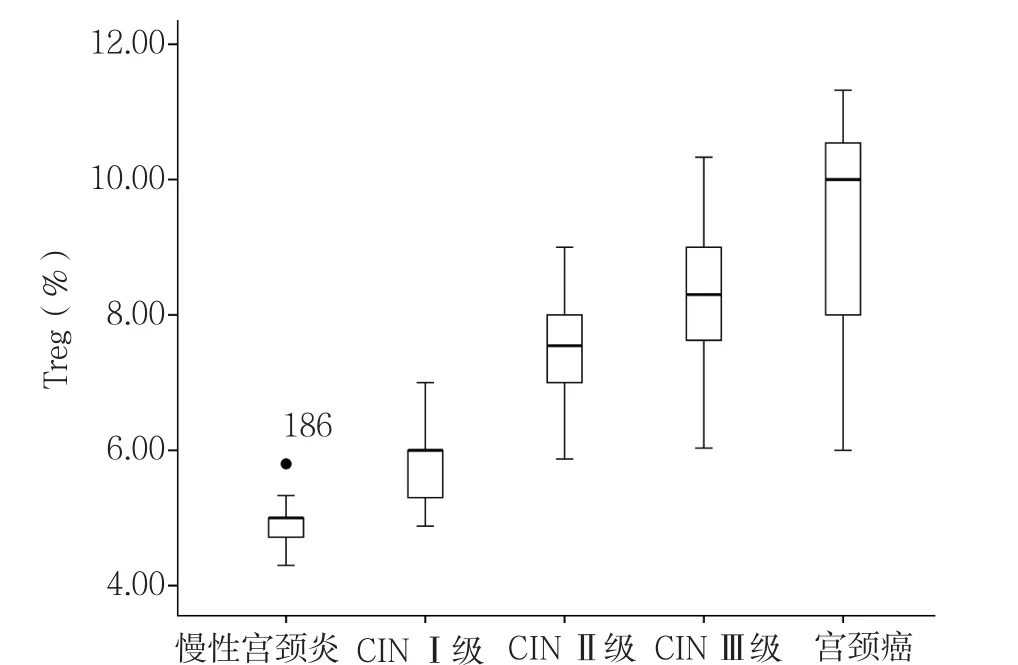
图3 慢性宫颈炎、CINⅠ级、CINⅡ级、CINⅢ级、宫颈癌患者Treg分布Figure 3 Distribution of the number of Treg in patients with chronic cervicitis,CINⅠ,CINⅡ,CINⅢ and squamous carcinoma of the cervix
3 讨论
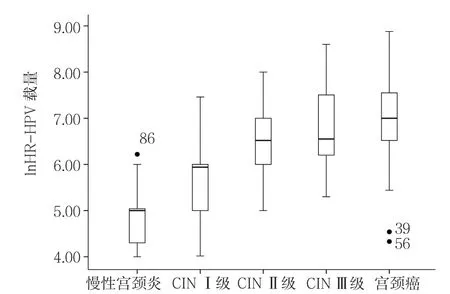
图4 慢性宫颈炎、CINⅠ级、CINⅡ级、CINⅢ级、宫颈癌患者HR-HPV载量分布Figure 4 Distribution of the level of HR-HPV load in patients with chronic cervicitis,CINⅠ,CINⅡ,CINⅢ and squamous carcinoma of the cervix
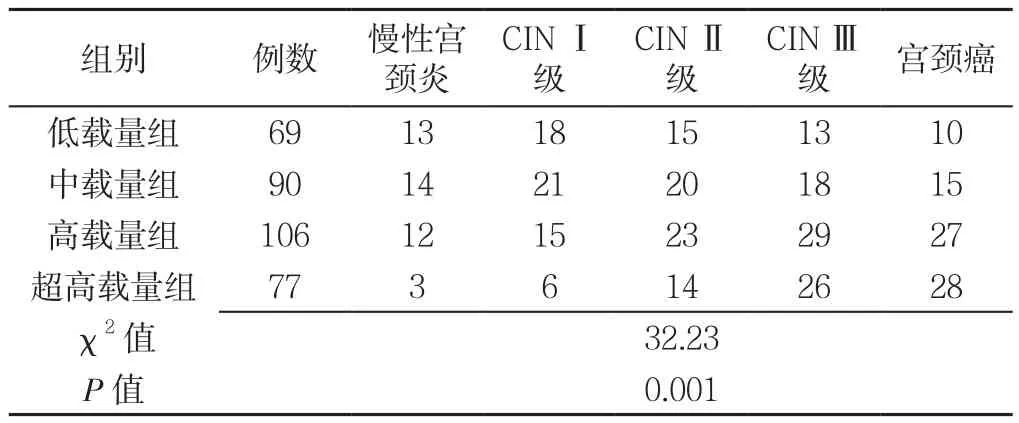
表3 低载量组、中载量组、高载量组、超高载量组不同病变患者分布Table 3 Distribution of different cervical lesions in patients by the level of HR-HPV load
宫颈病变阶梯式缓慢演变进程,加之病因明确、方便取材的优势,预示着宫颈癌是可以早预防、早发现、早治疗的,但事实并不似预期,我国每年新发宫颈癌患者多达13万,发病年轻化趋势明显,10年间下降约5岁[10]。化疗、手术和放射等传统疗法难以根治残留的小病灶或微转移灶,35%左右的患者因复发或转移死亡[11],以激活抗肿瘤免疫为基础的免疫治疗,其临床疗效并不理想,这与肿瘤细胞所处的肿瘤微环境关系密切[12],主要是免疫抑制微环境负向调控作用的强大。很多病变的早期,机体的全身免疫功能并未出现明显的改变,但病变局部即已存在免疫抑制。文献报道,Treg表达强度与HPV-16基因所致宫颈癌变关系密切[13]。本研究结果显示,HR-HPV载量在宫颈癌变期有相对较大的浮动,在慢性宫颈炎/CINⅠ级之间以及CINⅡ级/CINⅢ级之间HR-HPV载量差异不明显,提示HRHPV载量与宫颈病变的严重程度不总是同步的,一定范围内HR-HPV载量越高,触发的抗HR-HPV免疫应答越强,适当的免疫应答有利于HR-HPV清除,但过度的免疫应答反过来损坏免疫功能和靶向组织器官功能,使机体处于HR-HPV感染和免疫功能受损的恶性循环中。HR-HPV载量不能作为区分宫颈病变程度良好的量化指标,但高/超高的HR-HPV载量仍有预警作用,可间接反映机体对病毒的清除能力和感染轻重。相关分析显示,HR-HPV载量、宫颈病变、Treg均呈正相关,宫颈病变与Treg高度相关;偏相关分析显示:控制组别后,宫颈病变与Treg仍呈正相关,相关系数较简单相关分析稍微下降;控制Treg后,宫颈病变与组别间不再有直线相关性。提示HR-HPV载量、Treg、宫颈病变3个变量之间存在交互影响,Treg较HR-HPV载量与宫颈病变进展更具相关性,HR-HPV持续感染是宫颈病变进展恶化过程中必要条件的第一步,宫颈局部微环境免疫失衡是关键环节,推测病变进展到重度CIN和宫颈癌程度后,细胞的恶性转化可能不再依赖HR-HPV的高载量。

图5 低载量组、中载量组、高载量组、超高载量组不同病变患者Treg分布Figure 5 Distribution of the number of Treg in patients with different cervical lesions by the level of HR-HPV load
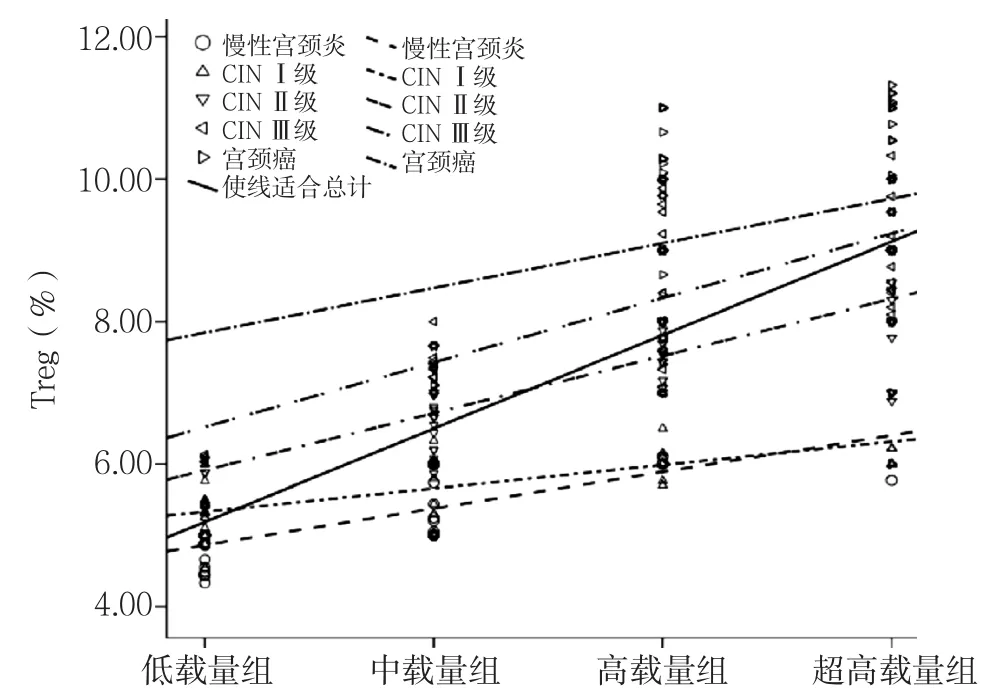
图6 低载量组、中载量组、高载量组、超高载量组不同病变患者Treg分布Figure 6 Distribution of the number of Treg in patients with different cervical lesions by the level of HR-HPV load
HR-HPV感染不是全身的,不形成病毒血症。肿瘤微环境是有别于人体正常内环境的复杂系统,具有低氧、低pH值及高压的特点,使效应T淋巴细胞转变为无功能状态,随后凋亡,从而损害抗肿瘤免疫反应,在肿瘤的发生、发展过程中至关重要[14]。肿瘤微环境具有异质性,不同的个体、不同的肿瘤,甚至在同一个体的不同部位,均面对不同的免疫微环境,肿瘤免疫治疗的疗效存在明显的个体差异,目前多将此归于肿瘤微环境的异质性[15]。本研究发现,不同HR-HPV载量组别和不同宫颈病变患者Treg均有明显差异,在超高的病毒载量作用下和宫颈癌变期,Treg分散趋势明显,波动明显,幅度较大,提示HR-HPV载量越高、宫颈病变越重,宫颈局部免疫抑制微环境组成的异质性越显著,个体差异越大,治疗方面应突出个性化的特点;复式箱型图直观地显示了HR-HPV诱导的Treg表达强度在增加宫颈病变这一变量后数值分布的多样性,提示宫颈局部免疫抑制微环境异质性的复杂多变,组成上和功能上的异质性,为此在注重个体化治疗的同时,密切监测微环境的动态变化,及时调整,至关重要;在判定HR-HPV载量与Treg的相关性上,若将宫颈病变视为整体考量,其所起的决定作用为0.572,慢性宫颈炎、CINⅠ级、CINⅡ级、CINⅢ级、宫颈癌所起的决定作用依次为0.559、0.339、0.653、0.546、0.085,换言之,宫颈癌变期宫颈局部免疫抑制微环境异质性最复杂。通过上述统计学分析推测,宫颈癌变期和超高的病毒载量在宫颈局部免疫抑制微环境异质性上发挥了更大和更为复杂的作用,在不同程度宫颈病变、不同HR-HPV载量中Treg表达量及其发挥的功能并由此产生的重要作用并不相同。Treg的免疫抑制作用在HR-HPV相关性宫颈病变的进程变化中,可能因微环境的差异具有双向性调节:(1)对HPV诱导的持续炎性刺激形成保护性生理防御反应,在防止过强的免疫损伤和清除病原体之间维持平衡,以减缓组织病理损害;(2)免疫逃逸导致机体对肿瘤的免疫无应答或免疫反应低下,促使宫颈癌变。结合本研究结果,Treg在程度较低的宫颈病变和低拷贝的病毒载量时,作用较一致,其表达水平的升高更多是一种应激性保护防御反应的正向作用,提示Treg在病毒感染过程中可使组织损伤程度最小化[16],致使HR-HPV感染虽持续存在,但患者病情较轻,应动态监护,持续随访。Treg在CINⅢ级/宫颈癌和高/超高拷贝的病毒载量时,三者之间不一致性更大,表现多样,复杂多变。
在HR-HPV相关性宫颈病变中,细胞免疫功能状态虽不能直接反映抗HR-HPV免疫效应,通过联合HR-HPV载量等指标能较好地预测HR-HPV感染人群的宫颈病变发展进程。肿瘤的发生和发展不仅依赖于基因突变,还与肿瘤微环境的异质性有关,所有抗瘤和促瘤因素共同组成肿瘤微环境的免疫网络,肿瘤微环境的动态改变影响抗瘤/促瘤效应平衡,决定肿瘤逆转、稳定和恶化的转归趋向。CD4+Treg负向调节免疫反应的特性,不仅导致HR-HPV慢性感染长时间持续存在,所形成的慢性炎性微环境作为免疫微环境的重要组成部分,在宫颈病变进展过程中作用重大,通过其异质性和动态演变精细调控病毒复制和机体效应之间的相互作用。因此,基于对HR-HPV感染引发人体病变的整体认识,从宫颈局部微环境入手,兼顾正向和负向调控机制,此外,考虑到肿瘤免疫抑制性微环境存在的异质性,在宫颈癌免疫诊断和治疗方面应体现个体化特点,助推精准医疗发展。
作者贡献:余杨进行文章的构思与设计,研究的实施与可行性分析,结果的分析与解释,撰写论文;孙翔进行数据收集、整理,统计学处理;付艳丽进行论文的修订,负责文章的质量控制及审校;余杨、付艳丽对文章整体负责,监督管理。
本文无利益冲突。
