稳定过表达人源SAMHD1基因细胞株的建立及其抗病毒活性的研究
2019-02-27武晋英张洲李子威王昊然操孙润李宇恒宋晓宇曹流
武晋英,张洲,李子威,王昊然,操孙润,李宇恒,宋晓宇,曹流
(中国医科大学转化医学研究院,辽宁省协同创新中心,沈阳 110122)
SAMHD1 (sterile α motif domain and HD domaincontaining protein 1) 蛋白是真核细胞内的一种天然免疫抑制因子[1-2],HD蛋白结构域具有脱氧核苷三磷酸 (deoxyribonucleoside triphosphate, dNTP) 水解酶活性,可水解病毒RNA、DNA转录和复制所必需的原料物质,从而阻断病毒侵袭宿主细胞、发挥抑制病毒感染的功能[3-8]。SAMHD1基因突变可诱发类似先天性病毒感染的遗传性自身免疫性疾病、Aicardi-Goutières 综合征 (Aicardi-Goutières syndrome,AGS)[9-10]。近期研究发现SAMHD1蛋白dNTP水解酶活性可被细胞周期检验点激酶磷酸化修饰调节[11],进而参与细胞周期调控、维系细胞稳态[12]、调节DNA损伤修复进程[13-14],从而影响肿瘤等疾病的发生与治疗[15-16]。为了深入研究SAMHD1蛋白的功能与相关分子机制,急需建立稳定表达SAMHD1蛋白的细胞系。本研究利用慢病毒过表达质粒载体pCDH-EF1- MCS-T2A-copGFP,进行稳定过表达人源SAMHD1基因的结肠癌细胞系构建,并进行1型单纯疱疹病毒 (herpes simplex virus type 1,HSV-1) 病毒感染实验加以验证,为进一步探索SAMHD1的生物学功能奠定实验基础。
1 材料与方法
1.1 质粒、细胞及主要试剂
pCDH-EF1-MCS-T2A-copGFP质粒、慢病毒包装质粒 (PCMV-dr8.9dvpr418 和 PCMV-VSV-G419)、人结肠癌细胞 (HCT116) 为本实验室保存;HSV-1购自辽宁佰昊生物科技有限公司;RNAiso PLus、M-MLV反转录合成cDNA试剂盒、 PrimerSTAR、 EcoR1、 BamH1、T4 Ligase、E.coli.DH5a购自日本TaKaRa公司;琼脂糖凝胶DNA回收试剂盒购自美国Axygen公司;转染试剂Tubofect transfection购自美国Thermo Scientific公司;Anti-SAMHD1、β-actin 抗体购自英国Abcam公司;其余分子生物学试剂购自美国Sigma公司。
1.2 细胞培养
人结肠癌细胞HCT116用含10%胎牛血清及青霉素 (100 U/mL) 和链霉素 (100 U/mL) 的RPMI 1640培养基,置于37 ℃、5% CO2孵箱培养,根据细胞的生长情况进行传代,调整好细胞状态备用。
1.3 总RNA的提取及cDNA合成
运用Trizol法提取HCT116细胞中的总RNA,在ThermoNanodrop浓度分析仪上测定总RNA浓度,然后利用cDNA合成试剂盒,逆转绿合成cDNA,将其暂存于-20 ℃备用。
1.4 PCR扩增与重组质粒构建
根据GENBANK中的人源SAMHD1基因序列,设计SAMHD1引物:F,CCGGAATTCATGCAGCGAGC CGATTC; R,CGGGATCCTCACATTGGGTCATCT。以1.3中合成的cDNA为模板扩增SAMHD1全长编码区序列。纯化PCR产物,并将其与pCDH-EF1-MCS-T2A-copGFP质粒分别用EcoRⅠ和BamHⅠ限制性核酸内切酶进行酶切,最后利用T4 Ligase将SAMHD1片段与pCDH-EF1-MCS-T2A-copGFP载体连接,构建重组质粒PCDH-EF1-MCS-SAMHD1-T2A-GFP。重组质粒经EcoRⅠ和BamHⅠ双酶切初步鉴定,送测序验证。
1.5 稳定表达人源SAMHD1细胞株构建
1.5.1 表达人源SAMHD1的慢病毒制备:分别将4.4 μ g PCMV-dr8.9dvpr418、2.2 μ g PCMV-VSV-G419、3.4 μ g pCDH-EF1-MCS-SAMHD1-T2A-GFP或pCDH-EF1-MCS-T2A-copGFP 质粒稀释于1 mL无血清DMEM,加入20 μ L Tubofect转染试剂,立即混匀并低速离心,室温放置15~20 min,将上述混合液加入准备好的293T细胞,6 h后更换细胞培养液,24、48、72 h分别收集上清,2 000 r/min离心10 min去除细胞碎片,上清即为含有 pCDH-EF1-MCS-SAMHD1-T2A-GFP或pCDHEF1-MCS-T2A-copGFP 的病毒液。收集上清并加入适量PEG-it于4 ℃混转过夜,4 000 r/min离心30 min,500 μ L PBS重悬沉淀,4 ℃保存备用。
1.5.2 稳定表达人源SAMHD1细胞株建立:用1.5.1中制备的病毒 (100 μ L) 感染细胞 (培养皿直径=35 mm) ,密度约40% (1×105/皿) 的HCT116细胞,24 h后重复感染,48 h后正常培养。
1.5.3 稳定表达人源SAMHD1细胞株鉴定:冰上制备稳定表达SAMHD1的116细胞总蛋白样。Western blotting检测目的蛋白表达。
1.6 稳定表达SAMHD1细胞株的抗HSV-1病毒作用检测
首先进行HSV-1病毒扩大培养,用10 cm直径培养皿培养Hela细胞,密度达到100% (约1×107/皿) 后更换培液,加入新鲜培养基9 mL,再加入1 mL HSV-1病毒液。48~72 h收取上清,1 000 r/min离心 5 min,取上清,4 ℃冰箱短期保存。然后培养HCT116细胞,密度50%~70% (约7×106/皿) 时感染病毒 (培养基∶病毒液=9∶1) ,病毒感染12 h后换液。HSV-1病毒用绿色荧光蛋白 (green fluorescent protein,GFP) 标记。在荧光显微镜下观察并记录HSV-1感染0、12、24、36、48 h后情况,收集感染后细胞进行蛋白印记实验,检测病毒感染的标志性蛋白 (HSV-GD) 来评价过表达细胞株的抗病毒作用。
2 结果
2.1 重组质粒的构建及鉴定结果
结果显示,以合成的cDNA为模板采用特异性引物进行PCR扩增,把PCR产物连接到慢病毒表达载体pCDH-EF1-MCS-T2A-copGFP上,构建出重组质粒pCDH-EF1-MCS-SAMHD1- T2A-GFP。将重组质粒经EcoRⅠ和BamHⅠ双酶切鉴定,片段大小约为1 800 bp,与SAMHD1片段长度相符,见图 1。DNA测序结果证明SAMHD1基因插入方向及读码框正确,表明重组质粒构建成功,见图2。
2.2 稳定表达SAMHD1的细胞株建立及鉴定
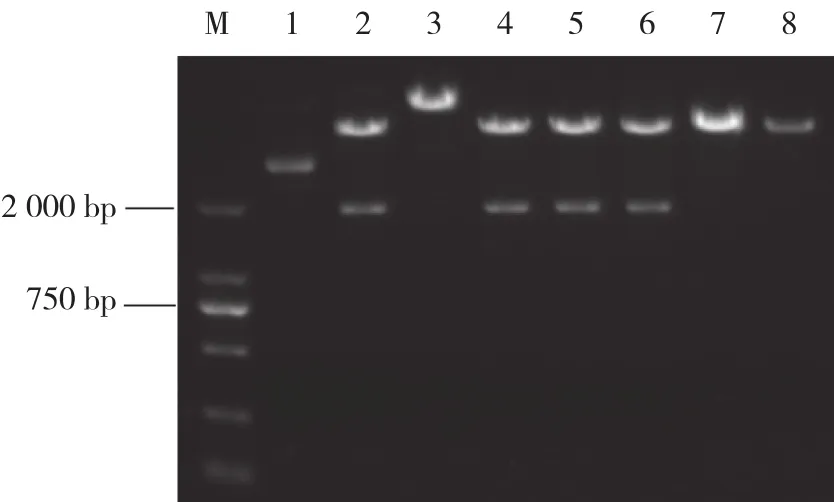
图1 重组质粒酶切鉴定的琼脂糖凝胶电泳图Fig.1 Restriction enzyme digestion results of the recombinant plasmid identified by agarose gel electrophoresis

图2 重组质粒测序结果图Fig.2 Sequencing chromatogram of the recombinant plasmid
将pCDH-EF1-MCS-SAMHD1-T2A-GFP和pCDHEF1-MCS-T2A-copGFP的假病毒感染HCT116细胞,感染2次后更换为正常培养基培养。细胞裂解液裂解感染后的细胞。Western blotting检测结果显示,感染pCDH-EF1-MCS- SAMHD1-T2A-GFP病毒细胞在72×103位置条带亮度明显增强,SAMHD1蛋白的相对表达量为1.108±0.066; 而空白对照HCT116细胞和感染pCDH-EF1-MCS-T2A-copGFP病毒液细胞在72×103位置未见条带亮度明显改变,SAMHD1蛋白相对表达量分别为0.708±0.043和0.719±0.011,见图3。表明稳定过表达SAMHD1的HCT116细胞株构建成功。
2.3 稳定表达 SAMHD1 细胞株抗病毒功能评价

图3 Western blotting 检测HCT116细胞中SAMHD1 蛋白表达Fig.3 Western blotting results of SAMHD1 protein expression in HCT116 cells
利用HSV-1 GFP病毒对目的细胞进行0、12、24、36、48 h感染,观察目的细胞中GFP荧光强度的高低变化确定感染时间,结果发现,36 h病毒感染效率最高。pCDH+HSV-1与未感染病毒pCDH组比较,感染组GFP荧光亮度明显增高,说明感染成功。但是同样都进行病毒感染的pCDH+ SAMHD1+ HSV-1组与pCDH+ HSV-1组细胞比较,GFP荧光亮度却未见明显增高,见图4A。结果显示,与pCDH-EF1-MCS-T2A-copGFP的HCT116细胞 (相对表达量为11.509±0.607 )比较,稳定表达pCDH-EF1-MCS-SAMHD1-T2A-GFP细胞 (相对表达量为1.234±0.072 ) GFP表达明显较少。同时收集感染后细胞进行蛋白印记实验,检测病毒感染的标志性蛋白 (HSV-GD) 表达来评价过表达细胞株的抗病毒作用。蛋白印记实验结果也证明过表达SAMHD1细胞中病毒感染的标志性蛋白HSV-GD表达较低,见图4B。以上实验结果均表明慢病毒介导的过表达SAMHD1基因的结肠癌细胞株能够有效抑制HSV-1复制。
3 讨论
2011年,研究[17]证实SAMHD1是一种有效的人类免疫缺陷病毒Ⅰ型(human immunodeficiency virus-1,HIV-1)限制因子。作为目前发现唯一的dNTP水解酶,SAMHD1通过调控脱氧核糖核苷三磷酸的含量来限制非循环细胞中的HIV-1感染,并且能够阻断细胞中逆转录病毒的转录过程和DNA病毒的复制[5-6,18]。随后人们对其抗病毒功能进行了大量研究,dNTP是细胞、寄生虫和病毒DNA聚合酶的通用底物[19],因此细胞dNTP含量几乎影响所有dsDNA病毒的基因组复制,目前认为SAMHD1维系核苷酸含量的动态平衡可能是细胞限制各种病毒复制的一般机制。
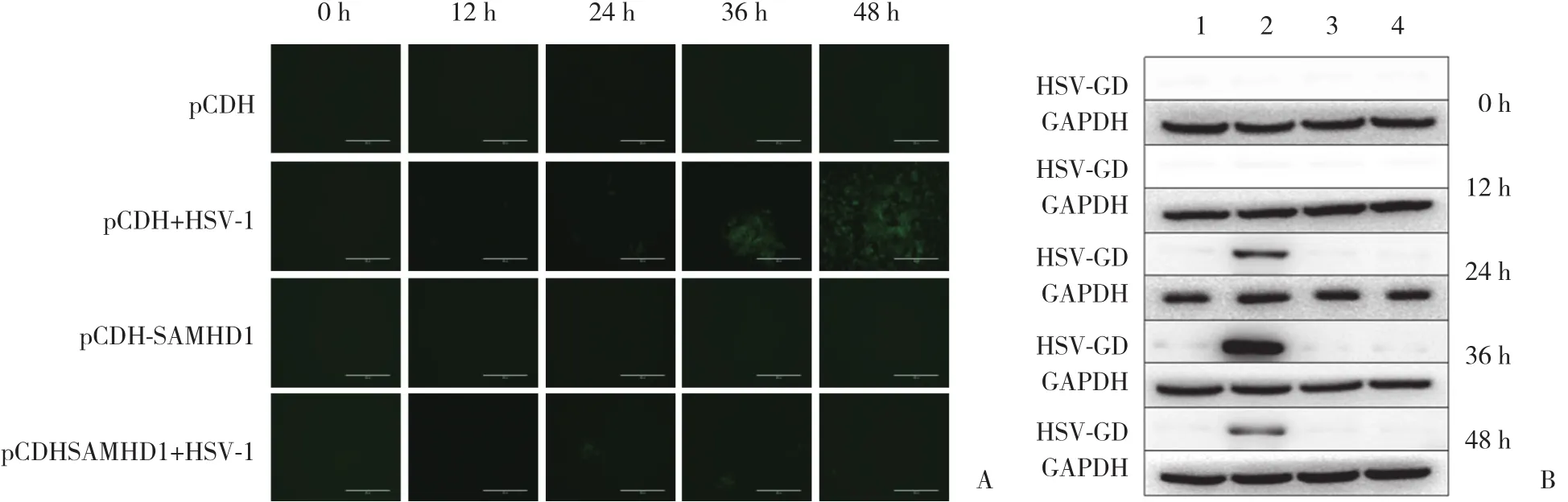
图4 过表达 SAMHD1 细胞系的抗病毒功能评价Fig.4 Evaluation of the antiviral function of the cell line overexpressing SAMHD1 gene
瞬时转染存在表达效率不一致且外源基因表达会随细胞生长繁殖而逐渐降低,无法传到子代,临床研究[20]证明单纯疱疹病毒 (herpes simplex virus,HSV) 是人类最常见的病原体,人是唯一的自然宿主,本研究选择人结肠癌细胞作为工具细胞,通过琼脂糖凝胶实验及测序结果证明重组质粒构建成功。利用慢病毒包装系统建立SAMHD1的稳转细胞株,Western blotting检测结果表明稳定过表达SAMHD1的细胞株构建成功。免疫荧光和Western blotting结果证明稳定过表达SAMHD1可以有效抑制HSV-1在结肠癌细胞系中的复制,且证实本实验所构建的稳定过表达SAMHD1细胞株具有SAMHD1的生物学功能。
SAMHD1具有广泛的抗病毒功能,能够有效抑制DNA病毒HSV-1在结肠癌细胞中的复制。但是SAMHD1是否对其他类型病毒及在其他细胞中有同样的生物学功能,还需进一步探讨。本研究为深入研究SAMHD1蛋白的生物学功能提供实验保障。
