药食两用中药饮片微生物污染现状考察与研究
2019-02-25高新贞王彦厚
高新贞,刘 枕,王 颖,王彦厚
(淄博市食品药品检验研究院,山东 淄博 255086)
中药饮片是介于农产品和药品之间的产品[1],有些品种既是生产中成药的原料,又可经简单处理用于患者,还可作为食品用于日常生活,称为药食两用中药饮片。近年,如枸杞、菊花、黑芝麻、山楂,及价格相对昂贵的阿胶、人参均作为药食两用中药饮片,使用量与日俱增。但这类饮片若被微生物污染,会产生很多不良影响:一方面表现在微生物中的致病菌和条件致病菌对人体健康有直接威胁;另一方面,被微生物污染的药品,其理化性质改变会降低药品的有效性,甚至某些被微生物和酶降解的产物会导致使用者产生不良反应,甚至死亡[2]。另外在实际生活中,大多数服用者对微生物缺乏了解,对服用被微生物污染的饮片后身体产生的不良反应与饮片微生物污染的相关性知之甚少,更无从论证与考察。因此制定合理的饮片微生物检查标准,有效控制其质量,使其真正起到保健养生、食为药用的功能至关重要。为此笔者从医院、药店、超市、农贸市场分别随机购买了27批常用药食两用中药饮片,先按《中国药典》要求进行符合性检验,然后参考《食品卫生微生物学检验》相关国家标准检查需氧菌总数和控制菌,考察饮片的污染现状,为下一步合理制定标准、控制质量提供参考依据。同时通过比较不同来源、不同包装的同品种中药饮片的微生物污染状况,阐述包装、储存、运输的重要性。
1 材料与仪器
1.1 实验样品
分别从医院、药店、超市、农贸市场购买枸杞、薄荷、金银花、蒲公英、菊花共25份散装样品;从超市购买单剂量包装的枸杞、菊花各1份样品,包装标示饮用方法为95 ℃以上热水冲泡3~5 min。以A、B、C、D、E分别表示枸杞、薄荷、金银花、蒲公英、菊花;以阿拉伯数字表示购买来源,分别为1淄博市张店区某药店、2淄博市周村区某超市、3淄博市周村区某医院、4淄博市张店区某农贸市场、5淄博市周村区某农贸市场、6淄博市张店区某超市。
1.2 培养基
胰酪大豆胨液体培养基(批号:1065575);胰酪大豆胨琼脂培养基(批号:3304006);麦康凯琼脂培养基(批号:3303050);紫红胆盐葡萄糖琼脂培养基(批号:3304009);麦康凯液体培养基(批号:3304008);pH 7.0氯化钠-蛋白胨缓冲液(批号:3104094)。上述培养基购自广东环凯微生物科技有限公司,已进行适用性检查,均符合规定。
肠道菌增菌液体培养基(批号:150804);RV沙门菌增菌液体培养基(批号:150914);甘露醇氯化钠琼脂培养基(批号:150806);溴化十六烷基三甲铵琼脂培养基(150801);木糖赖氨酸脱氧胆酸盐琼脂培养基(批号:150916);三糖铁琼脂培养基(批号:151117);MUG培养基(批号:150128)。上述培养基购自北京陆桥技术股份有限公司,已进行适用性检查,均符合规定。
1.3 试剂
沙门菌干制生化鉴定试剂盒(批号:170914);大肠埃希菌干制生化鉴定试剂盒(批号:170712);冻干血浆(批号:171025);色氨酸肉汤(批号:170801)。上述试剂均购自北京陆桥技术股份有限公司。
1.4 菌种及菌液制备
接种铜绿假单胞菌(Pseudomonas aeruginosa)[CMCC(B)10 104]、大肠埃希菌(Escherichia coli)[CMCC(B)44 102]、乙型副伤寒沙门菌(Salmonella paratyphiB)[CMCC(B)50 094]的新鲜培养物至胰酪大豆胨液体培养基,33 ℃培养24 h。取上述新鲜培养物1 ml,用pH 7.0氯化钠-蛋白胨缓冲液10倍稀释至小于100 cfu/ml,备用。上述菌种均由山东省食品药品检验研究院提供。
1.5 仪器
BPX-162电热恒温培养箱(上海博讯);LRHS-150-Ⅱ恒温恒湿培养箱(上海跃进);MJX-250B-Z霉菌培养箱(上海博讯);GHP-9160N隔水式恒温培养箱(上海一恒);YXQ-LS-70A全自动立式压力蒸汽灭菌器(上海博讯);HC-B10001电子天平(慈溪华徐衡器);HR40-ⅡB2生物安全柜(青岛海尔);Vitek2 compact全自动细菌鉴定及药敏分析系统(法国梅里埃);奥林巴斯CX31生物显微镜 (日本奥林巴斯);ZF-2三用紫外仪(上海安亭)。
2 方法与结果
2.1 药典符合性检验
根据《中国药典》2015年版四部[3]通则1106、1107的规定进行试验,考察中药饮片质量是否符合《中国药典》要求。
2.1.1 标准 按照通则1107非无菌药品微生物限度标准表4对研粉口服用贵细饮片、直接口服及泡服饮片的规定,上述饮片可归类为直接泡服的中药饮片,应不得检出沙门菌(10 g);耐胆盐革兰阴性菌应小于104cfu(1 g)。
2.1.2 试验方法 按通则1106非无菌产品微生物限度检查:控制菌检查法进行检查。
2.1.2.1 耐胆盐革兰阴性菌检查 供试液制备和预培养 取供试品10 g,加胰酪大豆胨液体培养基至100 ml,混匀,作为1:10供试液,23 ℃培养2 h,用胰酪大豆胨液体培养基作为稀释剂10倍梯度稀释,分别制成1:100、1:1000和1:10000供试液。
选择和分离培养 取经预培养后的1:10、1:100、1:1000、1:10000供试液各1 ml分别接种至10 ml肠道菌增菌液体培养基中,33 ℃培养24~48 h,上述每一培养物分别划线接种于紫红胆盐葡萄糖琼脂培养基平板上,33 ℃培养18~24 h。
结果判断 若紫红胆盐葡萄糖琼脂培养基平板上有菌落生长,则对应培养管为“+”,否则为“-”。根据各培养管检查结果,从通则1106表2查1 g供试品中含有耐胆盐革兰阴性菌的可能菌数。结果见表1。
由表1可见27批次样品的耐胆盐革兰阴性菌定量试验中,有24批次样品紫红胆盐葡萄糖琼脂培养基平板上无菌落生长,耐胆盐革兰阴性菌小于10 cfu/g;有3批次大于104cfu/g,分别为来源于两家农贸市场的枸杞和一家药店的菊花。

表1 耐胆盐革兰阴性菌检查结果
2.1.2.2 沙门菌检查 供试液制备和增菌培养 取供试品10 g接种至200 ml胰酪大豆胨液体培养基中,混匀,33 ℃培养18~24 h。
选择和分离培养 取上述培养物0.1 ml接种至10 mRV沙门菌增菌液体培养基中,33 ℃培养18~24 h;取少量RV沙门菌增菌液体培养物划线接种于木糖赖氨酸脱氧胆酸盐琼脂培养基(XLD)平板上,33 ℃培养18~48 h;用接种针挑选疑似菌落于三糖铁琼脂培养基高层斜面上进行斜面和高层穿刺接种,33℃培养18~24h,或采用其他适宜方法进一步鉴定。
结果判断 按照通则1106相关要求进行。结果见表2。
由表2可见,27批样品在XLD平板上均有菌落生长,经初步生化鉴定均为非沙门菌。对菌落形态一致的21批样品再次分离纯化,进行仪器鉴定,结果97 %概率为泛菌属。其余6批因试剂不足,未进行进一步鉴定。

表2 沙门菌检查结果
2.2 增项检查
按同类食品要求增加检查项目,并进行质量考察和研究。考虑到药食两用中药饮片常用于制作糕点、饮品、冷食菜等,笔者参考国家标准《食品卫生微生物学检验》中的 GB/T 4789.21-2003[4]、GB/T 4789.23-2003[5]及GB/T 4789.24-2003[6]3个标准,发现冷食菜、糕点、蜜饯、饮料等食品均有菌落总数、大肠菌群、沙门菌、志贺菌、金黄色葡萄球菌、霉菌和酵母菌计数的检验要求。药典已规定了沙门菌、耐胆盐革兰阴性菌检查,考虑到大肠埃希菌为口服制剂必检项目,结合现有试验条件,选择菌落总数、大肠埃希菌和分布广泛的金黄色葡萄球菌3个项目对中药饮片进行检查,并将菌落总数统一到药典术语:需氧菌总数。为模拟药食两用中药饮片在服用时进行沸水冲泡的过程,笔者选取了市场需求量大的枸杞和菊花共计12批次,95 ℃水浴处理10 min前后,分别对其进行需氧菌总数、大肠埃希菌、金黄色葡萄球菌检查。
2.2.1 需氧菌总数计数方法 取样品25 g,加胰酪大豆胨液体培养基225 ml,45 ℃保温振摇混匀,作为1:10供试液。10倍梯度稀释制成1:100、1:1000、1:10000的供试液。参考2.1项结果可见,样品污染较严重,因此样品处理前计数试验从1:100做起,处理后计数试验从1:10做起。采用平皿法中的倾注法,计数结果保留两位有效数字,平板上若无菌落生长,以<1乘以稀释倍数的值报告。结果见表3、表4。
2.2.2 大肠埃希菌检查方法 取1:10供试液10 ml接种至100 ml胰酪大豆胨液体培养基,混匀,33 ℃培养24 h;取上述培养物1 ml接种至100 ml麦康凯液体培养基,43 ℃培养48 h;取麦康凯液体培养物划线接种于麦康凯琼脂培养基平板上,33 ℃培养72 h,选取典型菌落进行分离、纯化、染色镜检。结果见表3、表4。
2.2.3 金黄色葡萄球菌检查方法 取1:10供试液10 ml接种至100 ml胰酪大豆胨液体培养基,33 ℃培养24 h;取上述培养物划线接种于甘露醇氯化钠琼脂培养基平板上,33 ℃培养72 h,选取典型菌落进行分离、纯化、鉴定。结果见表3、表4。
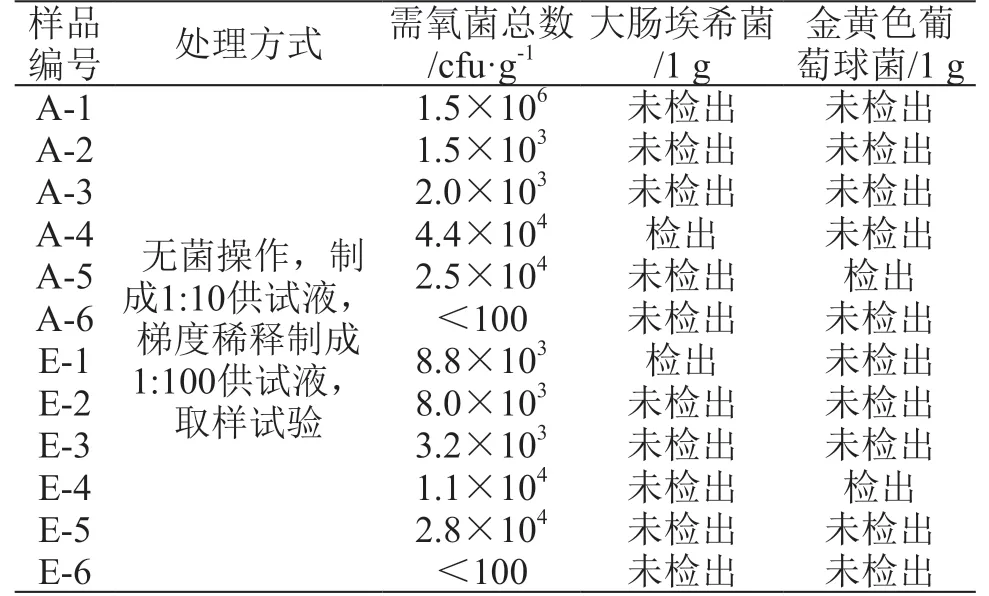
表3 样品处理前需氧菌总数、大肠埃希菌、金黄色葡萄球菌检查结果

表4 样品处理后需氧菌总数、大肠埃希菌、金黄色葡萄球菌检查结果
3 讨论
按《中国药典》2015年版四部[3]通则1106、1107的相关要求进行符合性检验,27批样品中有3批耐胆盐革兰阴性菌超标,不合格率达11.1 %。有文献[7]报道,相对安全的微生物指标,空气中的微生物浓度为1~104cfu/L;水中的微生物浓度为1~104cfu/ml;生活饮用水100 cfu/ml。由表3可见,处理前有1批枸杞达到106cfu/g,2批枸杞、2批菊花接近105cfu/g,均超过上述指标,且接近《美国药典》38版对使用前用沸水处理的植物中需氧菌总数≤105cfu/g限度标准[2]。由此可见,药食两用中药饮片微生物污染现状不容乐观,建议加强对药食两用中药饮片的微生物检验。
27批样品均未检出沙门菌,符合现行药典的相关规定。但在XLD平板上生长的菌落经分离、纯化、鉴定,多为泛菌属。泛菌属为条件致病菌,服用人群不同,如新生儿、婴幼儿及体弱者,致病风险可能不同[3]。1批购自农贸市场的枸杞,样品编号A-4,经处理后在EMB平板上仍有菌落生长,经染色镜检确定为革兰阳性芽孢菌。此类菌耐热性高,尤其对体弱者致病性强,应严格控制。《美国药典》、《欧洲药典》、《日本药局方》中对类似于中国的中药饮片的药品,均规定了需氧菌总数、霉菌和酵母菌总数、大肠埃希菌的检查[2]。因此现行《中国药典》对中药饮品的微生物限度标准不足以排除其潜在风险,建议对中药饮片增加微生物检验项目。
由表4可见,经处理后的样品需氧菌总数大大降低,下降2~4个数量级,仅有3批达到102cfu/g,处于相对安全的水平。另外,样品处理前,2批检出金黄色葡萄球菌,2批检出大肠埃希菌。样品经处理后,均未检出相应控制菌。因此中药饮片在无特殊服用要求时,建议尽量热水泡服或经过其它加热方式处理,能有效杀灭微生物,降低服用风险。
微生物生长的条件是营养、空气、水分等。由结果可见,2批单剂量包装的中药饮片,处理前后,计数平板均无菌落生长;控制菌检查无论是药典规定项目,还是笔者增加的检查项,均未检出。这与此类产品前期经过初步净制,单次用量独立包装,有些还抽真空有关。USP<1112>中介绍了利用水分活度控制药品中微生物生长的一般方法[1],通过对饮片进行适度干燥处理,并采用适宜的包装材料及包装方式等途径控制其水分活度,对防止微生物污染有较大的影响。监管相对较松的农贸市场,饮片大都直接堆放在地上,销售人员不注意卫生,控制菌检出率则相对偏高。建议在生产、储存、运输过程中严格管理,采用有效的包装形式、合适的储存条件,防止微生物的多次污染。
本文试验过程中,仅参考《中国药典》四部[3]进行样品检查,尚未进行方法适用性试验。因此单剂量独立包装样品在计数检验时均无菌落生长,且未检出控制菌,是否与经过防腐处理相关有待考察。
