RNA 干扰成纤维细胞生长因子受体3 基因对卵巢癌细胞增殖凋亡、免疫及NF-κB 信号通路的影响
2019-02-23郑广韩婷婷杨钰
郑广 韩婷婷 杨钰
1齐齐哈尔医学院附属第三医院肿瘤一科(黑龙江齐齐哈尔161002);2齐齐哈尔第二医院妇产科(黑龙江齐齐哈尔161002)
卵巢癌是常见的妇科恶性肿瘤之一,其发病隐匿,发展迅速,大多数患者诊断时已发生转移及扩散,尽管采取手术和化疗,但患者5年的生存率很低[1]。成纤维细胞生长因子受体3(fibroblast growth factor receptor 3,FGFR3)定 位 于 人 类4p16.3,为跨膜酪氨酸激酶受体糖蛋白,近些年的研究显示,在多种肿瘤中FGFR3 出现过度表达,其高表达影响肿瘤的发生发展[2]。目前FGFR3 在卵巢癌中的研究较少,有研究显示,卵巢癌中FGFR3表达上调,通过siRNA 敲减卵巢癌FGFR3 的表达后可抑制癌细胞的增殖[3]。这提示抑制FGFR3 表达可能影响卵巢癌的发生发展。关于FGFR3 对卵巢癌细胞凋亡及机制研究的尚未明确。RNA 干扰技术是一种能特异性的沉默基因表达的技术,作为一种抗癌的方法在研究各种肿瘤中被广泛的应用[4]。本研究通过RNA 干扰技术沉默卵巢癌SKOV-3 细胞FGFR3 表达,将干扰FGFR3 表达的siRNA 转染SK-OV-3 细胞,检测细胞的活力、凋亡率及免疫逃逸相关基因B7-H1 表达,并进一步研究可能的分子机制,为卵巢癌的诊疗提供理论帮助。
1 材料与方法
1.1 细胞及主要试剂和仪器 人卵巢癌SK-OV-3细胞株购自上海细胞所;RPMI1640 培养基、双抗、胎牛血清及胰蛋白酶均购自美国Gibco;FGFR3、B7-H1、p-NF-κB、p-IκB、cyclinD1、survivin 抗体均购自美国Abcam;脂质体LipofectamineTM2000 购自美国Invitrogen;bradford 蛋白定量试剂盒购自北京百泰克生物;CCK8 购自日本同仁研究所;Annexin V-FITC/PI 细胞凋亡试剂盒购自南京凯基;酶标仪购自美国Bio-TEK;FACSar 流式细胞仪购自美国BD。
1.2 细胞培养及siRNA 转染 SK-OV-3 细胞在5%体积分数的CO2培养箱中用RPMI1640 完全培养液(含有10%小牛血清及双抗)中37 ℃传代培养。取生长至对数期的SK-OV-3 细胞,以每孔1×105个细胞接种至6 孔细胞培养板,细胞达70%生长融合时,更换培养液(不含有血清和抗生素),参照脂质体LipofectamineTM2000 转染说明进行转染,将合成的无干扰作用的siRNA(阴性对照组,NC组)和合成的靶向抑制FGFR3 的siRNA(si-FGFR3组)转染SK-OV-3 细胞,并设置对照组(Control 组,加入脂质体),培养箱内孵育5~6 h,更换培养液(含有血清不含抗生素),继续培养48 h 收集细胞及蛋白裂解液,用于实验。siRNA 设计合成均委托广州锐博生物完成。FGFR3 的siRNA 序列,sense 5′-CGACAAGGAGCTAGAGGTT-3′,antisense 5′-AACCTCTAGCTCCTTGTCG-3′,阴性对照组siRNA 序列,sense 5′-ACAACTGCCTGGTTGGCAA-3′,antisense 5′-TTGCCAACCAGGCAGTTGT-3′。
1.3 Western blot 检测 胰酶消化细胞,预冷的PBS 洗涤细胞,加入适量的RIPA 裂解液,4 ℃超声粉粹后,离心,收集上清,上清即为提取的全细胞蛋白,Bradford 法对蛋白进行定量。取蛋白50 μg按比例与2×SDS loading buffer 混匀,于100 ℃煮沸变性5 min,每泳道上样50 μg 变性蛋白,经12%的SDS-PAGE 电泳分离,电泳结束后电转移胶至NC膜,室温条件5%脱脂奶粉封闭膜1 h,洗膜,加入稀释好的FGFR3、B7-H1、p-NF-κB(S536)、p-IκB(S36)、cyclinD1、survivin 和内参GAPDH 抗体(按照1∶500~1 000 稀释),4 ℃摇床孵育过夜,洗膜,加入HRP 标记的二抗,室温孵育2 h,ECL 显色液避光显色,凝胶图象分析系统进行吸光度扫描,凝胶自动分析软件进行分析。以p-NF-κB 以NF-κB 为内参、p-IκB 以IκB 为内参,FGFR3、B7-H1、p-NFκB、p-IκB、cyclinD1、survivin 以内参GAPDH 为内参,以目的蛋白与内参蛋白的吸光度比值作为各蛋白的相对表达量。
1.4 细胞活力CCK8 法检测 取对数期的SK-OV-3 细胞,以每孔5 × 103个细胞接种于6 孔板,每孔中加入2 mL,培养箱内常规培养24 h,以进行同步化处理,参照1.2 方法将NC 组和si-FGFR3 组转染细胞,并设置空白对照组及空白对照孔,每组设置5 个重复孔,在转染的24、48 和72 h 每孔中加入CCK8 10 μL,以空白对照孔调零,酶标仪测定吸光度值(OD值,570 nm)。实验重复3 次。
1.5 细胞凋亡AnnexinV-FITC 和PI 双染法检测 胰酶消化按照1.2 分组转染48 h 的各组细胞,收集1 × 106个细胞,制备成单细胞悬液,PBS 洗涤,离心,在沉淀中加入500 μL 的Binding buffer 悬浮细胞,混匀后分别加入AnnexinV-FITC 和PI 各5 μL,4 ℃避光放置10~15 min,上机,行流式细胞术检测。实验重复3 次。
1.6 统计学方法 所有实验数据采用SPSS 21.0软件进行分析,计量资料用表示,多组差异比较采用单因素方差分析,两两比较采用LSD-t检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 si-FGFR3 转染SK-OV-3 细胞效果 对照组、NC 组和si-FGFR3 组FGFR3 的蛋白表达分别为(0.271 ± 0.035)、(0.289 ± 0.036)、(0.081 ± 0.010),与对照组比较,si-FGFR3 组FGFR3 的表达显著降低(P<0.05),而在NC 组的表达无显著变化(P>0.05)。见图1。
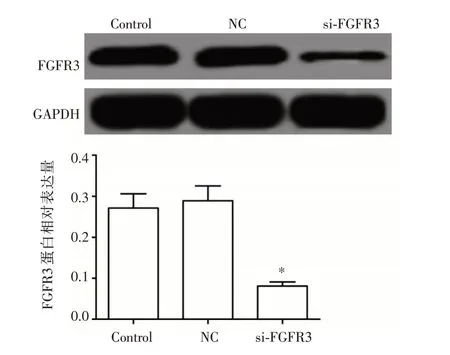
图1 质粒转染SK-OV-3 细胞后细胞中FGFR3 的蛋白表达Fig.1 Protein expression of FGFR3 in cells after transfecting SK-OV-3 cells with si-FGFR3
2.2 si-FGFR3 转染降低SK-OV-3 细胞活力如表1所示,与NC 组比较,si-FGFR3 组在3 个时间点的细胞活力均显著降低(P<0.05)。
2.3 si-FGFR3 转染促进SK-OV-3 细胞凋亡对照组、NC 组和si-FGFR3 组的细胞凋亡率分别为(2.34±0.46)%、(2.51±0.47)%、(16.88±0.99)%,与NC 组比较,si-FGFR3 组的细胞凋亡率显著升高(P<0.05)。见图2。
表1 si-FGFR3 转染降低SK-OV-3 细胞活力Tab.1 si-FGFR3 transfection reduces the activity of SK-OV-3 cells ±s
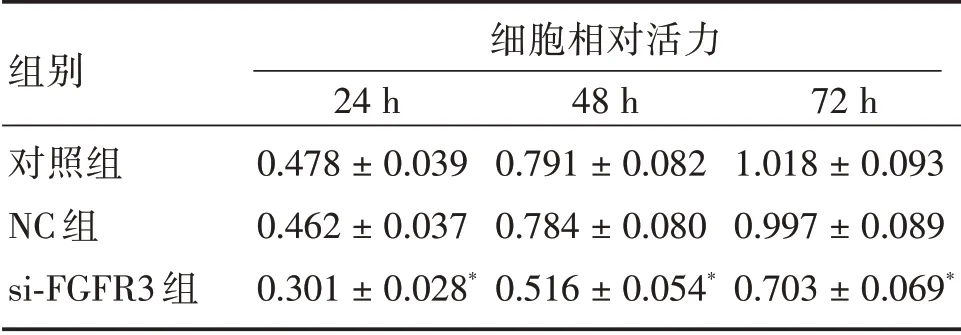
表1 si-FGFR3 转染降低SK-OV-3 细胞活力Tab.1 si-FGFR3 transfection reduces the activity of SK-OV-3 cells ±s
注:与NC 组比较,*P <0.05
组别对照组NC 组si-FGFR3 组细胞相对活力24 h 0.478±0.039 0.462±0.037 0.301±0.028*48 h 0.791±0.082 0.784±0.080 0.516±0.054*72 h 1.018±0.093 0.997±0.089 0.703±0.069*
2.4 si-FGFR3 转染降低SK-OV-3 细胞B7-H1 表达 对照组、NC 组和si-FGFR3 组B7-H1 的蛋白表达分别为(0.351 ± 0.039)、(0.366 ± 0.042)、(0.123± 0.015),与NC 组比较,si-FGFR3 组B7-H1 的蛋白表达显著降低(P<0.05)。见图3。
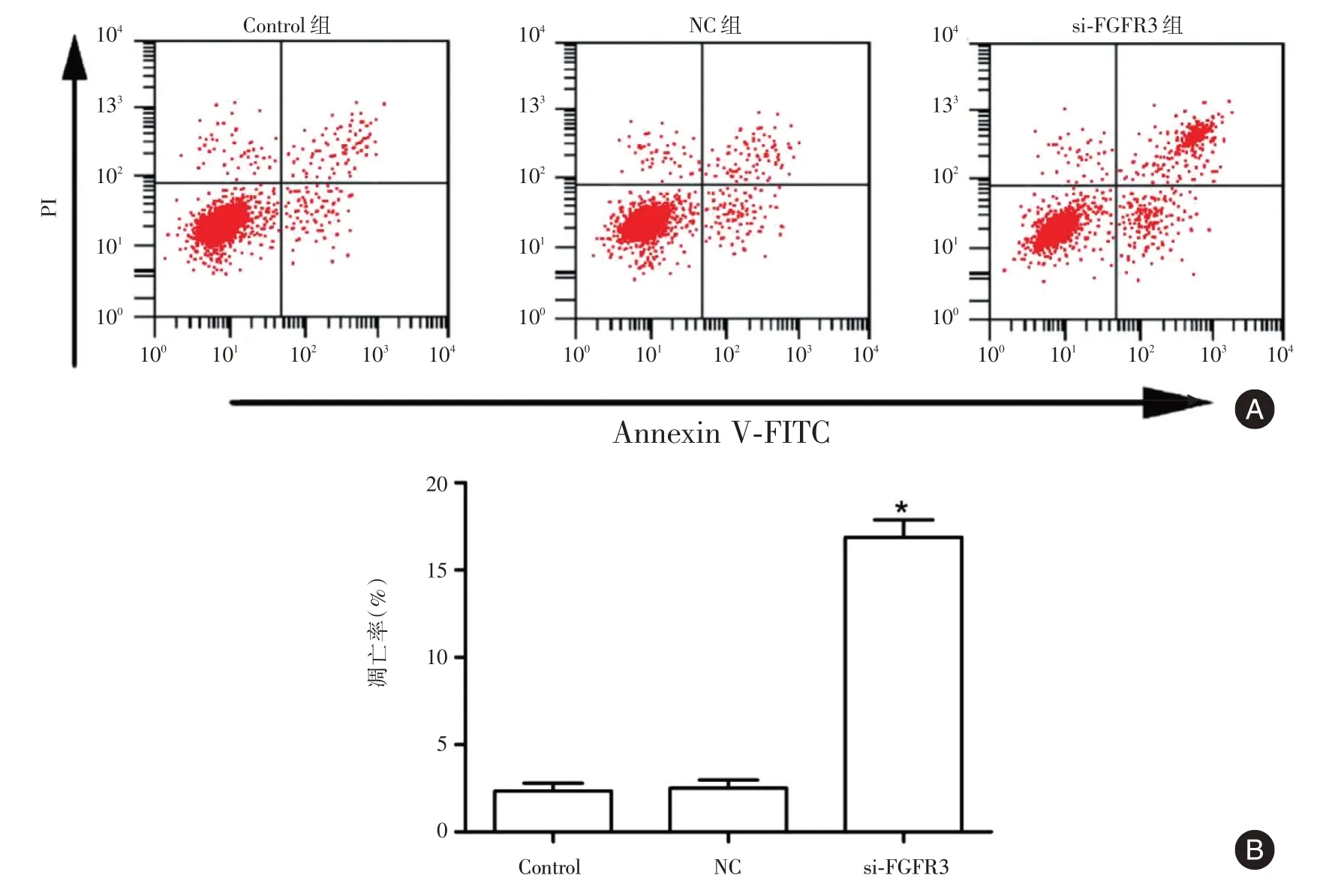
图2 si-FGFR3 转染促进SK-OV-3 细胞凋亡Fig.2 si-FGFR3 transfection promotes apoptosis of SK-OV-3 cells
2.5 si-FGFR3 转染下调SK-OV-3 细胞NF-κB 信号 对照组、NC 组和si-FGFR3 组p-NF-κB 的蛋白表 达 分 别 为(0.142 ± 0.015)、(0.158 ± 0.017)、(0.034 ± 0.006),p-IκB 的蛋白表达分别为(0.047± 0.008)、(0.062 ± 0.009)、(0.123 ± 0.014),cyclinD1 的蛋白表达分别为(0.766 ± 0.069)、(0.771± 0.067)、(0.326 ± 0.042),survivin 的蛋白表达分别 为(0.263 ± 0.026)、(0.272 ± 0.028)、(0.153 ±0.020),与NC 组比较,si-FGFR3 组p-NF-κB、cyclinD1 和survivin 的表达均显著降低(P<0.05),p-IκB 的表达显著升高(P<0.05)。见图4。
3 讨论
FGFR 家族为跨膜酪氨酸激酶受体糖蛋白,FGFR3 属于FGFR 家族,定位于人类4p16.3,多种肿瘤中FGFR3 出现异常表达,其表达异常可引起所介导的途径发生异常,引起细胞分裂异常,进而可能促进肿瘤的发生发展[5]。而有研究显示,抑制FGFR3 表达可能降低肿瘤的发展进程。如多发性骨髓瘤中抑制FGFR3 表达可诱导细胞的凋亡[6];胃癌中抑制FGFR3 表达可降低癌细胞增殖及促进凋亡,并可增加顺铂的化疗敏感性[7]。FGFR3对卵巢癌的影响目前研究的较少。有研究发现FGFR3 在卵巢癌中表达上调,抑制FGFR3 表达可降低癌细胞增殖,敲减FGFR3 表达可降低卵巢透明细胞癌的增殖和迁移[3,8]。但FGFR3 对卵巢癌细胞凋亡及机制研究的尚未清楚。
RNA 干扰是一种能降解特定基因mRNA 的细胞反应过程,目前该技术已被广泛的应用于癌基因的研究,并取得了对癌基因的RNA 干扰,这为基因功能研究及肿瘤的防治提供了新的思路及方法[9]。本研究中将合成的干扰FGFR3 表达的siRNA 转染卵巢癌细胞,细胞中FGFR3 的表达明显降低,且可有效降低癌细胞的活力及促进细胞的凋亡。B7-H1 是B7 家族中的一员,是一种重要的负性协同刺激分子,可介导肿瘤发生免疫逃逸[10]。有研究显示,卵巢癌细胞B7-H1 出现高表达,但引起其升高的机制还未完全清楚,在卵巢癌细胞与巨噬细胞非接触共培养后,可发现两种细胞B7-H1 表达较非培养组均明显升高,而抑制NF-κB 等信号通路后B7-H1 表达被抑制[11]。作为信号传导途径中的枢纽,NF-κB 与免疫、细胞凋亡调节及肿瘤发生发展等存在密切联系,因此在治疗肿瘤中NF-κB 可能是一个新的靶点。NF-κB 的活化是一个复杂过程,当结合NF-κB 的多个位点受到活化因素刺激后,NF-κB 被激活,IκB 发生磷酸化,磷酸化的IκB 与NF-κB 分离,NF-κB 快速入核而后行使转录因子功能,诱导一些靶基因的表达,如cyclinD1、survivin 等[12]。有研究显示,阻断NF-κB 的活化可明显抑制卵巢癌细胞增殖[13]。本研究检测磷酸化的NF-κB 和IκB 及靶基因cyclinD1 和survivin 的表达,发现抑制FGFR3 表达后卵巢癌细胞中p-NF-κB、cyclinD1 和survivin 的表达均明显降低,p-IκB 表达升高,这提示FGFR3 可通过下调NF-κB 信号影响卵巢癌的发生发展。
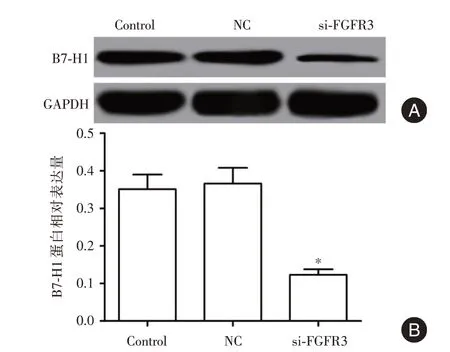
图3 si-FGFR3 转染对SK-OV-3 细胞B7-H1 表达的影响Fig.3 Effect of si-FGFR3 transfection on the expression of B7-H1 in SK-OV-3 cells
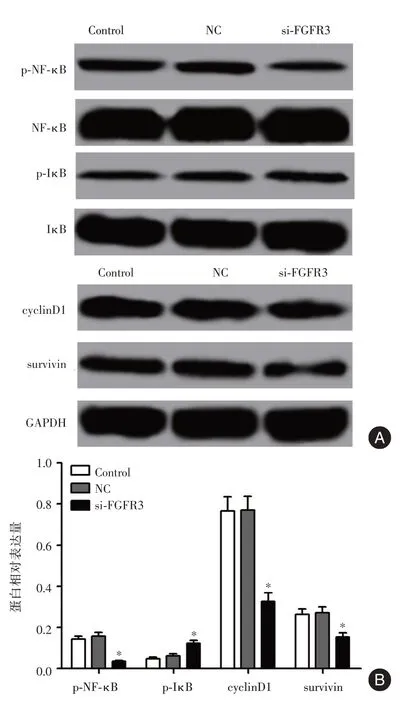
图4 si-FGFR3 转染对SK-OV-3 细胞NF-κB 信号的影响Fig.4 Effect of si-FGFR3 transfection on NF-κB signal in SK-OV-3 cells
综上所述,通过RNA 干扰抑制卵巢癌细胞中FGFR3 表达可降低癌细胞活力,诱导细胞凋亡,下调免疫逃逸相关基因B7-H1 表达,其机制可能与下调NF-κB 信号通路有关。该研究提示FGFR3 可能是卵巢癌诊疗的新的靶点,但本研究内容有限,且仅在细胞水平的研究,还需更多实验作为依据。
