SNAP25基因多态性对氨磺必利治疗精神分裂症PANSS评分的影响
2019-02-23峰邹
曹 峰邹 莹
尽管目前抗精神分裂症药物的副作用已经大大减少,但是许多精神分裂症患者的治疗效果仍然难以令人满意[1],导致患者的症状加重出现功能障碍等严重后果。抗精神分裂症药物的临床疗效可能因个体差异而产生不同,因此药物遗传学研究对于精神分裂症的的治疗显得尤为重要[2]。Muller等[3]报道突触相关蛋白25kDa(synaptosomal associated protein of 25KD,SNAP25)基因与抗精神病药物反应相关,发现rs8636位点基因多态性与高加索人精神分裂症患者药物治疗反应有关。Dai等[4]研究显示,SNAP25基因rs3746544位点单核苷酸多态性与精神分裂症患者患病风险相关。本研究采用病例对照研究的方法分析SNAP25基因rs8636位点和rs3746544位点单核苷酸多态性与精神分裂症易感性和氨磺必利治疗精神分裂症患者PANSS评分的影响,报道如下。
1 临床资料
1.1 一般资料 选择2014年5月—2017年8月期间浙江省绍兴第七人民医院收治的精神分裂症患者150例作为研究对象,招募145名健康的体检者作为对照组。本研究获得医院医学伦理委员会的审核通过,所有受试者均签署知情同意书。
1.2 纳入与排除标准 纳入标准:(1)符合国际疾病分类 10(international Classification of diseases,ICD-10)[5]精神分裂症的诊断标准;(2)年龄 18~55 岁;(3)阳性与阴性症状量表(PANSS)总分≥70分,阳性症状≤22 分,阴性症状≥40 分,P1、P3、P6、G9 四项≥4分不超过2项,任一项评分均≤5分[6]。排除标准:(1)有过两种或多种抗精神病药治疗的耐药性精神分裂症患者;(2)不能配合完成本次研究的患者;(3)有比较严重的暴力倾向和自杀倾向的患者;(4)1个月内服用氯氮平治疗者;(5)处于妊娠期或哺乳期的患者;(6)有药物过敏史的患者。
2 方法
2.1 检测SNAP25基因rs8636位点和rs3746544位点基因型 取所有受试者肘静脉血5mL,采用Qiagen全血基因组DNA提取试剂盒(货号:61104,Qiagen,德国)提取基因组DNA,采用特异性引物扩增SNAP25基因rs8636位点和rs3746544位点目的片段,其中rs8636位点聚合酶链式反应(PCR)扩增引物序列为上游:5’-AGGGTTTGTTTGCTGCTTTTGA-3’,下游:5’-ACATCCACACTGTTTCACAGC-3’。rs3746544位点PCR扩增引物序列为上游:5’-CTCTTGTTTTC AGGTTGGCTCC-3’,下游:5’-AGGGATAGCCCACTTACCCA-3’。PCR反应体系:10ng DNA模板,上下游引物各 10pmol,Taq DNA 聚合酶 0.25U,1×的 buffer,10mM dNTP,补水至20μL。PCR反应条件:预变性95℃,5min;94℃,30s;60℃,30s,72℃,30s;30 个循环后 72℃延伸 5min,4℃保存。PCR产物纯化后采用Sanger测序的方法检测SNAP25基因rs8636位点和rs3746544位点基因型,见图1。
2.2 治疗方法 所有精神分裂症患者均采用氨磺必利(规格:0.2g,批号 20140524001,齐鲁制药有限公司)治疗,以阳性症状为主者口服氨磺必利400~1200mg/d,以阴性症状为主口服氨磺必利50~300mg/d。根据患者的耐受情况和病情,适当调整剂量,氨磺必利片≤400mg/d则一次服用完;若>400mg/d,则分为2次服用,疗程8周。治疗期间不与其他抗精神病药物合用。治疗过程中出现失眠的患者可以使用苯二氮卓类药物治疗,如果出现锥体外系反应(EPS)可以采用苯海索片治疗,记录患者出现的不良反应。
2.3 评价指标 治疗前和治疗8周后采用PANSS[7]对患者的精神状况进行评价,包含阳性症状、阴性症状、一般精神病理症状、总分等指标。
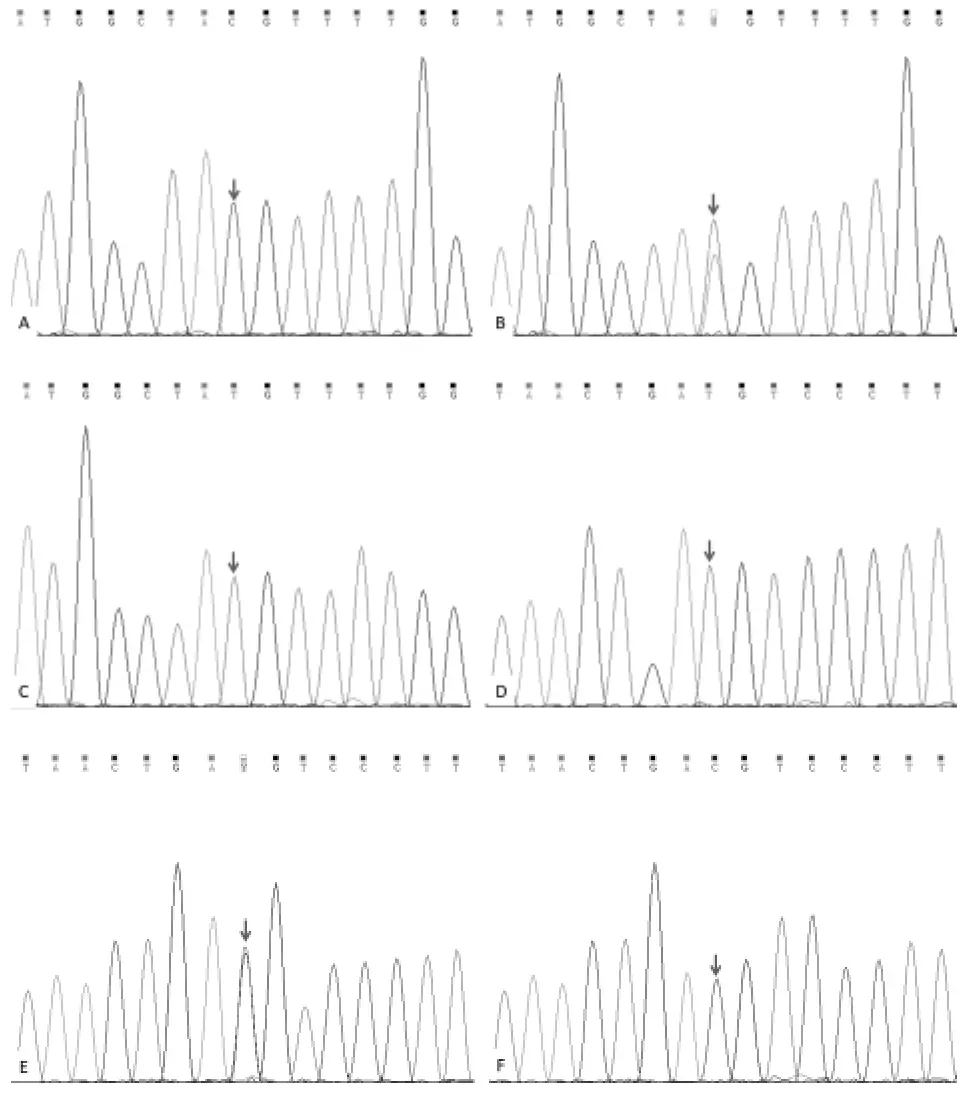
图1 Sanger测序结果
2.4 统计学方法 应用SPSS20.0统计软件,计量资料以均数±标准差(±s)表示,多组间均数比较采用单因素方差分析,两组间比较采用t检验,计数资料以[例(%)]表示,采用 χ2检验。计算等位基因频率的OR(odds ratio,比值比)值和 95%CI(Confidence interval,置信区间)。Hardy-Weinberg 平衡采用 χ2检验。使用多元Logistic回归分析精神分裂症易感性,采用Bonferroni法对年龄、性别、BMI等因素进行校正,P<0.05表示差异有统计学意义。
3 结果
3.1 研究组和对照组一般资料比较 研究组男87例,女 63例,年龄 18~52岁,平均(37.8±8.9)岁;体质指数(BMI)(22.3±2.4)kg/m2。对照组男 85 名,女 60名,年龄18~50岁,平均(38.2±9.1)岁;BMI(21.9±2.7)kg/m2。两组年龄、性别、BMI等一般资料比较,差异无统计学意义(P>0.05),具有可比性。
3.2 研究组和对照组SNAP25基因SNP位点基因型频率 SNAP25基因rs8636位点和rs363032位点基因型频率符合Hardy-Weinberg平衡(P>0.05)。研究组患者SNAP25基因rs8636位点TT基因型频率显著高于对照组,差异有统计学意义(P<0.05)。rs8636位点突变型等位基因T是精神分裂症的危险因素(校正比值比(OR)=1.21,95%置信区间(CI)=1.02~1.43,P=0.03)。研究组患者的 SNAP25 基因rs363032位点突变基因型(TC和CC)频率显著高于对照组,差异有统计学意义(P<0.05)。SNAP25基因rs363032位点突变型等位基因C是精神分裂症的危险因素(校正 OR=1.60,95%CI=1.35~1.83,P<0.001),见表1。
3.3 SNAP25基因SNP与精神分裂症患者一般资料比较 SNAP25基因rs8636位点和rs363032位点不同基因型精神分裂症患者的年龄、性别、BMI等一般资料之间的差异无统计学意义(P>0.05)。SNAP25基因rs8636位点和rs363032位点野生型、杂合型、突变纯合型患者治疗消耗的氨磺必利的剂量依次上升,差异有统计学意义(P<0.05),见表 2。

表1 研究组和对照组SNAP25基因SNP位点基因型频率比较[例(%)]
表2 SNAP25基因rs8636位点和rs363032位点不同基因型精神分裂症患者一般资料比较(±s)
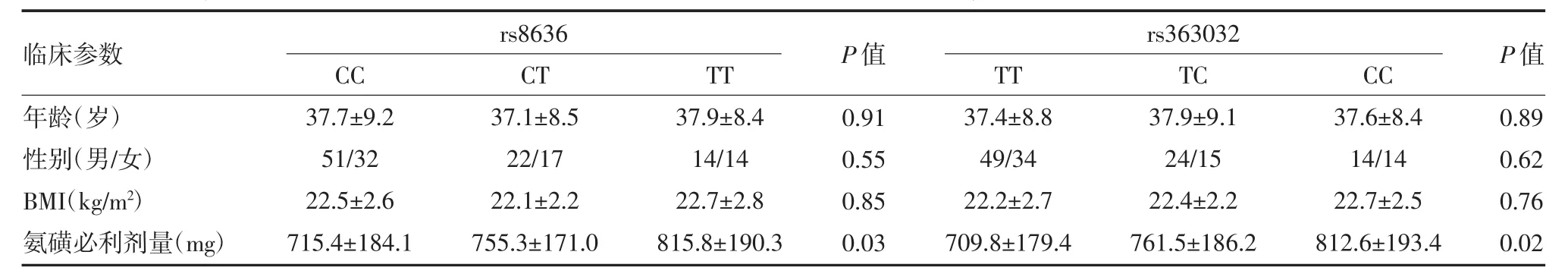
表2 SNAP25基因rs8636位点和rs363032位点不同基因型精神分裂症患者一般资料比较(±s)
注:SNAP25:突触相关蛋白 25kDa;BMI:体质量指数
临床参数年龄(岁)性别(男/女)BMI(kg/m2)氨磺必利剂量(mg)CC 37.7±9.2 51/32 22.5±2.6 715.4±184.1 rs8636 rs363032 CT 37.1±8.5 22/17 22.1±2.2 755.3±171.0 TT 37.9±8.4 14/14 22.7±2.8 815.8±190.3 P值0.91 0.55 0.85 0.03 TT 37.4±8.8 49/34 22.2±2.7 709.8±179.4 TC 37.9±9.1 24/15 22.4±2.2 761.5±186.2 CC 37.6±8.4 14/14 22.7±2.5 812.6±193.4 P值0.89 0.62 0.76 0.02
表3 精神分裂症患者SNAP25基因SNP与PANSS评分比较(分,±s)

表3 精神分裂症患者SNAP25基因SNP与PANSS评分比较(分,±s)
注:与治疗前同基因型比较,*P<0.05;SNAP25:突触相关蛋白25kDa;PANSS:阳性与阴性症状量表
基因型rs8636 CC CT TT F值P值rs363032 TT TC CC F值P值PANSS总分 阳性症状 阴性症状 一般病理症状治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后88.7±19.8 88.0±20.7 89.7±21.7 0.41 0.81 51.1±9.5*49.5±10.1*49.0±9.8*0.51 0.77 23.8±7.2 23.4±7.8 24.1±8.1 0.38 0.84 15.8±5.8*15.5±6.1*15.7±5.7*0.10 0.94 20.5±7.1 20.3±6.4 21.1±8.1 0.63 0.58 14.8±6.5*14.2±7.9*14.4±7.7*0.35 0.87 44.2±11.5 44.3±12.3 44.5±13.4 0.38 0.84 20.4±8.5*19.8±8.9*18.9±9.0*0.52 0.76 88.0±19.2 88.5±20.3 89.4±21.4 0.53 0.75 52.4±9.1*49.1±9.5*48.7±10.3*0.56 0.71 23.4±7.5 23.5±7.7 24.3±7.9 0.58 0.69 15.4±6.2*15.1±5.9*16.0±6.1*0.35 0.87 20.8±6.9 21.4±8.0 21.3±7.7 0.59 0.65 14.2±6.7*14.6±7.4*14.2±7.1*0.41 0.81 44.1±12.3 44.0±11.8 44.8±12.5 0.49 0.79 20.8±8.9*19.4±8.1*18.5±9.4*0.58 0.69
3.4 SNAP25基因SNP与PANSS评分的相关性 治疗后所有精神分裂症患者的PANSS总分、阳性症状评分、阴性症状评分、一般病理症状评分均显著降低,差异有统计学意义(P<0.05)。治疗前与治疗后SNAP25基因rs8636位点和rs363032位点不同基因型之间的PANSS总分、阳性症状评分、阴性症状评分、一般病理症状评分之间的差异无统计学意义(P>0.05),见表 3。
3.5 不良反应 治疗过程中出现的不良反应主要有失眠 15例(10.0%),头痛 10例(6.7%),焦虑 3例(2.0%),EPS35例(23.3%),催乳素升高 32例(21.3%)。SNAP25基因rs8636位点和rs363032位点不同基因型精神分裂症患者的不良反应情况比较,差异均无统计学意义(P>0.05),见表4。
4 讨论
氨磺必利是一种新型的抗精神病药物,选择性阻断多巴胺能D2和D3受体,在低剂量时能够显著改善患者的阴性症状,当使用剂量较高时能够改善患者的阳性症状[8-10]。低剂量(<10mg/kg)的氨磺必利对突触前D2/D3受体的亲和力较强,突触前抑制消除,进入间隙的多巴胺增加后额前皮质的多巴胺性能传递提升,使患者的阴性症状显著改善[11-12]。然而在实际临床工作中往往出现个体差异而导致治疗效果的不同,这可能与遗传因素的不同有关。陈颖等[13]研究显示,多巴胺D1受体基因多态性与氯氮平治疗精神分裂症患者的疗效有关。欧阳后先等[14]研究显示,α1B-肾上腺素受体基因多态性与精神分裂症奥氮平临床治疗效果具有相关性。由此可知,遗传因素对精神分裂症患者的治疗效果具有非常重要的影响。

表4 精神分裂症患者SNAP25基因SNP不良反应比较(例)
SNAP25基因位于人20p12-p11.2染色体上,该基因大小为88.59kbp,包含8个外显子和7个内含子。SNAP25是神经递质释放所必需的一种突触前胞膜蛋白,在脑神经元中高度表达,是SNA受体(SNARE)复合体的核心结构,在突触的可塑性中发挥重要作用[15-16]。SNAP25基因变异种类较多,刘云升等[17]研究显示,SNAP-25基因多态位点rs3746544与中国儿童注意缺陷多动障碍(ADHD)的发病有关,但未发现rs8636位点单核苷酸多态性与ADHD之间的相关性。本研究结果显示,精神分裂症患者与健康者SNAP25基因rs8636位点和rs363032位点基因型频率之间的差异有统计学意义(P<0.05),突变型人群更容易患精神分裂症。rs8636位点位于SNAP25基因3’UTR,而rs363032位点位于SNAP25基因5’UTR,这两个位点SNP不影响SNAP25蛋白的氨基酸序列,但是属于SNAP25基因的调控区域,突变可能改变了SNAP25蛋白的表达水平。从本研究结果中可以看出,治疗后达到相同PANSS评分标准,突变型精神分裂症患者需要的氨磺必利剂量较大,且不影响治疗副反应,说明SNAP25基因rs8636位点和rs363032位点单核苷酸多态性影响SNAP25蛋白的表达水平进而影响氨磺必利对精神分裂症患者的临床疗效,具体机制还需要进一步研究。研究不足之处,首先,药物遗传学研究的受试者样本量相对较小;其次,根据各种遗传模型和混杂因素进行多重测试,如疾病持续时间、基线症状严重程度、抗精神病药物剂量和既往用药效果等可能导致偏倚。因此本研究也可能产生假阳性。
综上所述,SNAP25基因rs8636位点和rs363032位点单核苷酸多态性与精神分裂症易感性有关,这种单核苷酸多态性可能影响氨磺必利的治疗效果,为了避免假阳性对结果产生的影响,还需要进一步扩大样本量进行研究。
