Box-Behnken响应面法优化索拉非尼PLGA-TPGS聚合物纳米粒的处方与工艺
2019-02-22黄宇哲桂双英储晓琴
黄宇哲,桂双英, 2, 储晓琴, 2
(1.安徽中医药大学药学院,安徽 合肥 230012;2.安徽省中医药科学院药物制剂研究所,安徽 合肥 230012)
索拉非尼是一种新型小分子多靶点、多激酶抑制剂[1],可直接阻断RAF/MEK/ERK介导的细胞信号传导通路而抑制肿瘤细胞增殖[2-3],对肝癌、肺癌、非小细胞癌等多种实体瘤疗效确切[4-5],尤其可显著延长晚期肝癌患者总生存期。索拉非尼难溶于水,临床将其制成甲苯磺酸盐口服给药,但仍存在生物利用度低、临床剂量大、不良反应多等缺点,因而开发索拉非尼新剂型,提高靶向性、降低不良反应成为目前研究者面临的共同挑战[6]。
聚合物纳米粒(polymer nanoparticles, PNP)作为一种新型药物载体,具有增加药物溶解度,延缓药物释放时间,提高药物稳定性和靶向性等优势[7]。PNP经静脉注射入血后能够将包覆的药物浓集于肝、脾等部位,同时降低药物在其他组织中的分布。纳米粒(nanoparticles, NPs)的靶向性通常受粒径的大小和表面电荷分布影响,因此控制这两种因素能够使NPs在给药部位起到更好的靶向作用。选择合适的载体材料是制备NPs的重要因素之一,常用的PNP材料有聚乳酸-羟基乙酸共聚物[poly(lactic-co-glycolic acid),PLGA]、聚乳酸(polylactic acid,PLA)、聚氰基丙烯酸烷酯(polyalkylcya-nocraylate,PACA)等。研究报道,GAO等[8]、LIN等[9]应用PLGA为载体材料制备索拉非尼聚乙二醇(polyethylene glycol,PEG)-PLGA NPs(PEG-PLGA NPs)聚合物,与游离药物相比,负载PEG-PLGA NPs半衰期增加9倍,药时曲线面积增加24倍,显著延长索拉非尼在体内的循环时间,增强索拉非尼抗肿瘤效果。维生素E-聚乙二醇1000琥珀酸酯(D-ɑ-tocopheryl polyethylene glycol 1000 succinate, TPGS)是由维生素E琥珀酸酯(vitamin E succinate, VES)中羧基与聚乙二醇1000(polyethylene glycol 1000, PEG1000)中羟基酯化形成的维生素E水溶性衍生物[10],可通过抑制p-gp的外排,改善膜的渗透性,增加药物的蓄积,提高药物疗效。WIN等[11]制备出TPGS乳化的负载紫杉醇PLGA NPs,其在大鼠体内48 h药时曲线下面积是紫杉醇溶液剂的4.9倍,且NPs在体内的作用时间明显延长。
本实验在确定PLGA为内核的基础上,采用TPGS作为乳化剂进行包裹,采用超声乳化-溶剂挥发法以期制备出新型索拉非尼PLGA-TPGS NPs聚合物[12]。通过Box-Behnken 响应面法优化处方,以期能够制备出提高索拉非尼水溶性、粒径合适、包载量高以及体外释放理想的NPs,并对所制备出的NPs进行表征,为后期索拉非尼PLGA-TPGS NPs的体内实验提供依据。制备出的NPs与临床现有片剂甲苯磺酸盐相比,期望能够提高生物利用度,降低给药剂量,减少不良反应,并且可通过控制粒径和表面电荷等因素主动靶向至肿瘤部位。
1 仪器与材料
LC-20ADXR高效液相色谱仪:日本岛津仪器有限公司;Zetasizer 3000HS激光粒度仪:英国Malvern公司;JEOL-2010高分辨透射电子显微镜:日本电子;92-IIN细胞破碎仪:宁波新芝生物科技有限公司;ZD-88B恒温摇床:江苏省太仓市博莱特实验仪器厂;UV757CRT紫外可见光分光光度计:上海精密科学仪器有限公司;Centrifuge 5430R台式超速离心机:美国Eppendorf公司;AB135-S电子天平:瑞士Mettler Toledo公司;85-2恒温磁力搅拌器:江苏省常州普天仪器制造有限公司;KQ-100DA数控超声波清洗器:江苏省昆山市超声仪器有限公司;XW-80A涡旋混合器:上海精科实业有限公司;Milli-Q一体式超纯水机:美国Milipore公司。
PLGA(50∶50,分子量30 000):济南岱罡生物工程有限公司;TPGS(批号Y21A8D41711)、索拉非尼(批号 284461-73-0,纯度>99%):上海源叶生物科技有限公司;甲醇、乙腈为色谱纯,其他试剂均为分析纯。
2 方法与结果
2.1 聚合物NPs的制备 按照文献[12]方法制备聚合物NPs。精密称取一定量索拉非尼,以1 mL DMSO溶解作为内水相;精密称取一定量PLGA,以5 mL丙酮涡旋溶解作为有机相;将内水相与有机相混合,冰浴中超声破碎形成初乳(W/O);将初乳使用注射器逐滴加入一定浓度乳化剂TPGS的溶液中,形成复乳(W/O/W),冰浴下磁力搅拌一定时间,挥发有机试剂;低温超速离心(12 000 r/min, 20 min, 4 ℃),用去离子水洗涤3次,制得索拉非尼PLGA-TPGS NPs。
2.2 含量测定方法
2.2.1 样品溶液配制
(1)供试品溶液配制 精密吸取索拉非尼纳米混悬液2 mL,置10 mL量瓶中,乙腈超声破乳,并用流动相定容至刻度,摇匀,即得。
(2)阴性样品溶液配制 精密吸取空白纳米混悬液2 mL,置10 mL量瓶中,乙腈超声破乳,并用流动相定容至刻度,摇匀,即得。
(3)对照品溶液配制 精密称取索拉非尼对照品10.0 mg,置50 mL量瓶中,乙腈超声破乳,并用流动相定容至刻度,摇匀,即得。
2.2.2 检测波长选择 取索拉非尼对照品溶液适量,于200~400 nm波长处进行紫外扫描,结果在266 nm处有最大吸收峰,而辅料在此无吸收,因此选择检测波长为266 nm。
2.2.3 色谱及检测条件 按照文献[13]的色谱条件进行检测。色谱柱:Kromasil C18柱(250 mm×4.6 mm,5 μm);流动相:乙腈-水(63∶37,0.03%三乙胺);流速:1.0 mL/min;检测波长:266 nm;柱温:25 ℃;进样量:20 μL。
2.2.4 专属性考察 分别精密移取对照品溶液、供试品溶液及阴性样品溶液各20 μL,注入高效液相色谱仪,记录色谱图,见图1。该色谱条件下,索拉非尼峰形较好,保留时间为10.7 min,溶剂和辅料无干扰。

图1对照品(A)、阴性样品溶液(B)和样品溶液(C)的高效液相色谱图(1.索拉非尼)
2.2.5 标准曲线的绘制 精密吸取对照品溶液,分别配制成浓度为5、50、100、250、300、400 μg/mL的标准溶液,依次进样20 μL,以质量浓度(c)对峰面积(A)进行线性回归,得回归方程A=2.141 1c+0.289 3(r=0.999 9)。结果表明,在5~400 μg/mL浓度范围内,索拉非尼的质量浓度与峰面积呈良好的线性关系。
2.2.6 精密度实验 精密量取质量浓度为5、250、400 μg/mL的对照品溶液,于1 d内0、2、4、6、12、24 h进样6次,计算日内精密度;每日进样1次,连续进样6 d,计算日间精密度。低、中、高浓度日间和日内精密度(RSD)均小于2%。
2.2.7 稳定性实验 取同一份索拉非尼供试品溶液,分别在0、2、4、8、12、24 h进样测定,记录峰面积并计算RSD,结果RSD=1.53%(n=5),表明索拉非尼样品溶液在24 h内基本稳定。
2.2.8 重复性实验 取同一批索拉非尼纳米混悬液5份,依法制备索拉非尼供试品溶液,进行含量测定,结果RSD<2%(n=5),表明该方法重复性较好。
2.2.9 回收率实验 取0.5 mL空白NPs混悬液9份,分别置10 mL量瓶中,分别加入低、中、高浓度的对照品溶液5 mL、乙腈5 mL,超声破乳,并加入流动相定容至刻度,摇匀,依法进样测定。结果平均回收率为98.60%,RSD=1.38%(n=9)。见表1。
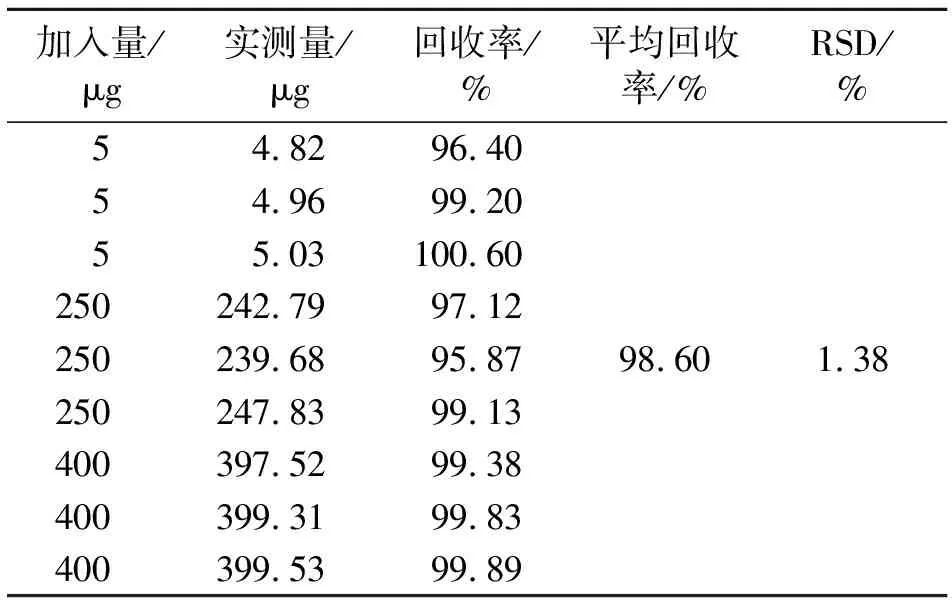
表1 加样回收率实验结果(n=9)
2.3 索拉非尼载药量和包封率测定 采用低温超速离心法测定NPs的包封率。取索拉非尼纳米混悬液,过膜,进样20 μL,测得总含量(W总);离心(12 000 r/min, 20 min, 4 ℃),得上清液,精密移取上清液20 μL,依法进样测定,计算未包封的索拉非尼量(W1)。另取索拉非尼纳米混悬液,用流动相定容,测定索拉非尼的含量,计算NPs中索拉非尼的总量(W2)。计算公式如下:
载药率=(W2-W1)/W总×100%;
包封率=(W2-W1)/W2×100%。
2.4 索拉非尼PLGA-TPGS NPs的处方优化
2.4.1 Box-Behnken响应面法设计方案 参考文献[14-15]的方法,并根据预实验结果,以索拉非尼与PLGA的质量比(x1)、有机相与水相的容积比(x2)、乳化剂TPGS的浓度(x3)为考察指标,以包封率(y1)和载药量(y2)为评价指标,按表2设计因素水平进行实验。

表2 Box-Behnken实验因素水平表
2.4.2 实验结果与模型拟合 采用Hassan公式将包封率和载药量进行“归一化”处理,计算其几何均数归一值(overall desirability,OD)。OD=(d1×d2×…×dn)1/n,n为指标数;di=(yi-ymin)/(ymax-ymin),yi为实测值,ymin和ymax为某一指标在不同试验中的最小值和最大值。实验结果见表3。

表3 Box-Behnken实验结果
应用Design-expert 8.0.6统计软件对结果分别进行多元非线性回归和二次多项式方程拟合,得索拉非尼与PLGA的质量比(x1)、有机相与水相的容积比(x2)、乳化剂TPGS的浓度(x3)与OD值之间的二次多项回归方程:OD= 0.77+0.17x1-0.040x2-0.057x3-0.014x1x2-0.19x1x3-0.22x2x3-0.17x12-0.19x22-0.22x32。对OD值进行方差分析,得出方程决定系数R2=0.947 3,表明该回归模型的拟合情况良好。响应面拟合的二次模型方差分析结果(见表4)提示该模型的预测价值有统计学意义(P<0.05),且失拟值无统计学意义(P>0.05),说明该模型能较好地拟合并对响应值准确地预测。此外,一项式中x1对模型的预测价值有统计学意义(P<0.05),x1x3和x2x3的交互作用对模型的预测价值有统计学意义(P<0.05)。二项式中x12、x22、x32对模型的预测价值均有统计学意义(P<0.05)。
2.4.3 响应面优化处方 根据二次多项式拟合方程,应用Design Expert 8.0.6软件模拟出实验因素对响应值的三维响应面图和等高线图,见图2、图3、图4。图2显示乳化剂TPGS浓度为0.05%,索拉非尼与PLGA质量比的最优区域是1∶10~1∶12,有机相和水相容积比的最优区域为1∶4~1∶6。图3显示有机相、水相比为5倍的条件下,索拉非尼与PLGA质量比的最优区域是1∶10~1∶12,乳化剂TPGS浓度的最优区域是0.03%~0.07%。图4显示PLGA是药物质量10倍的条件下,有机相和水相容积比的最优区域为1∶4~1∶6,乳化剂TPGS浓度的最优区域是0.03%~0.07%。根据上述所选最优区域,结合二次回归方程,求解得到最佳制备工艺条件:索拉非尼与PLGA的质量比(x1)为1∶11.56;有机相与水相的容积比(x2)为1∶5.56;乳化剂TPGS的浓度(x3)为0.03%。
2.4.4 验证试验 根据最佳处方条件,制备3批样品,测定其包封率和载药率。结果包封率的预测值为90.35%,实测值为89.78%±1.54%,RSD=0.63%(n=5);载药率的预测值为9.65%,实测值为9.41%±0.35%,RSD=2.49%。各项指标实测值与预测值之间偏差均小于5%,说明最佳处方条件可靠,预测性较好。

表4 OD值响应面二次回归模型方差分析结果
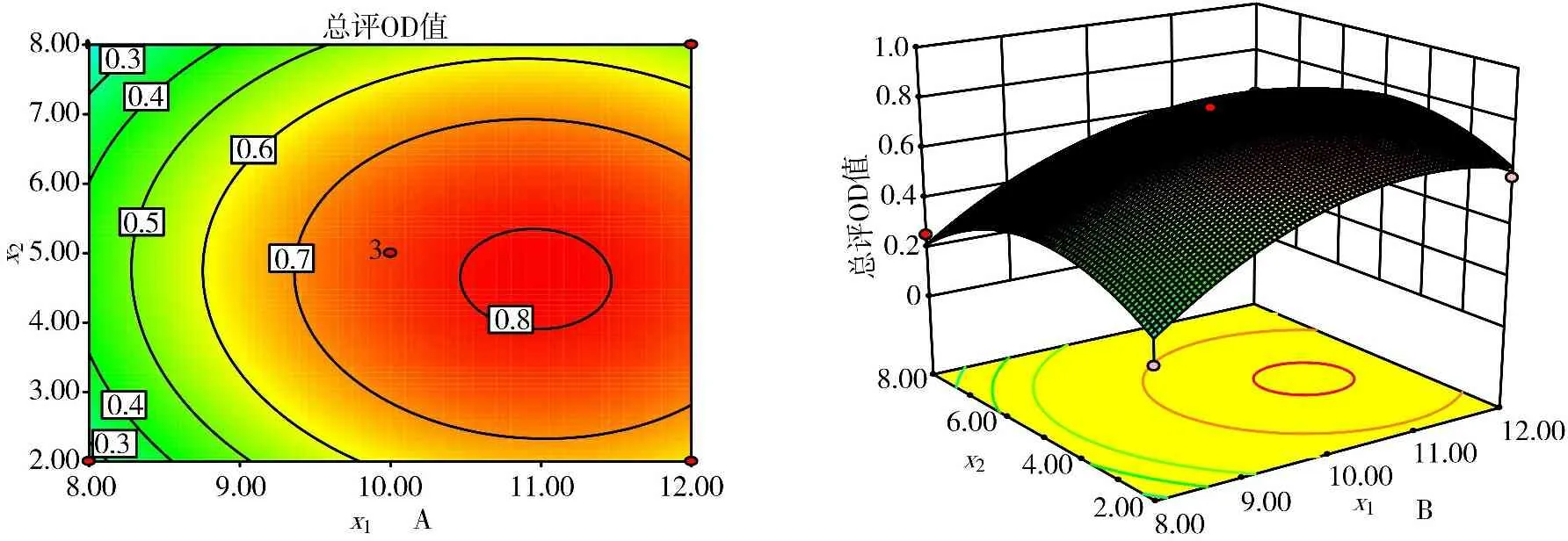

图2 索拉非尼与PLGA的质量比(x1)和有机相与水相容积比(x2)对OD值影响的等高线图(A)与响应面图(B)
图3索拉非尼与PLGA的质量比(x1)和乳化剂TPGS浓度(x3)对OD值影响的等高线图(A)与响应面图(B)
2.5 体外释药性能研究
2.5.1 释放介质的配制 参照《中华人民共和国药典》(2015版)方法,分别配制不同pH值的磷酸盐缓冲液。①pH 5.0磷酸盐缓冲液:取0.2 mol/L磷酸二氢钠溶液一定量,用氢氧化钠试液调节pH值至5.0,即得。②pH 7.4磷酸盐缓冲液:取磷酸二氢钾1.36 g,加0.1 mol/L氢氧化钠溶液79 mL,用水稀释至200 mL,即得。
2.5.2 药物释放测定 采用透析法考察索拉非尼PLGA-TPGS NPs在磷酸缓冲盐溶液[pH 5.0(肿瘤偏酸性环境)和pH 7.4(中性环境)]中的释放行为。将5 mL NPs或索拉非尼溶液装入预处理好的透析袋中,平行3份,除去袋内的气泡,两端系好,放入含100 mL的磷酸盐缓冲液中,释放液中加入1%吐温-80保证药物在漏槽条件下释放,于恒温摇床上震荡(37 ℃,120 r/min)分别在1、2、3、4、8、12、24、48、72、96、120 h时间点取样2 mL,每次均补充新鲜的释放介质2 mL,将样液过膜(0.22 μm)取滤液20 μL进样。实验结果见图5。由结果可知,索拉非尼PLGA-TPGS NPs和索拉非尼原料药的释放行为存在较大的差异。其中索拉非尼原料快速释放,24 h处释放度达92.82%±4.06%,120 h内完全释药。索拉非尼PLGA-TPGS NPs在pH 5.0和pH 7.4的磷酸盐缓冲液模拟肿瘤环境和血液环境,释放表现为二相特征,可看出前20 h出现突释效应,其原因为尚有一部分索拉非尼游离于NPs外或附着于NPs表面,在溶出介质中释放速度快。随后,表现为缓慢释放,在120 h,索拉非尼PLGA-TPGS NPs在肿瘤微环境和血液环境中的累计释放量分别为80.69%±4.70%和40.67%±3.77%,这表明NPs能够在肿瘤部位更多地释放出药物,而在血液中药物释放量少。

图4有机相、水相容积比(x2)和乳化剂TPGS浓度(x3)对OD值影响的等高线图(A)与响应面图(B)

图5 索拉非尼PLGA-TPGS NPs和索拉非尼溶液体外累积释放曲线
2.6 NPs表征 采用激光粒度仪表征纳米混悬液的粒径结果。其粒径为249.2 nm,多分散指数(polydispersity,PDI)为0.082,Zeta电位为-29 mV。结果表明所制备的NPs具有良好的分散性和稳定性。见图6。
2.7 NPs形态观察 取少量NPs混悬液,滴至有400目碳膜的铜网上,静置2 min后,再滴加2%的磷钨酸负染片刻,吸去多余的负染液,晾干后通过透射电镜观察NPs的形态,见图7。索拉非尼PLGA-TPGS NPs为球形,结构完整。
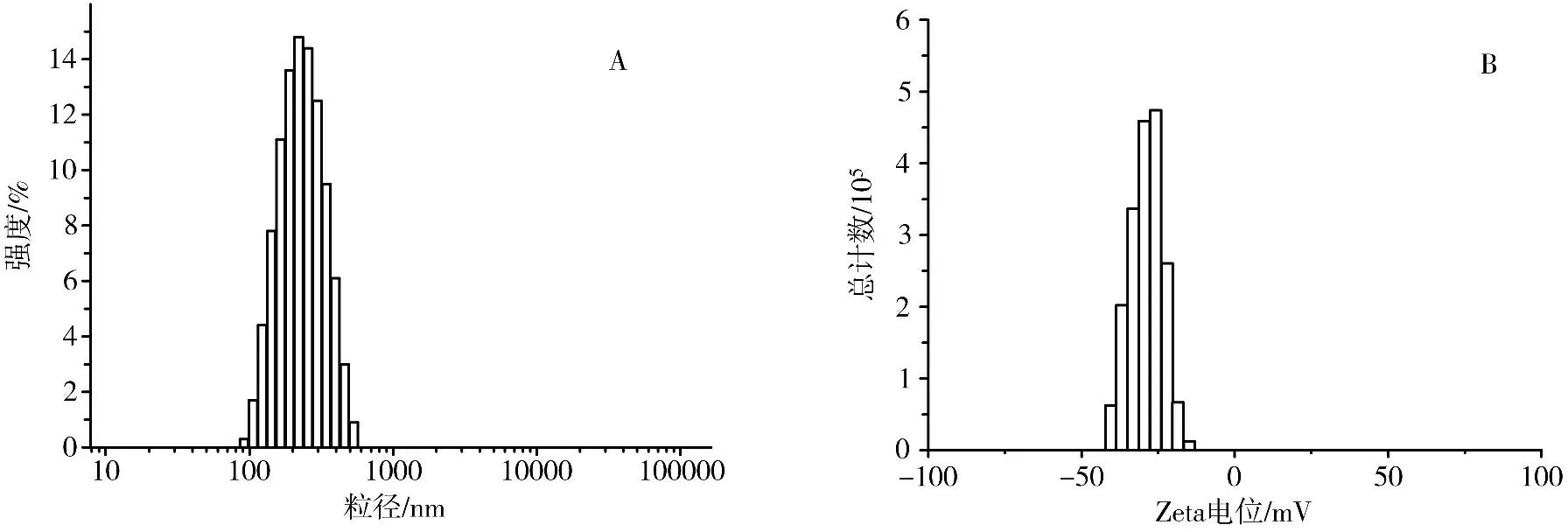

图6 索拉非尼PLGA-TPGS粒径分布图(A)及电位图(B)
图7透射电镜下索拉非尼PLGA-TPGS NPs形态(A、B分别放大3 000、5 000倍)
3 讨论
索拉非尼为难溶性药物[16],实验中通过溶剂、非溶剂法使索拉非尼在水性介质中形成NPs,在制备过程中加入聚合物材料和乳化剂,对减小NPs的粒径及提高稳定性有重要作用。本实验的关键是有机溶剂的选择,需要选择一种既能溶解药物,又能溶解载体的溶剂。在实验初期,曾选用甲醇、乙醇、乙酸乙酯作为有机溶剂,但所制备的NPs粒径大小、分散系数及稳定性都不理想。最终确定采用二甲基亚砜-丙酮(1∶5)为有机溶剂,通过调节pH至酸性,达到提高药物溶解性的目的。在乳化剂的选择上,实验最初使用聚乙烯醇(polyvinyl alcohol,PVA)对聚合物NPs进行包裹,制得的样品粒径和包封率低,最终通过筛选采用0.03% TPGS作为乳化剂增加药物的包封率,所制备出的NPs各项理化指标较优,粒径均在240 nm左右,PDI值均小于0.2。
药物制剂工艺复杂,影响因素众多,且各因素之间存在交互作用[17]。Box-Behnken响应面法采用非线性数学模型对多个影响因素进行实验优化,现已广泛应用于药学制剂处方优化和筛选[18]。与均匀设计和正交设计比较,响应面法实验次数少、精度高、预测性好[19]。本实验通过星点设计法优化制备索拉非尼PLGA-TPGS NPs,在预实验中,考察了制备工艺中各因素对NPs的包封率、载药量、Zeta电位、NPs粒径等指标的影响,相关性分析后发现各因素对NPs粒径分布和Zeta电位的影响不显著。载药量是决定药物进入体内发挥作用的重要指标,包封率是体现药物与纳米材料的相容性[20],综合考虑最终选定包封率和载药量为本实验考察指标,响应面法优化得到索拉非尼PLGA-TPGS NPs最优工艺的包封率为89.78%,载药量为9.41%,与已研究的索拉非尼新剂型[21]相比,在载药量相当的情况下,包封率显著提高,这为后续进一步开展索拉非尼PLGA-TPGS NPs体内研究奠定良好的制备工艺基础。药物的释放行为表明,在酸性环境下,药物释放更快,这是由于外层的聚合物材料更容易解离,而在血液环境中,纳米药物释放量少,后期通过静脉注射入血后NPs可携带药物至靶点,并在肿瘤微酸性环境中完全释放。
