LncRNA-HOTTIP促进肺癌发生发展的作用及机制研究
2019-02-22孙耕耘秦一雨葛安兴
杨 莉,孙耕耘,秦一雨,葛安兴
肺癌是人类最常见的恶性肿瘤,我国是肺癌大国,年新发病例数约占全球总数一半,并呈逐年上升趋势[1]。近年来,手术、放化疗等治疗手段日益进展,但肺癌整体疗效并不理想[2]。研究肺癌发生发展的分子机制对改善目前中晚期肺癌患者预后具有重大意义。长链非编码RNA(long non-coding RNA, LncRNA)是一类长度大于200 bp、不编码蛋白的RNA,通过多种途径调控基因表达,发挥生物学功能。近年来LncRNA与肿瘤之间的关系逐渐受到重视,它们作为原癌基因发挥促癌作用,也能作为抑癌基因发挥抑癌作用[3-4]。该研究通过长链非编码RNA芯片对肺癌组织和癌旁组织中差异表达的LncRNA进行筛查,发现HOXA远端转录本(HOXA transcript at the distal tip,HOTTIP)基因表达显著增高,并通过一系列细胞和分子生物学实验探讨HOTTIP对肺癌细胞增殖和凋亡的影响和机制。
1 材料与方法
1.1材料携带HOTTIP-shRNA、HOTTIP全长序列的慢病毒以及空白慢病毒购自上海伯豪生物科技有限公司;特异性HOTTIP原位杂交检测试剂盒(HOTTIP RNAscope 2.0)购自美国Advanced Cell Diagnostic公司;DMEM高糖细胞培养液购自美国Gibco公司;胎牛血清购自美国Hyclone公司;TRIzol裂解液购自美国Sigma公司;PCR引物由上海生物工程技术服务公司合成;反转录试剂盒购自日本Takara公司;Annexin V-FITC/PI双染试剂盒购自美国BD公司;蛋白提取试剂盒购自中国碧云天公司;PVDF膜购自美国Millipore公司;所有抗体包括一抗和二抗均购自美国Santa Cruz公司;ECL化学发光试剂盒购自美国Pierce公司;X-OMAT-Blue film购自美国Kodak公司。
1.2方法
1.2.1组织标本收集 收集铜陵市人民医院胸外科行肺癌手术的80例肺癌患者,其中男52例,女28例;年龄 37~75岁,中位年龄64岁;肺癌肿块切除后采用福尔马林予以固定保存,同时切除肿块周围2 cm以外的癌旁组织作为对照组。所有80例患者均签署了知情同意书和手术同意书。
1.2.2LncRNA芯片检测 采用TRIzol提取3例肺癌组织及癌旁组织中的总RNA,然后送公司进行LncRNA芯片检测(美国Agilent公司)。该芯片可检测41053条LncRNA和29417条mRNA。检测结果采用Real-time PCR进行验证。
1.2.3细胞培养 人肺癌细胞株95-D、A549和人永生化肺上皮细胞株BEAS-2B购自中国科学院上海分院细胞库。三种细胞均采用添加10%胎牛血清和1%青链霉素的高糖DMEM培养基培养于37 ℃条件下5% CO2的常规细胞培养箱中。在细胞生长至80%融合率时,采用0.25%胰酶消化细胞并进行传代。
1.2.4慢病毒构建及转染 携带目标LncRNA全长的慢病毒(Lenti-HOTTIP)和携带HOTTIP-shRNA的慢病毒(Lenti-HOTTIP-shRNA)由上海伯豪生物科技有限公司完成。在95-D和A549细胞采用无血清培养基培养4 h后,将携带目标基因的慢病毒加入到细胞培养基中,继续孵育12 h。稳定转染采用加入嘌呤霉素的培养基培养2周。
1.2.5CCK-8法 96孔板中每孔接种2×103个95-D和A549细胞/100 μl过夜,然后加入慢病毒孵育,在孵育12 h后每孔加入10 μl体积的CCK-8溶液,并设计不加慢病毒的细胞作为对照组。加入CCK-8溶液孵育2 h后,放入酶标仪中检测溶液在450 nm的吸光度。细胞相对生长率=实验组OD值/对照组OD值×100%。
1.2.6Annexin V/PI实验 Annexin V/PI实验按照BD公司提供的试剂盒进行。收集至少1×105个经慢病毒处理后的95-D和A549细胞,用70%预冷的乙醇固定30 min,然后分别加入Annexin V和PI,在黑暗的室温下孵育15 min,然后上流式细胞仪检测。
1.2.7Real-time PCR 采用TRIzol提取组织和细胞中的总RNA。首先将RNA反转录成cDNA,然后进行PCR扩增,扩增的参数设置如下:95 ℃、8 min预变性;95 ℃、10 s,65 ℃、18 s,72 ℃、16 s,共40个循环。U6作为内参照。引物如下:miR-137:F: 5’-CCGGTGGTCCTCTGACTCTCTTCGGTGACGGGTATT-CTTGGGTGGA-3’;R: 5’-ATTACGTTGTTATTGCTTAAGAATACGCGTAGTCGAGGAGAGTAC-3’;HOTTIP:F:5’-AATTCTGCCGCTGGTACTCTCCTCGACTACGCGTATTCTTAAGCAAT-3’; R: 5’-TAATCCGTATTATCCACCCAAGAATACCCGTCACCGAAGAGA-GTC-3’;U6:F:5’-CTCGCTTCGGCAGCACA;R:5’-AACGCTTCACGAATTTGCGT-3’。
1.2.8原位杂交实验 首先将肺癌和癌旁组织制成4 μm后的组织切片,每一张组织切片使用20 ul含有特异性HOTTIP探针的预处理液孵育12 h,然后采用二氨基联苯胺(DAB)显色。染色评分采用阳性细胞百分数与染色强度乘积的方法。根据阳性细胞百分数比例分为(0分,<5%; 1分, 5%~25%; 2分, 25%~50%; 3分, >50%),根据染色强度分为(0分, 阴性; 1分, 弱阳性; 2分, 中等; 3分, 强阳性)。HOTTIP染色评分分级如下:- (0~1分)、+(2~3分)、(4~6分)、(>6分)。据此将HOTTIP表达水平分为两组:HOTTIP低表达为(-)、(+);HOTTIP高表达为()、()。
1.2.9Western blot法 总蛋白采用蛋白提取试剂盒完成。取25 μg蛋白样品经95 ℃水浴加热变性后,加至SDS-PAGE胶中,然后按序进行电泳、转膜(0.2 μm PVDF膜)、封闭、一抗孵育、二抗孵育、ECL化学发光、显影定影。GAPDH蛋白作为内参照。
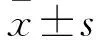
2 结果
2.1肺癌组织中LncRNA表达谱分析芯片结果显示(图1A),肺癌组织和癌旁组织中共有127个LncRNA表达水平存在显著差异,表达差异在2倍及以上的LncRNAs一共有22个。在肺癌组织中表达上调的LncRNA有15个,表达下调的LncRNA有7个,其中HOTIIP在肺癌组织中表达上调最为显著,FC=6.37(表1)。通过Real-time PCR对80例肺癌组织中HOTIIP表达水平进行验证,结果显示HOTTIP在肺癌组织中的表达水平显著高于相应癌旁组织(F=97.267,P<0.001)(图1B)。
2.2HOTTIP与患者临床病理因素之间的关系如图2所示,原位杂交结果显示HOTTIP主要位于细胞质,在肿瘤细胞胞质中染色强度和阳性率均显著高于癌旁组织。高表达组52例,低表达组28例。通过χ2检验分析,HOTTIP表达水平与性别、年龄、分化程度并无显著关系,但它与肿瘤大小、TNM分期以及淋巴分期显著相关。见表2。
2.3HOTTIP对肺癌细胞增殖的影响如图3所示,HOTTIP在肺癌细胞株95-D和A549中的表达水平显著高于人永生化肺上皮细胞株BEAS-2B。HOTTIP过表达可以促进95-D和A549细胞增殖,而沉默其表达则可以抑制细胞增殖(P<0.05)。见表3、4。
2.4HOTTIP对肺癌细胞凋亡的影响在经过慢病毒处理72 h后,HOTTIP过表达组细胞凋亡比例与对照组并无显著差异,而HOTTIP表达下调组细胞凋亡比例显著增高(P<0.05)。见图4。
2.5HOTTIP对增殖和凋亡相关蛋白表达的影响如图5所示,HOTTIP表达下调后(HOTTIP-shRNA),95-D细胞内p-AKT、p-mTOR和bcl-2蛋白表达水平下调, Bax、断裂的caspase-3蛋白表达水平上调,而HOTTIP过表达后,95-D细胞内p-AKT、p-mTOR和bcl-2蛋白表达水平上调,Bax、caspase-3蛋白表达水平不变。Bax、caspase-3、p-AKT、p-mTOR和bcl-2蛋白条带相对灰度值见表5。
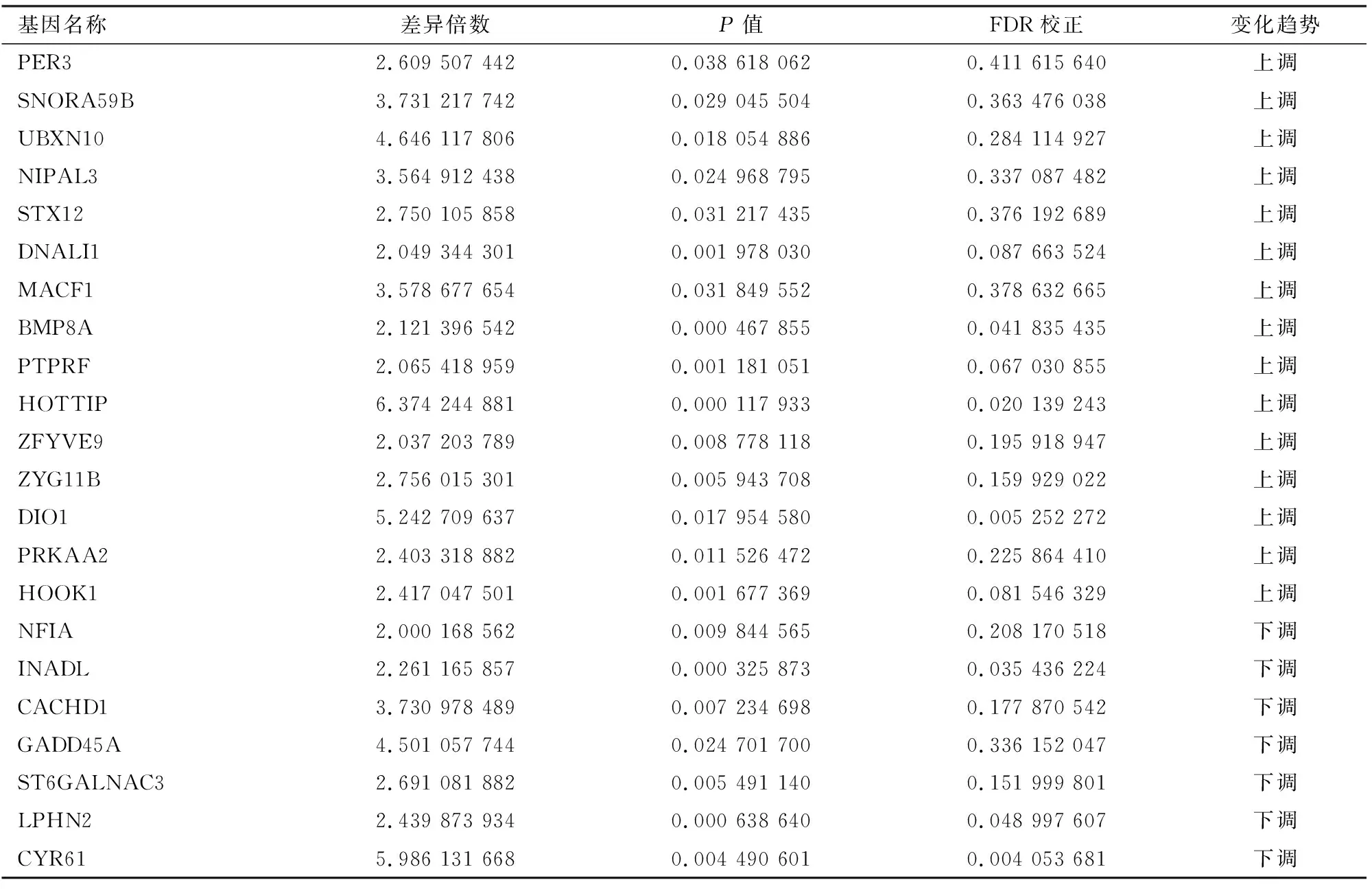
表1 表达差异两倍或两倍以上的LncRNAs

图1 肺癌和癌旁组织中HOTTIP表达水平
A:3例肺癌组织及相应癌旁组织芯片筛查热图;B:80例癌组织与癌旁组织的表达水平差异;与癌旁组织比较:***P<0.001

图2 HOTTIP在癌组织和癌旁组织中的原位杂交染色 ×200
2.6HOTTIP与miR-137表达水平相关性分析通过miRDB软件对HOTTIP与miR-137存在的结合位点进行预测,发现两者存在结合位点(图6A)。采用Real-time PCR检测80例肺癌患者组织中miR-137表达水平,并与HOTTIP表达水平进行相关性分析,结果显示相关系数为-0.412,P<0.001,提示两者呈显著负相关(图6B)。

表2 HOTTIP表达水平与临床病理因素的关系(n=80)
3 讨论
近年来多项研究显示长链非编码RNA在肿瘤发生发展过程中发挥重要作用。本研究首先通过芯片筛查发现长链非编码RNA(HOTTIP)在肺癌组织中表达异常增高,并通过Real-time PCR予以验证。发现HOTTIP不仅在肺癌组织中表达增高,而且其表达水平与某些临床病理因素如肿瘤大小、淋巴转移以及TNM分期相关。已有研究[5-6]显示HOTTIP在一些恶性肿瘤中存在表达增高的现象,如肝细胞癌、胰腺癌等。2017年Zhang et al[7]研究发现HOTTIP在肺癌组织中的表达水平显著高于正常组织,这与本课题组的研究结果相似。以上研究提示HOTTIP不仅参与肺癌发生发展,还可能成为诊断以及评估分期的标志物。
目前HOTTIP被认为具有原癌基因的特征,可以促进多种肿瘤细胞增殖,其中包括肺癌[8]。在后续的功能学实验中研究了HOTTIP对肺癌细胞增殖和凋亡的影响,结果提示HOTTIP也参与调控肺癌细胞凋亡。PI3K/AKT/mTOR是调控细胞增殖和凋亡的经典信号通路[9],研究[10]显示PI3K信号通路在肺癌中处于异常激活状态。本课题组发现HOTTIP处理后PI3K信号通路中的成员AKT和mTOR的磷酸化状态出现增多,说明信号通路被激活,这可能是HOTTIP促进肺癌细胞增殖的重要原因。此外,本课题组还检测了凋亡相关蛋白Bax和Bcl-2及caspase-3的表达水平。结果显示HOTTIP-shRNA处理后,Bax表达升高,Bcl-2表达降低,而caspase-3活性片段表达升高,以上结果说明HOTTIP可以通过调控Bax/Bcl-2比例来影响细胞凋亡,但HOTTIP如何调控Bax/Bcl-2蛋白有待进一步研究。

图3 HOTTIP表达水平对肺癌细胞增殖的影响
A: HOTTIP在95-D、A549以及BEAS-2B细胞中的表达水平;与BEAS-2B比较:*P<0.05;B: HOTTIP表达对95-D细胞增殖的影响;与Control组比较:△P<0.05;C: HOTTIP表达对A549细胞增殖的影响;与Control组比较:#P<0.05
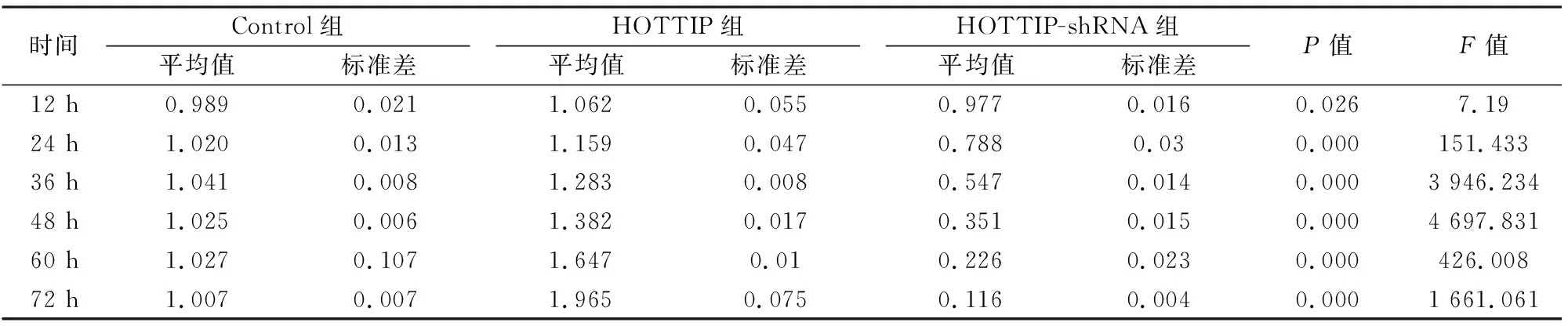
表3 95-D细胞OD值平均值、标准差、P值以及F值

表4 A549细胞OD值平均值、标准差、P值以及F值

图4 HOTTIP表达水平对肺癌细胞凋亡的影响
A: 流式细胞仪检测Annexin V/PI双荧光;B:各处理组中95-D和A549细胞凋亡比例;与Control组比较:*P<0.05

图5 HOTTIP对增殖和凋亡相关蛋白表达的影响

图6 结合位点预测及相关性分析
A: HOTTIP序列中存在miR-137结合位点;B: HOTTIP与miR-137表达水平相关性

表5 Bax、caspase-3、p-AKT、p-mTOR和bcl-2蛋白条带相对灰度值
LncRNA生物学作用方式多种多样,既可以从转录水平也可以从转录后水平调控基因表达[11-12]。近年来,学者们发现一种LncRNA调控基因表达的新途径,就是LncRNA可作为竞争性内源性RNA(ceRNA)与miRNA相互结合,减弱miRNA对其他靶基因表达的抑制作用,并且这种作用方式通常只存在于细胞质中[13]。本课题组研究发现HOTTIP主要存在于细胞质中,提示HOTTIP可能也通过竞争性结合miRNAs发挥生物学作用。于是,本课题组通过软件miRDB对HOTTIP可能结合的miRNAs进行了预测,结果显示HOTTIP存在与miR-137结合的序列,本课题组进一步检测miR-137在肺癌中的水平,发现其表达水平与HOTTIP呈负相关。miR-137被认为是一种抑癌基因,在多种肿瘤中包括肺癌表达下调,可以通过作用于多种靶基因如SRC3和TGFA而发挥抑制肺癌发生发展的作用[14-15]。在今后的研究中,本课题组将通过双荧光素酶报告基因检测HOTTIP与miR-137的直接结合,并进一步预测和验证miR-137的靶基因。
