马衔山中国沙棘根瘤内共生细菌多样性研究
2019-02-21张爱梅韩雪英孔维宝牛世全朱学泰
张爱梅,韩雪英,王 嘉,孔维宝,牛世全,朱学泰
西北师范大学生命科学学院,兰州 730070
植物内生菌是在一定阶段或全部阶段生活于健康植物的组织和器官内部的一大类微生物[1]。内生菌具有丰富的生物多样性,对于一种植物而言,从中可分离到的内生真菌或细菌通常为几种至几十种,有的甚至可达几百种[2]。内生菌数量庞大,种类众多,包括内生真菌、内生细菌和内生放线菌等[3]。在同一种植物的根、茎、叶、花、果实和种子中均有内生菌被发现,且植物内生菌具有一定的植物和组织专一性[4]。
内生菌多样性的研究主要应用传统的微生物培养技术,通过分离、培养等过程从特定的样品中获得微生物纯培养物,再进行菌株的分类鉴定。由于实验室条件下提供的培养基及培养环境与微生物所处的自然环境之间存在很大差异,大量微生物无法通过纯培养获得目标菌株。高通量测序技术的快速发展,为内生菌多样性的研究提供了更有效的途径,可灵敏地探测待测样品中包括稀少种群在内的绝大多数微生物,能更全面客观地揭示目标环境中微生物群落结构,同时获得定性及相对定量的信息[5]。
中国沙棘(Hippophaerhamnoides)可在贫瘠干旱及高寒环境生存,根系发达,且能形成明显的根瘤,是一种典型的放线菌结瘤植物,能与弗兰克氏菌(Frankia)共生结瘤固氮。研究发现,除弗兰克氏菌外,沙棘根瘤中还存在大量的非弗兰克氏内共生菌[6-7]。用纯培养方法研究沙棘内共生菌时还发现,沙棘内共生菌具有系统内生性和组织专化性[8]。
为了全面了解沙棘根瘤内共生细菌的多样性,明确根瘤内共生细菌群落结构特点及组成,以分布在甘肃马衔山高寒地区的中国沙棘根瘤为研究材料,将高通量测序技术和纯培养技术联合使用,以期能更系统地揭示中国沙棘根瘤内共生细菌的多样性,并获得具有潜在应用价值的内共生细菌资源。同时,比较两种方法研究结果的差异,为沙棘根瘤内共生细菌多样性的研究与应用提供参考,并为更进一步开展内生共细菌相关研究提供方向及有价值的菌株材料。
1 材料与方法
1.1 样品采集
采样地为马衔山自然保护区,地理位置位于甘肃省兰州市榆中县马坡乡(海拔2792 m,年平均气温3.2℃,经纬度: 103°58′42″E, 35°47′21″N)。2016年9月在沙棘根瘤生长期,在人为干扰相对较少的河滩地生长的中国沙棘灌丛典型生境,选取6株中国沙棘植株采集沙棘根瘤,带回实验室于4℃冰箱保存,并尽快进行根瘤内共生细菌的分离培养和根瘤总DNA的提取[9]。
1.2 沙棘根瘤表面消毒
选取新鲜幼嫩的沙棘根瘤样品,除去沙棘根瘤表面的泥沙等杂质,依次用自来水、蒸馏水和无菌水分别冲洗。然后用75%乙醇和1% NaClO溶液分别进行表面消毒,再用无菌水反复冲洗,收集最后一次冲洗的无菌水进行无菌检测[10]。
1.3 沙棘根瘤内共生细菌的纯培养
1.3.1 内共生细菌的分离
沙棘根瘤内共生细菌的分离采用根瘤切片法[11]。采用牛肉膏蛋白胨培养基和加入沙棘根浸出物的牛肉膏蛋白胨培养基分离细菌;采用高氏I号培养基和加入沙棘根浸出物的高氏I号培养基分离放线菌;采用Qmod和加入沙棘根浸出物的Qmod培养基分离弗兰克氏菌。用无菌刀片将沙棘根瘤尖端含菌组织切成约1 mm的薄片,分别置于上述培养基的平板中,28℃培养。挑取平板上不同菌落形态特征的内共生细菌,划线纯化后保存于试管斜面备用。
1.3.2 内共生细菌的初步鉴定
沙棘根瘤内共生细菌的传统鉴定采用形态观察和生理生化实验相结合的方法。形态观察与生理生化特征主要参考《常见细菌系统鉴定手册》、《放线菌快速鉴定与系统分类》以及《土壤与环境微生物研究法》[12-14]。
1.3.3 内共生细菌的分子鉴定
沙棘根瘤内共生细菌DNA的提取采用碱解法[15],放线菌DNA提取采用微波法[16]。16S rRNA基因扩增采用通用引物:27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′)。PCR反应体总系为25 μL:引物各1 μL,模板4 μL,Taq MasterMix(Dye)15 μL,加ddH2O至25 μL。PCR扩增反应条件为95℃预变性5 min,95℃变性1 min,56℃退火30 s,72℃延伸2 min,30个循环,最后72℃延伸10 min。PCR产物经1%琼脂糖凝胶电泳检测后,送去北京奥科鼎盛生物科技有限公司进行测序。
将所得到的序列用NCBI的BLAST进行比对,用MEGA7.0软件采用邻接法构建系统发育树进行系统进化分析;将16S rRNA基因序列相似性在97%以上划分为同一个操作分类单元(operational taxonomic unit,OTU),进一步根据公式计算Shannon指数和Simpson指数。
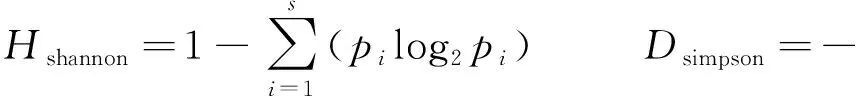
式中,S代表所有OTUs的总数,pi代表划分到同一个属的OTUs数占总OTUs的百分比[17]。
1.4 沙棘根瘤内共生细菌的高通量测序分析
1.4.1 内共生细菌总DNA提取与16S rDNA-V4区PCR扩增
根瘤内共生细菌总DNA的提取参照彭源东与李志真等采用的CTAB法[18-19]。用1%琼脂糖凝胶电泳检测所提取DNA的效果。
细菌16S rDNA-V4区的PCR扩增采用带Barcode的特异性引物515F(5′-GTGCCAGCMGCCGCGG-3′)和806R(5′-GCCAATGGACTAHVGGGTWTCTAAT-3′)。PCR扩增采用50 μLPCR扩增体系,扩增反应条件为98℃预变性5 min,98℃变性30 s,50℃退火30 s,72℃延伸30 s,25个循环,最后72℃延伸5 min。部分PCR产物于2%琼脂糖凝胶电泳检测,其余样品-20℃保存备用。
1.4.2 文库构建和上机测序
根据PCR产物浓度进行等量混样,充分混匀后使用2%琼脂糖凝胶检测PCR产物,对目的条带使用Qiagen公司的胶回收试剂盒回收产物。使用TruSeq® DNA PCR-Free Sample Preparation Kit建库试剂盒进行文库构建,构建好的文库经过Qubit和Q-PCR定量,文库合格后,使用Hiseq 2500 PE250进行上机测序。本研究测序工作由北京诺禾致源生物信息科技有限公司完成。
1.4.3 高通量测序数据处理
将测序得到的原始数据截去Barcode和引物序列后进行拼接,拼接得到的序列经过严格的过滤,并去除其中的嵌合体序列得到最终的有效数据。利用Uparse软件对样品的全部有效序列在97%水平上进行OTU聚类,并筛选出OTU中出现频率最高的序列作为OTUs代表序列,用Mothur方法与SILVA的SSUrRNA数据库进行物种注释分析,并在各个水平上统计样品的群落组成。高通量测序数据处理与分析由北京诺禾致源生物信息科技有限公司完成。
2 结果与分析
2.1 纯培养方法分析中国沙棘根瘤内共生细菌群落结构
利用不同培养基从采集的中国沙棘根瘤中分离纯化得到17株内共生细菌,所有菌株均可传代培养。所有菌株培养后,提取其DNA,再将菌株的16S rRNA基因进行PCR扩增并测序,测序得到的基因序列通过BLAST程序与GenBank数据库中已报道的16S rRNA序列进行相似性对比,并构建系统发育树(图1)。
同时进行17株菌株的形态学观察和生理生化实验,将二者结果与系统进化树结果结合进行分析,分离到的17株沙棘根瘤内共生细菌分属于放线菌门(Actinobacteria)、厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)3个门。在属分类单元,17株菌株分属于8个属,其中:链霉菌属(Streptomyces)4株、韩国生工菌属(Kribbella)1株、拟诺卡氏菌属(Nocardiopsis)1株、类芽孢杆菌属(Paenibacillus)1株、芽孢杆菌属(Bacillus)7株、芽生杆菌属(Bosea)1株、马赛菌属(Massilia)1株和沙雷氏菌属(Serratia)1株;优势属为芽孢杆菌属和链霉菌属。
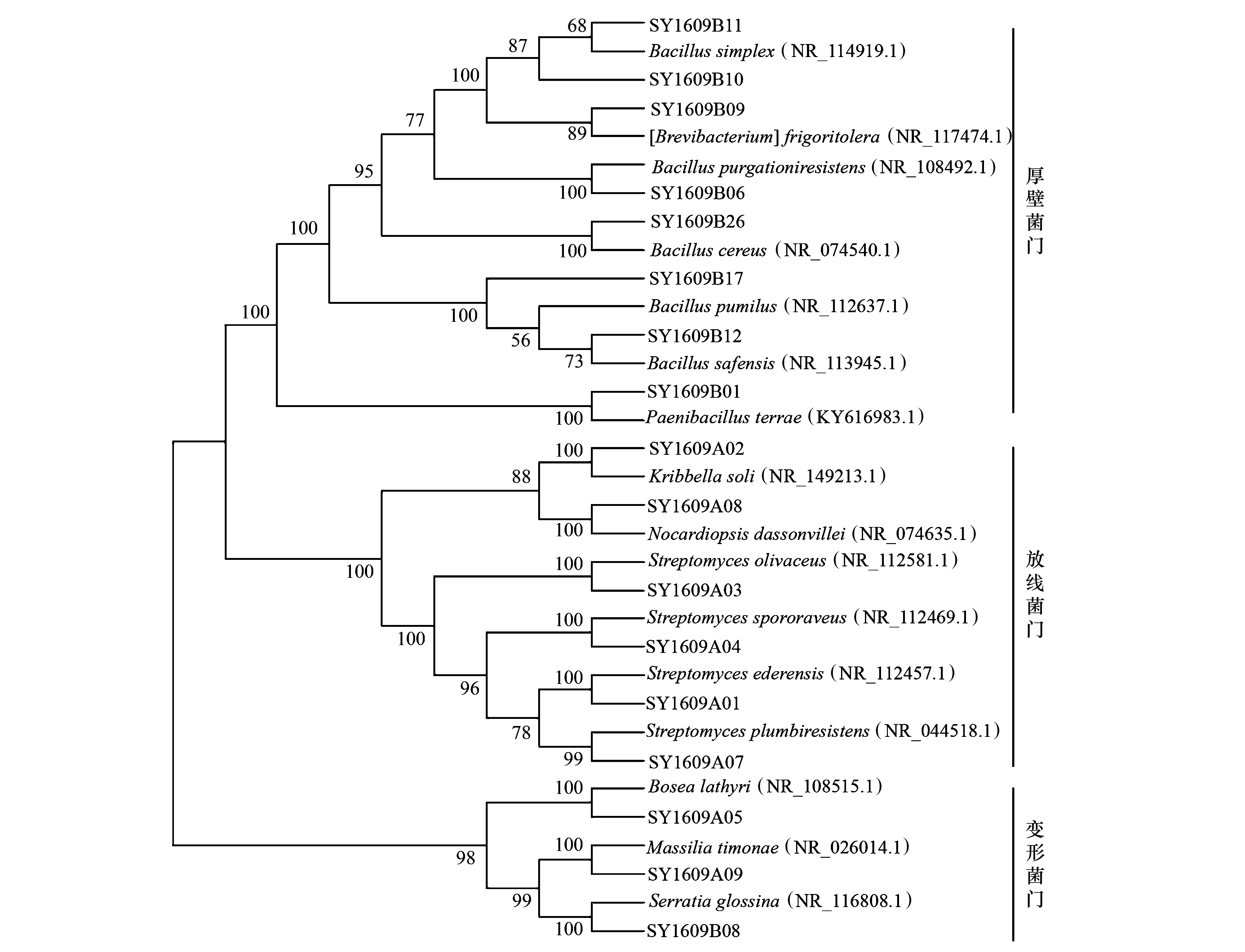
图1 基于16S rRNA基因构建系统进化树Fig.1 Phylogenetic tree based on 16S rRNA gene sequences
2.2 高通量测序分析中国沙棘根瘤内共生细菌群落结构
2.2.1 样品复杂度分析
采用Illumina HiSeq 测序平台进行测序,得到51566条原始数据,拼接和质控后进行嵌合体过滤,得到可用于后续分析的有效序列50234条,其平均长度约422 bp,与16S rDNA-V4区序列长度基本一致。以97%的一致性将有效序列聚类为1805个OTU。
结果表明样品覆盖度为99.3%,ACE指数为1318,Chao1指数为1271,且稀释曲线趋于平稳,表明测序数据合理可靠。
2.2.2 OTU物种注释
对OTU代表序列进行物种注释,获得分类学信息并分别在各分类单元统计样本的群落组成,沙棘根瘤内共生细菌可以注释到24门、50纲、90目、167科、215属(表1)。
2.2.3 内共生细菌群落结构组成
在门和属分类单元进行物种分类树统计,各分类单元相对丰度前10的物种分别如图所示(图2)。在门分类单元,沙棘根瘤内共生细菌主要分布在蓝细菌门(Cyanobacteria)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、衣原体门(Chlamydiae)、酸杆菌门(Acidobacteria)、绿弯菌门(Chloroflexi)、疣微菌门(Verrucomicrobia)和柔膜菌门(Tenericutes)等;其中蓝细菌门、变形菌门、放线菌门和厚壁菌门为优势门。
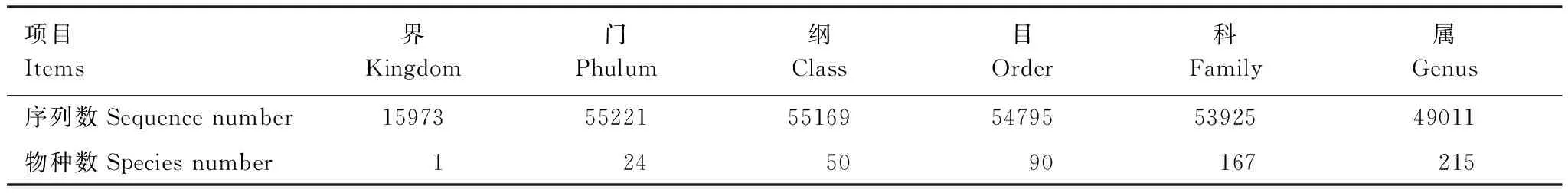
表1 各分类单元的序列数目及群落组成
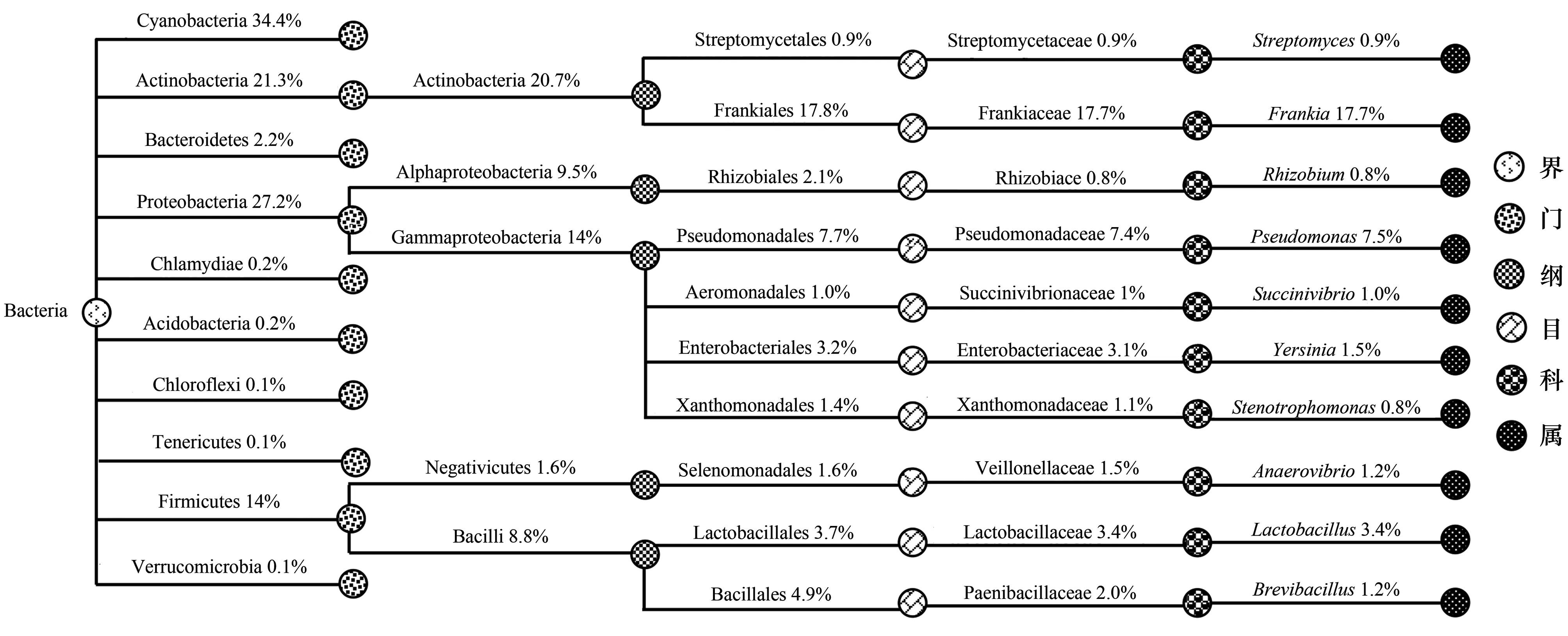
图2 物种分类树Fig.2 Classification tree of microbial speciesCyanobacteria:蓝细菌门;Actinobacteria:放线菌门;Bacteroidetes:拟杆菌门;Proteobacteria:变形菌门;Chlamydiae:衣原体门;Acidobacteria:酸杆菌门;Chloroflexi:绿弯菌门;Tenericutes:柔膜菌门;Firmicutes:厚壁菌门;Verrucomicrobia:疣微菌门;Actinobacteria:放线菌纲;Alphaproteobacteria:α-变形菌纲;Gammaproteobacteria:γ-变形菌纲; Bacilli:芽孢杆菌纲;Frankiales:弗兰克氏菌目;Rhizobiales:根瘤菌目;Pseudomonadales:假单胞菌目;Aeromonadales:气单胞菌目;Enterobacteriales:肠杆菌目;Xanthomonadales:黄单胞杆菌目;Selenomonadales:月牙单胞菌目;Lactobacillales:乳杆菌目;Bacillales:芽孢杆菌目;Streptomycetaceae:链霉菌科;Frankiaceae:弗兰克氏菌科;Rhizobiace:根瘤菌科;Pseudomonadaceae:假单胞菌科;Succinivibrionaceae:琥珀酸弧菌科;Enterobacteriaceae:肠杆菌科;Xanthomonadaceae:黄单胞菌科;Veillonellaceae:韦荣球菌科;Lactobacillaceae:乳杆菌科;Paenibacillaceae:类芽孢杆菌科;Streptomyces:链霉菌属;Frankia:弗兰克氏菌属;Rhizobium:根瘤菌属;Pseudomonas:假单胞菌属;Succinivibrio:琥珀酸弧菌属;Yersinia:耶尔森氏鼠疫杆菌属;Stenotrophomonas:寡养单胞菌属;Anaerovibrio:厌氧弧菌属;Lactobacillus:乳酸杆菌属;Brevibacillus:短芽孢杆菌属
在属分类单元,沙棘根瘤内共生细菌主要包括弗兰克氏菌属(Frankia)、假单胞菌属(Pseudomonas)、乳酸杆菌属(Lactobacillus)、耶尔森氏鼠疫杆菌属(Yersinia)、厌氧弧菌属(Anaerovibrio)、短芽孢杆菌属(Brevibacillus)、琥珀酸弧菌属(Succinivibrio)、链霉菌属(Streptomyces)、根瘤菌属(Rhizobium)和寡养单胞菌属(Stenotrophomonas);优势属为弗兰克氏菌属和假单胞菌属,相对丰度分别达到17.7%和7.5%,为沙棘根瘤内的绝对优势类群。
2.3 纯培养和高通量测序分析中国沙棘根瘤内共生细菌的差异
2.3.1 内共生细菌群落结构的差异
在门、纲、目、科和属分类单元,纯培养方法只检测到3门、5纲、7目、8科和8属,而高通量测序共检测到24门、50纲、90目、167科和215属(表2)。后者的检测灵敏度分别是前者的8、10、12.9、20.9倍和26.9倍。这一结果表明,纯培养方法严重低估了沙棘根瘤内共生细菌的物种组成;分类单元越低,高通量测序方法检测到的微生物物种数越多,与纯培养方法相比具有越明显的优势。
2.3.2 内共生细菌相对丰度的差异
在门分类单元,比较纯培养和高通量测序方法检测到的根瘤内共生细菌的相对丰度,结果发现,纯培养方法检测到的放线菌门和厚壁菌门的内生细菌相对丰度明显高于高通量测序方法,而变形菌门的相对丰度却低于高通量测序方法(表3)。蓝细菌门、变形菌门、放线菌门和厚壁菌门均为高通量测序的优势菌门,蓝细菌门在纯培养时却没有分离得到。

表2 纯培养与高通量测序检测到的各分类单元的内共生细菌群落组成

表3 根瘤内共生细菌在门分类单元的相对丰度差异/%
在属分类单元,比较纯培养和高通量测序方法检测到的根瘤内共生细菌的相对丰度,发现纯培养方法检测到的内共生细菌的相对丰度普遍高于其在高通量测序方法中的丰度(表4)。纯培养方法分离得到的芽孢杆菌属的相对丰度为41.2%,而在高通量测序分析中只占0.70%;纯培养分离得到的链霉菌属的相对丰度为23.5%,但在高通量测序中只占0.92%;纯培养分离得到的拟诺卡氏菌属和沙雷氏菌属,高通量测序却没有检测到。相反地,高通量测序检测到的优势属弗兰克氏菌属(17.7%)和假单胞菌属(7.5%),纯培养方法却没有分离得到。
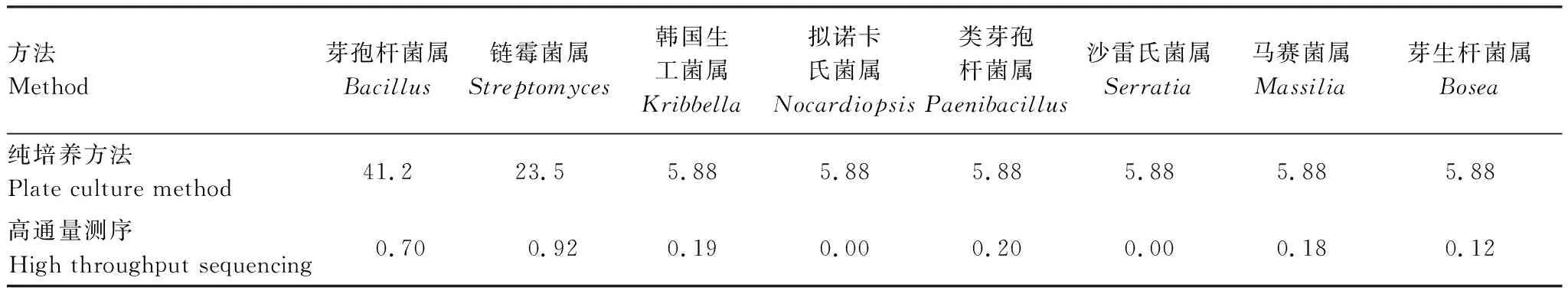
表4 根瘤内共生细菌在属分类单元的相对丰度差异/%
2.3.3 内共生细菌多样性差异
将沙棘根瘤内共生细菌的微生物多样性指数进行统计,结果表明,基于纯培养的根瘤内共生细菌香农指数为2.462,辛普森指数为0.754,而高通量测序得到的根瘤内共生细菌香农指数为4.967,辛普森指数为0.869,说明高通量测序检测到的内共生细菌的群落多样性要高于纯培养方法,同时也说明,沙棘根瘤内共生细菌群落结构更为复杂,群落更为稳定。
3 讨论
本研究通过纯培养和高通量测序方法检测马衔山中国沙棘根瘤内共生细菌,两种方法都表明中国沙棘根瘤内共生细菌具有丰富的多样性。在采用纯培养方法检测时,由于培养条件的影响,只得到相对较少的纯培养物,其根本原因可能是由于大量的微生物还未找到合适的培养条件[20]。沙棘根瘤内共生细菌的生长与一些生物因素和非生物因素也有关系,为了使实验室培养的营养条件更接近自然环境,在沙棘根瘤内共生细菌分离时,还应尝试模拟自然生态环境,以利于更多的内共生细菌被分离培养。
本研究中,采用纯培养方法检测到中国沙棘根瘤内共生细菌的优势属为芽孢杆菌属和链霉菌属。刘志强[21]和徐瑞瑞[7]等均对沙棘根瘤中的微生物进行过研究,也发现沙棘根瘤内共生细菌多样性丰富,但分离得到的根瘤内共生细菌的种类与本次研究得到的种类存在一定差异,说明植物内共生细菌多样性可能受植物种类、地理位置、生长环境和气候条件等因素的影响[22]。本研究中马衔山中国沙棘生长在海拔2800 m左右的高寒区,其根瘤内共生细菌的多样性与其所处的特殊生境有关[23]。
本研究采用高通量测序方法检测沙棘根瘤内共生细菌时,优势门为蓝细菌门、变形菌门、放线菌门和厚壁菌门,并且变形菌门、放线菌门和厚壁菌门的微生物在纯培养时也被分离到,说明分类单元越高,纯培养和高通量测序方法研究根瘤内共生细菌多样性的差异越小。蓝细菌门细菌分布极广,在极端环境中也能生长,还能与一些植物共生[24]。而蓝细菌门的微生物在本研究中利用纯培养方法分离时却未被分离到,因此,其在中国沙棘根瘤中的存在状况以及与沙棘之间的关系还有待进一步研究。
本研究在采用高通量测序方法检测沙棘根瘤内共生细菌时,优势属为弗兰克氏菌属和假单胞菌属。弗兰克氏菌能与沙棘共生形成根瘤[25],是沙棘根瘤内的绝对优势菌,其丰度达到17.7%。但采用纯培养方法分离时却未分离到弗兰克氏菌,可能因为弗兰克氏菌在人工培养条件下生长缓慢,离体培养需要2—3周或更长时间,且容易被杂菌污染[26]。本研究在中国沙棘根瘤内共生细菌分离过程中采用根瘤切片法,培养一段时间后,根瘤切片周围很快铺满生长较快的细菌菌苔,这也可能是阻碍生长较慢的弗兰克氏菌的生长繁殖的重要因素[27]。因此,探索合适的培养条件及合适的培养方法,缩短弗兰克氏菌生长周期,减少弗兰克氏菌离体培养中的污染,是非常必要的[28]。假单胞菌属为本研究中高通量测序检测到的仅次于弗兰克氏菌的优势菌,其丰度达到7.5%。假单胞菌属细菌广泛存在于各种生境中,包括植物的根瘤内[29],但本研究中利用纯培养方法分离时也未分离到此菌,可能与培养条件有关,假单胞菌属细菌与中国沙棘的互作关系也有待深入探究。已有研究也发现,在其他植物中发现的内共生细菌以假单胞菌属和芽孢杆菌属等为最常见的属[30]。本研究在沙棘根瘤中检测到的内共生细菌有一部分与上述其他植物内共生细菌相同,说明沙棘根瘤内共生细菌与其他植物内共生细菌也具有相似性。另外,本研究中纯培养分离得到的拟诺卡氏菌属和沙雷氏菌属,在高通量测序并未检测到,可能与高通量测序技术存在漏检有关。
尽管高通量测序能够更全面的反映中国沙棘根瘤内共生细菌的多样性,提供更多的生物学信息,对沙棘根瘤内共生细菌多样性研究具有指导意义。但传统纯培养方法仍为获取目标菌株的基本途径,在获取具有潜在应用价值的内共生细菌资源,并进行深入研究方面具有优势。如纯培养方法能分离得到一些具抑菌和促生活性的根瘤内共生细菌,这些内共生细菌产生的具有多种生理活性的代谢产物的开发具有广阔的应用前景[31]。
为了探明中国沙棘根瘤内共生细菌的多样性,需要展开进一步的资源调查,收集尽可能多的不同生境宿主来源的菌株,积累丰富的形态、生理生化指标,并建立精确可靠的分子特征数据库,更科学地界定这些内共生细菌的功能和分类地位。将高通量测序和纯培养方法相结合,既可以最大限度的反映沙棘根瘤内共生细菌的多样性,又能够有针对性的进行纯培养,收集到根瘤内共生细菌菌种资源,为后续研究提供材料。
4 结论
高通量测序和纯培养方法都表明中国沙棘根瘤内共生细菌具有丰富的多样性,但高通量测序方法能够较为全面的反映中国沙棘根瘤内共生细菌的群落组成,而纯培养方法仅能够分离到少数可培养的中国沙棘根瘤内共生细菌。
高通量测序和纯培养方法检测中国沙棘根瘤内共生细菌多样性时,分类单元越低,高通量测序方法检测到的微生物物种数越多,与纯培养方法相比具有越明显的优势。
高通量测序方法获得的中国沙棘根瘤内共生细菌多样性信息,为优化选择纯培养的适宜培养基及培养条件,实现有目的地分离特定物种奠定了基础。
