林木共生菌系统及其作用机制
——以杨树为例
2019-02-21袁志林潘雪玉
袁志林,潘雪玉,靳 微
中国林业科学研究院亚热带林业研究所,杭州 311400
杨树广泛分布于欧、亚和北美地区,多数种类具有较强的适应性[1-2]。作为重要的用材林和防护林树种,我国杨树人工林面积居世界首位[3]。杨树还是造纸业和生产生物乙醇的重要原材料,具有重要的生态价值和经济价值[4-5]。
拟南芥、水稻等是研究植物基础生物学和生命规律的模式物种。但树木有许多生物学特性与草本植物不同,如次生木质部组织、有规律的发育调控和长世代周期中需应对的环境胁迫等[6]。杨树具有生长快、成材早、无性繁殖体系成熟和易于更新等特点。同时,毛果杨(Populustrichocarpa)和胡杨(P.euphratica)等一批杨树基因组图谱的完成,极大推动了林木功能基因组学和发育生物学等基础研究[7-9]。不仅如此,杨树地上和地下部分可与多种微生物类群形成共生关系。上述生物学特性足以让杨树成为林木-微生物互惠共生机制研究的理想材料。
本文主要以杨树为例论述共生菌对林木生产力和适应性的重要贡献。首先详细介绍了杨树内生细菌(包括固氮菌)、根际促生菌、菌根真菌、内生真菌等多种类型共生菌的基础生物学特性及其功能,重点介绍了杨树-双色蜡蘑(Laccariabicolor)形成的外生菌根发育分子机制和卷缘桩菇(Paxillusinvolutus)提高杨树非生物胁迫能力的生理机制。在此基础上,对杨树-根际微生物形成的三重互惠关系(tripartite symbiosis,真菌-细菌-宿主)的现象与机理进行论述。另一方面,随着高通量测序技术和多组学分析平台的不断进步与完善,植物微生物组(microbiome,即在植物表面或内部生活的所有微生物类群遗传物质的总和,一般多指细菌和真菌)研究领域异常活跃,对微生物群落结构和功能的认识有了革命性的进步,使传统的“一种微生物,一种植物”双元互作体系拓展到“微生物群落-植物”的多元互作体系[10-11]。故此,本文还对近年来开展的杨树微生物组结构特征和组装机制等方面的最新研究进展进行归纳总结[12],并对今后该领域的发展趋势提出一些展望与思考。
1 杨树内生细菌及根际促生细菌
早在1951年,研究人员就发现了细菌与植物组织之间存在共生现象[13],当时这类细菌被普遍认为是病原物,但后来发现与细菌共生的植物并未表现出病症,且部分宿主的抗逆性有所增强。因此,这类栖息在健康植物组织内却不使宿主表现出任何病症的细菌被定义为内生细菌[14]。另外,Kloepper和Schroth首次提出了植物根际促生细菌(plant growth promoting rhizosphere bacteria,PGPR)的概念[15],即生活在土壤或附生于根系的一类可促进植物生长及矿质营养吸收,并能提高植物抗逆能力的一类细菌。PGPR主要通过溶解矿物质、分泌植物激素以及抑制病原微生物来发挥功能。可见内生细菌及根际促生菌是两类植物重要的有益细菌类群[16]。而开展杨树内生细菌功能和应用基础研究对杨树培育和土壤污染治理技术有重要的理论和实践指导意义。
1.1 内生细菌提高杨树抗病性及土壤污染修复能力
在杨树叶片、茎皮和根系组织中均有大量内生细菌栖息繁衍[5,17-18],特殊生境下的杨树如胡杨可能存在更丰富新颖的细菌种类[19]。然而,这些庞大的菌群扮演怎样的生态学功能,目前的认识还远远不够。通常认为,内生细菌可以控制宿主病害发生。杨树水泡型溃疡病(由病原菌Botryosphaeriadothidea引起)是杨树的常见病害之一,多危害大苗和幼树。胥丽娜等分离到一株杨树内生枯草芽孢杆菌(Bacillussubtilis),其发酵液能有效抑制B.dothidea菌丝生长和孢子萌发,并引起菌丝形态异常[20]。陈越渠等从杨树枝条中也分离到一株B.subtilisNS3,能够抑制13种常见的植物病原菌的生长,对杨树烂皮病(由病原菌Cytosporachrysosperma引起)和溃疡病的防治效果最好,具有一定的应用前景[21]。这些研究表明杨树内生细菌能产生活性较高的抑菌物质,从而能够直接减少病害发生程度。但这些细菌能否诱导杨树产生系统抗性(induced systemic resistance,ISR)仍不清楚。
杨柳科树种在土壤修复中表现出的优越性能已经被广泛认可。不仅如此,研究发现分离自杨树根、茎和叶片的多种内生细菌可有效降解单环芳香烃(BTEX)、三氯乙烯(TCE)和2,4,6-三硝基甲苯等多种污染物[22-24],在内生细菌中也检测到了与硝基芳香化合物降解相关的基因[25]。该项研究成果为建立高效林木-内生细菌的原位土壤联合修复模式提供了重要思路。
1.2 杨树根际促生细菌(PGPR)功能
有关PGPR对农作物、模式草本植物生长和抗性的调控机制研究已有海量文献,在此不再赘述。与内生细菌类似,杨树根际细菌也具有土壤重金属修复能力[26]。一株源于胡杨根际土壤的叶杆菌(Phyllobacteriumsp.)对重金属胁迫具有较强的耐性,并能促进Zn2+从根部转移至地上部分,从而减缓重金属对植株的伤害。杨树还可与广谱性根际细菌建立共生关系,如采集于松树根际土壤的多噬伯克霍尔德氏菌(B.multivorans)菌株WS-FJ9接种NL-895杨(Populus×euramericanacv. Nanlin 895)后增强了植株的光合效率,具有良好的开发前景[27]。
PGPR与内生细菌在概念上不易区分,很多PGPR也能侵染根系组织内部而成为内生细菌。但研究发现PGPR与内生细菌在功能上还是表现出差异。对杨树根际和根内生环境中19株荧光假单胞菌(Pseudomonasfluorescens)基因组比较分析发现内生荧光假单胞菌的溶磷能力、促生效应和蛋白水解酶活力等性状要优于根际荧光假单胞菌,因此可能对杨树表型的调控能力更强[28]。进一步研究发现,虽然接种内生荧光假单胞菌可改变杨树根系构型和叶片表型性状,却不能提高苗木光合效率和生物量积累,表明内生细菌可能只影响宿主碳水化合物的分配而对碳固定无明显贡献[29]。
由于细菌基因组较小且结构简单,测序技术的快速发展及成本的降低使得大样本细菌基因组精细图谱及比较基因组分析成为可能,这为深入解析杨树-细菌互惠机制提供了丰富的信息[30]。更重要的是,细菌基因组数据库的不断扩容,有助于快速推测杨树内生、根际细菌具有的功能(如激素、抗生物质、侵染能力和分泌系统等)和代谢途径,为实现在菌种资源库中“挑兵选将”、构建协同增效的功能菌群提供了有效途径[31]。
1.3 杨树内生联合固氮菌系统
森林土壤的可利用氮含量一般偏低[32],但研究发现很多树种可以通过与根瘤菌或放线菌形成根瘤结构来将空气中的氮气转化成植物可利用的形式,从而在氮含量匮乏的生境中迅速生长。目前已知根瘤菌和弗兰克氏菌等能与多种豆科与非豆科树种形成共生固氮体系,对提高林木氮素吸收意义重大。
在北美地区,毛果杨通常生长在氮含量极低的沙质土壤中,推测可能存在一种氮素高效利用模式[33]。虽未发现根瘤结构,但乙炔还原活性(acetylene reduction assay,ARA)测定结果表明在杨树中存在生物固氮现象。华盛顿大学Doty博士研究团队在温室培养的杂交杨中分离到具有固氮作用的内生热带根瘤菌(Rhizobiumtropici)[32]。随后该研究团队在原生境采集的杨树样本中分离出多种具有固氮作用的内生细菌。将分离所得菌株侵染番茄、玉米和水稻后,植株可在低氮培养基质中正常生长[34],说明这些固氮菌宿主范围较广。同样,将野生杨树群体中的内生固氮细菌接种杂交杨后,杂交杨的叶绿素含量及根系氮素水平均有所增加,且能提高杂交杨的抗旱性[35]。上述研究成果表明杨树内生固氮菌能促进非宿主植物的生长、养分吸收及抗逆性[36-37]。15N同位素示踪试验表明:在内生细菌侵染的杨树中,65%的氮元素来自于空气,且在杨树扦插条中检测到高浓度的15N同位素,这为明确杨树内生细菌固氮作用提供了最直接的证据[38]。由于内生固氮菌在杨树组织器官中分布不均,导致枝条间固氮效率有差异,但在茎和叶片组织中均检测出丰富的nifH基因[38]。根据生物固氮三种类型(共生固氮、自身固氮和联合固氮)的定义,可将杨树内生固氮归于联合固氮这一类型[39]。
目前已发现的杨树固氮细菌主要包括:从毛果杨中分离得到的Azospirillumbrasilense、Bradyrhizobiumsp.、Burkholderiavietnamiensis、Rhodospirillumrubrum、Rhodobactercapsulatus、Nostocpunctiforme、Methanococcusmaripaludis、Methanosarcinaacetivorans;从美洲黑杨(P.deltoids)中分离得到的B.vietnamiensis[40-42]。
2 杨树菌根
菌根是真菌侵染植物根尖后分化形成的一种特殊共生结构[43]。菌根真菌是土壤生态系统的重要组成部分,在改善植物营养吸收能力、增强植物适应性方面起重要作用[44-46]。国内外学者在菌根真菌资源调查、生态生理功能及菌根真菌在育苗造林和食用菌生产等方面已取得大量成果,带动了相关产业的发展。以中国林科院花晓梅研究员为代表的科学家领衔实施了林木菌根生物技术工程,在提高苗木质量及造林成活率等方面发挥了重要作用[47]。本章节内容介绍了杨树两种主要菌根类型(外生菌根和丛枝菌根)的研究现状,对杨树外生菌根发育分子机制及外生菌根真菌提高杨树耐盐性生理机制等方面进行详细评述。
2.1 杨树外生菌根真菌分布特征及生物多样性
外生菌根(ectomycorrhizas,ECM)的最主要特征就是真菌菌丝在植物根部皮层细胞间隙发育形成哈蒂氏网(Hartig net)并围绕根尖形成菌套(mantle)等结构[48]。外生菌根真菌影响着森林生态系统的健康和稳定,一些针叶树种(如松树)和阔叶树种(如栎类)在自然状态下严格依赖外生菌根真菌,否则难以存活[49-50]。在北美、欧洲和亚洲地区均开展过杨树外生菌根资源调查研究,调查的树种主要包括银白杨(P.alba)、黑杨(P.nigra)、美洲山杨(P.tremuloides)、小叶杨(P.simonii)、毛果杨和美洲黑杨等及相关的杂交杨品种。杨树外生菌根真菌(ectomycorrhizal fungi,ECMF)在分类地位上以担子菌居多,主要包括鹅膏菌科(Arnanitaceae)、丝膜菌科(Cortinariaceae)、红菇科(Russulaceae)、牛肝菌科(Boletaceae)、口蘑科(Tricholomataceae)和网褶菌科(Paxillaceae)等,少数物种属于子囊菌,如柔膜菌目(Helotiales)和盘菌科(Pezizaceae)[43]。杨树外生菌根真菌种类及相关信息详见表1[51-65]。值得一提的是,双色蜡蘑是目前研究最透彻的杨树外生菌根真菌,其全基因组信息已公布[66],这将有助于加深认识外生菌根形成、发育调控及信号转导等科学问题。

表1 杨树外生菌根真菌主要类群、调查方法及分布
本表格只列出每种杨树鉴定出的主要外生菌根真菌类群,低丰度物种尚未列出
2.2 杨树外生菌根发育的分子机制
在外生菌根形成发育过程中,宿主与真菌之间存在多种双向信号交流与响应机制。杨树-双色蜡蘑共生体系是研究林木外生菌根发育分子机制的理想模型。研究发现,双色蜡蘑可分泌某些挥发性倍半萜类小分子物质,在接触根系前就已经对杨树根系构型产生明显的调控效应,如导致次生根数量增加从而扩大杨树的根养分吸收表面积,这十分有利于双色蜡蘑从根系分泌液中获取更多的碳水化合物[67]。
在蛋白质参与的信号通路中,有一类被称为效应子(effectors)的小分子蛋白受到关注,即通常小于250个氨基酸、携带有分泌信号模块(secretion signal motif),可在另一有机体中引起表型和生理变化的小分泌蛋白家族(small secreted proteins,SSPs)[68]。双色蜡蘑基因组被破解之后[66],证实该菌存在大量编码SSPs的基因。Plett等[69]率先在双色蜡蘑中鉴定出对菌根形成和发育不可或缺的效应子MiSSP7(Mycorrhizal induced Small Secreted Protein 7,MiSSP7)。MiSSP7受根系信号刺激后通过内吞作用进入宿主细胞并定位在细胞核中,从而诱导宿主相关基因表达。Plett 等通过酵母双杂交方法鉴定出与MiSSP7互作的杨树PtJAZ6蛋白(茉莉酸信号通路抑制子)[70]。PtJAZ6在冠菌素(coronatine,与茉莉酸类化合物JAs具有相似的环戊烷结构,与JAs功能类似)存在下与茉莉酸受体蛋白 PtCOI1相结合,导致PtJAZ6发生泛素化而降解[71]。病原菌和从枝菌根真菌一般是通过激活茉莉酸信号途径来实现在根部细胞的成功侵染;而双色蜡蘑通过分泌MiSSP7与PtJAZ6的结合避免了PtJAZ6降解从而阻断茉莉酸信号通路相关的防御基因的表达,使菌丝顺利地在皮层细胞质外体空间定殖,最终发育形成哈蒂氏网,表明ECMF进化形成一套独特的侵染机制[70]。进一步研究还发现毛果杨同样会分泌SSPs,这些特异性SSPs可进入双色蜡蘑菌丝,在其细胞核中积累并诱导双色蜡蘑的某些功能基因表达,影响菌丝生长和形态,从而调节杨树-ECMF共生关系[68]。这表明SSPs的双向传输可能是维持菌根共生体正常发育并发挥功能的重要机制之一。
2.3 以卷缘桩菇(Paxillus involutus)为例论述外生菌根真菌增强杨树非生物胁迫能力的生理机制
外生菌根真菌增强杨树非生物胁迫(盐、干旱和重金属等)生理机制探索是近年的研究热点,已取得重要进展。MAJ和NAU分别是分离自杨树和栎树的外生菌根真菌-卷缘桩菇的两个耐盐菌株。MAJ菌株具有拒盐能力(salt-excluder),而NAU菌株在盐胁条件下具有更高的养分吸收能力(吸盐型)(salt-includer)[72]。MAJ接种银灰杨(P.canescens)后可形成正常的菌套和哈蒂氏网,盐胁迫会促使皮层细胞形成H2O2且激发过氧化反应;Na+亚细胞定位表明,MAJ形成的菌套不能作为一个物理屏障来有效保护过量盐分造成的伤害,故MAJ菌株只是在一定程度缓解而非阻止盐分对苗木的伤害[73-74]。
后续研究发现NAU菌株接种灰杨后不能形成典型的外生菌根结构,MAJ与NAU接种盐敏感银灰杨后皆可增强植株Ca2+和K+的吸收,而Ca2+可以调节盐胁迫下的K+/Na+平衡。其中MAJ主要通过改善宿主矿质营养吸收、调节渗透压及叶片脂肪酸组成来减缓叶片伤害[75];接种NAU菌株的根系在盐胁迫下呈现长期持续释放Ca2+的现象,减少宿主在盐胁条件下的K+损失并阻止Na+在根部细胞的积累,从而维持K+/Na+平衡[76-77]。在干旱胁迫下,MAJ菌株虽不能与胡杨形成外生菌根,但可加快胡杨可溶性糖的积累,提高了渗透压从而协助其耐旱[78]。在铅胁迫下,具有耐铅能力的卷缘桩菇菌株(非NAU和MAJ菌株)可促进宿主灰杨生长并增加其铅固定能力[79]。在镉胁迫下,MAJ菌株接种灰杨后促进Cd2+涌入根部细胞,同时也诱导了与Cd2+吸收、转运和解毒过程相关的基因表达并改善了灰杨的营养吸收,从而增强宿主的镉耐受性[80-81]。从应用角度看,进一步挖掘外生菌根真菌资源增强林木抗逆性,对推进盐碱地、重金属污染地区及干旱地区的生态修复造林工程有重要的开发价值。
2.4 杨树丛枝菌根
丛枝菌根(arbuscular mycorrhiza,AM)是球囊菌门(Glomeromycota)真菌菌丝定殖在根部细胞内部形成具有泡囊、丛枝等结构的共生体。丛枝菌根基本的营养交换方式通常认为是丛枝菌根真菌(AMF)向植物供给矿物质营养而植物将光合作用形成的碳水化合物提供给真菌利用。但最新的研究成果颠覆了上述传统认识:AMF更能利用宿主的脂肪酸类物质,即存在一种“揩油”行为[82]。有关杨树AMF多样性的研究报道在此不一一列举,此章节重点介绍杨树AM菌根的一些最新进展。
与其他AMF功能类似,接种根内球囊霉(Rhizophagusirregularis)和地表球囊霉(Glomusversiforme)能促进加拿大杨(P. ×canadensis)的生长和生理活性[83]。但也有例外,如Rooney等研究表明接种4种AMF真菌却抑制了杨树生长和磷素吸收[84]。在干旱胁迫下,根内球囊霉能提高加拿大杨渗透物质(如脯氨酸)含量、抗氧化水平并调节质膜多种水通道蛋白(plasma membrane aquaporins,PIPs)基因表达[85]。在盐胁迫条件下,根内球囊霉也能增强青杨(P.cathayana)的抗氧化能力,但这种效应可能依赖于杨树性别:雄株对菌根的依赖性比雌株高,接种后的雄株芽形态生长优于雌株[86]。在干旱条件下,丛枝菌根真菌可增强青杨抗氧化系统并促进雄株芽、根的生长和生物量的积累,而对雌株的生长及生理代谢则无明显影响[87]。在重金属胁迫实验中,也证实存在菌根效应的杨树性别差异;接种根内球囊霉会促进美洲黑杨雄株根系的镉富集能力,且能够阻碍金属离子向地上器官输送,但在雌株根系中该生物学效应却不明显[88]。木本被子植物中有很多种类是雌雄异株的,如杜仲科、杨柳科、大戟科等[89],因此从基因、分子水平解析这种与杨树性别有关的菌根效应的决定机制,对于深入认识林木菌根的生态学功能具有重要的科学意义。目前只在AM中发现此现象,在ECM中是否也存在类似生物学行为有待进一步探究。
杨树AM营养基础理论研究偏少,AM共生体氮素的吸收、代谢和运输机制是重要研究方向之一。基于互作转录组测序(dual RNA-seq)方法,发现氮素缺乏会导致根内球囊霉中有关细胞生长、生物膜合成和细胞结构成分相关的基因高度富集,而且菌丝中负责转运铵盐、硝酸盐和磷酸盐等的蛋白被激活;相反,无论在高氮还是低氮条件下,根内球囊霉都能诱导毛果杨中上述转运蛋白的高表达。因此AM菌根对提高杨树氮素有效性(nitrogen availability)及利用效率发挥着重要功能[90]。
需要指出的是,在一定环境下杨树如大齿杨(P.grandidentata)、窄叶杨(P.angustifolia)和美洲山杨(P.tremuloides)等根系可同时形成AM和ECM。研究表明树龄、土壤深度和土壤湿度等生物因子和环境因子对AM和ECM的分布格局和相对丰度有较大影响[91-92]。一般认为在杨树形成混合菌根条件下,ECM对杨树的增益作用可能优于AM[93]。Chen等较为系统地比较了AMF和ECMF单独和混合接种对桉树生长的差异,也证明ECMF在接种后期占据优势,而且对根系生长调控和苗木生物量积累要比AMF显著[94-95]。
3 杨树内生真菌及生物学功能
内生真菌(endophytic fungi)分布极其广泛,指生活在健康植物组织(根、茎、叶、花、果实等多种器官)内,不表现出明显病症的一类真菌。与松树、栎树等菌根发达的树种相比,杨树在多数生境下形成菌根的能力相对较弱,这间接反映了内生真菌对杨树生长及环境适应性的重要意义。杨树根系内生真菌物种高度的遗传多样性支持了该假设[12]。内生真菌的分布特征、物种多样性、传播方式和作用机制等均有别于菌根真菌或其他共生菌。近年来杨树内生真菌生理生态功能研究越来越受到学者关注。
我国学者开展了美洲黑杨杂种无性系NL-80351杨(P.deltoides‘harvard’×P.deltoidescv. ‘lux’)、美洲黑杨无性系(P.deltoides)和欧美杨(P.euranericana)休眠芽、叶片、树皮和枝条等组织内生真菌分离培养和鉴定工作[96-99],发现某些菌株对杨树烂皮病病原菌壳囊孢(Cytosporasp.)有一定的拮抗作用。Yan等利用ITS2基因序列和二级结构揭示了杨树叶片优势内生真菌-假尾孢菌(Pseudocercosporaspp.)的遗传多样性[100]。德国学者对我国胡杨叶片内生真菌也有初步研究[101]。分离自毛果杨茎皮的一株禾本红酵母(Rhodotorulagraminis)和毛果杨美洲黑杨杂种(P.trichocarpa×P.deltoides)茎皮的粘质红酵母(R.mucilaginosa)可以促进苗木生长和插条生根[41,102]。Martín-García 等基于ITS序列分析比较了西班牙北部黑杨和欧美杨无性系I-214细枝内生真菌群落结构[103]。目前对杨树根系内生真菌物种多样性和功能的研究比较深入[104-106]。嗜根小纺锤菌(Atractiellarhizophila)是最近发表的分离自美洲黑杨根系的一个真菌新种,在分类地位上隶属于担子菌的柄锈菌亚门(Pucciniomycotina)[105]。研究还发现A.rhizophila在全球分布广泛且宿主范围广(在松树、兰科植物及农作物根系中均有分布)。接种试验表明A.rhizophila菌株能够显著促进苗木生长及光合效率。最近笔者在舒玛栎(Quercusshumardii)一年生实生幼苗菌根根尖中也分离到一株A.rhizophila,但是否表现出类似的生物学效应值得进一步探讨。
此外,笔者实验室前期对我国南方地区多个杨树品种根系内生真菌进行了初步调查并与国外相关报道进行比较分析,发现子囊菌中的格孢腔目(Pleosporales)、柔膜菌目(Helotiales)中无柄盘菌(Pezicula)及低等菌中的被孢霉(Mortierella)可能是杨树根系内生真菌的常见类群(generalists)(结果未发表)。
3.1 杨树根系暗色有隔内生菌
在杨树根系还存在一类被称为暗色有隔内生菌(dark septate endophytes,DSEs)的特殊真菌类群。DSEs菌丝具隔膜,常呈黑褐色,侵染根系皮层细胞后形成微菌核(microsclerotia)结构。DSEs以子囊菌居多,少部分是担子菌[107-108]。虽然DSEs在自然界中广泛分布,有关杨树DSEs的生态学功能近年才被逐步揭示[109-110]。从杨树生物修复金属污染样点中分离得到的DSEs菌株可侵染多种植物(桦树、桉树和黑麦草)根系,具有促进宿主植物生长,增强宿主金属耐受性的特点。在中度微量元素污染土壤中,接种DSE真菌Leptodontidiumsp.可增加杨树(P.tremula×P.alba)的株高;而轻度污染土壤中,接种DSE菌株的杨树株高和干重均高于对照组。此外,甘瓶霉(Phialophoramustea)和背芽突霉(Cadophorasp.)可促进杨树根系生长,还可增加杨树P、K等营养元素的吸收效率[109-110]。在开展重金属污染修复试验区生长的两种杂交杨根系真菌群落研究中发现,几种内生真菌的重金属耐受性普遍强于外生菌根真菌-滑锈伞菌(Hebelomasp.),其中一株内生柔膜菌和一株内生担子菌(Serendipitavermifera)可成功侵染杨树根系并形成微菌核结构,且具有显著的促生效应[64]。如前所述,杨树根际细菌、内生细菌在土壤污染治理中也具有重要的应用前景,因此今后可以考虑建立DSEs-细菌-杨树复合共生体系,有望能进一步提高土壤修复能力。此外,研究发现一株源于盐地碱蓬(Suaedasalsa)根系的内生弯孢霉(Curvulariasp.),接种到毛白杨(P.tomentosa)无性系幼苗根系后可在皮层和根毛细胞中形成微菌核的侵染结构,且在盐胁迫条件下该菌株能提高杨树的光合效率[111]。上述一系列研究表明,DSEs可能是一类能够提高杨树非生物胁迫能力的重要根系真菌类群。
3.2 杨树叶片内生真菌与抗病抗虫相关性研究
亚利桑那州立大学Arnold团队首次发现可可树(Theobromacacao)混合接种叶片优势内生真菌菌群可以显著减少由棕榈疫霉(Phytophthorapalmivora)引起的病害[112],这可能与诱导树木抗病相关基因的表达有关[113]。杨栅锈菌(Melampsorarostrupii)是一种严重危害杨树生产的世界性重大真菌病害,主要危害幼苗和幼树。Raghavendra和Newcombe在控制试验中发现接种杨树叶片内生葡萄穗霉(Stachybotryssp.)、深绿木霉(Trichodermaatroviride)、黑细基格孢(Ulocladiumatrum)和狭截盘多毛孢(Truncatellaangustata)等菌株可增强毛果杨对杨栅锈菌的抗性[114];但接种内生真菌后表现出的叶片锈病抗性只是局部效应,未接种内生真菌的叶片并无抗病性,即叶片接种内生真菌后没有产生对锈病的系统抗性。这种抗性主要是基于微效基因(minor genes)控制的数量抗病性(quantitative resistance)或水平抗性(horizontal resistance),因为这些内生真菌不能诱导基于宿主主效基因(major genes)控制的垂直抗病性(vertical resistance)。更有趣的是,接种深绿木霉不能提高宿主窄叶杨(P.angustifolia)对白杨盘二孢病菌(Drepanopezizapopuli-albae,无性型为Marssoninacastagnei)的抗性[115];有的内生真菌甚至会加重杨树叶片病害程度[115]。可以看出杨树叶片内生真菌调控病害的机制可能比较复杂。为了进一步弄清楚在野外条件下杨树锈病发生是否与叶片内生真菌群落结构存在相关性,研究人员通过分离培养和群落高通量测序方法建立了大尺度下毛果杨叶围真菌(包括附生菌和内生菌)种类、丰度与病害发生的相关性模型[116]。研究发现木霉(Trichoderma)和枝孢霉(Cladosporium)等内生菌与病害发生呈显著负相关,表明这两个种类是杨树锈病的拮抗菌。相反,链格孢菌和另一种枝孢霉则有利于病害发生。研究结果为快速挖掘拮抗真菌资源应用于防治提供了重要策略。此外,杨树叶片内生真菌可能还可缓解宿主受食草动物取食的压力。欧洲山杨(P.tremula)叶片内生短梗霉(Aureobasidiumsp.)的侵染程度与蓝弗叶甲(Phratoravitellinae)引发的叶片虫害呈显著负相关,但对黑星病菌(Venturiatremulae)的发生无明显调控作用[117]。
3.3 根系内生真菌对杨树生长调控的可塑性
很多研究都发现内生真菌对草本植物、林木的增益作用是在一定条件下表现的。不同接种共培养方式和培养基质氮素形态可以改变林木-真菌的共生关系和互作结果。印度梨形孢(Serendipitaindica,曾用名为Piriformosporaindica)是一种广谱促生内生真菌,在杂交无性系杨树(P.tremula×P.tremuloides)Esch5与印度梨形孢共生体系中,幼苗在WPM培养基(Woody Plant Medium,木本植物专用)预培养一段时间后接种印度梨形孢,发现根系生物量和次生根数量显著增加;而将杨树幼苗移栽到预培养有印度梨形孢的WPM培养基中时,根系及整株幼苗生长严重抑制;延长共培养时间还会导致真菌侵染杨树茎皮和叶片[118]。这表明只有在适度菌丝侵染量才能建立与宿主的和谐平衡关系。笔者也发现分离自琴叶栎(Quercuslyrata)外生菌根的一株斜盖伞菌(Clitopilussp.)与北美枫香(Liquidambarstyraciflua)无菌实生幼苗建立共生体系时,菌株低剂量及晚接种将有效促进枫香根系的生长及植株生物量积累(待发表),实验结果支持上述结论。此外,当培养基质的氮素从有机氮、硝态氮换成铵态氮时,印度梨形孢可能会合成某种真菌毒素[118]。笔者发现在DSEs-植物共生体系中,只有在有机氮条件下,DSEs才能表现出明显的促生效应;当培养基质为无机氮时,大部分DSEs对植物生长无显著影响甚至是抑制生长[119]。以上研究结果对高效、科学筛选促生、抗逆内生真菌菌株具有重要的参考价值,以免由于接种方式或培养基质的不合理使用,导致某些功能菌株在筛选试验中过早被丢弃。
4 杨树微生物组研究概况
近年来,环境样品微生物群落高通量测序技术和生物信息学分析手段的快速发展,助推了微生物组研究。以北卡罗莱纳大学Jeff Dangl 教授和马普植物育种研究所 Paul Schulze-Lefert 教授为代表的研究团队领衔实施了拟南芥、玉米等模式生物根际微生物组大规模测序工作并取得重大进展[120-122],揭示了核心微生物组成员及微生物组构成的遗传调控机制。宏基因组及大样本功能细菌的全基因组测序分析在挖掘菌群功能方面已有所突破[123-124]。同时,以杨树为材料的林木微生物组研究也取得了一系列成果,如完成了美洲黑杨、毛果杨和胶杨(P.balsamifera)等微生物组图谱分析[5,125-127],研究了土壤因子、气候、海拔、地理位置和宿主基因型对根际和叶围微生物群落结构的影响。发现根际和根内生两个微区域微生物群落结构组成和多样性特征迥异[5,125],推测在杨树中存在一种选择性招募不同真菌类群的生物过滤机制,而且不同基因型的真菌群落在经杨树两代无性繁殖后仍然存在,表明这种在特定基因型杨树中适应良好的真菌类群与宿主之间可能存在专一性的互作关系[127]。
转基因杨树的释放对环境的潜在影响也可以通过研究根际微生物群落结构的变化来间接评估。Zhu等研究表明转多基因(枯草杆菌果聚糖蔗糖酶基因(SacB)、透明颤菌血红蛋白基因(vgb)、双价抗蛀干害虫基因(BtCry3A+OC-I)及调节基因(JERF36)杨树无性系D520和D521对根际细菌群落没有显著影响[128]。转基因杨树虽然对根际真菌群落结构(包括ECMF)无显著影响,但对非根际土壤真菌群落演替更新具较明显影响[60,129]。Danielsen等研究的结果表明:银灰杨中肉桂醇脱氢酶(木质素合成关键酶)基因沉默后并不会影响根部及土壤中的真菌群落[62]。但最新一项研究发现,将杂交杨(P.tremula×P.alba)中编码肉桂酰辅酶A还原酶(木质素合成关键酶)基因沉默后,与野生型杨树相比,根系内生细菌群落结构及代谢特征发生显著变化,而根际细菌群落与野生型杨树大部分有重叠,这表明杨树基因组的微小变化就能够实现对内生菌微生物组的有效调控[130]。综上可以看出,转基因杨树对根际微生物的组成和活力影响较小,而对内生菌群落结构影响较明显。这可能与内生菌-宿主细胞之间结构性整合特征有一定关系。
5 细菌-真菌-杨树形成三重跨界共生
植物(尤其是林木)与根际微生物通常形成多重互惠关系,比如在栎树(Quercuscrassifolia)的单个根尖组织中就鉴定出44 种ECMF类群[131]。此外,细菌细胞间的群体效应系统(quorum sensing)、菌根辅助细菌促进菌根发育、菌丝内共生细菌、根瘤菌与菌根菌协同增效等菌-菌互作形式更反映了林木根际微生物多重互惠关系的复杂性。本文重点评述两类细菌-真菌-杨树之间形成的三重跨界共生方式。
菌根辅助细菌(Mycorrhiza Helper Bacteria,MHB)是可刺激菌根共生体系形成的一类细菌的统称[132]。MHB可以增强菌根真菌孢子萌发及存活率,在共生关系形成前刺激菌丝生长[133],增加营养根对真菌信号的接受能力,最终影响菌根共生体的生理生态功能。在杨树根际微生物组研究中已鉴定出大量菌根辅助细菌,其中假单胞菌(Pseudomonas)是MHB的重要成员之一。Labbé等发现假单胞菌可提高双色蜡蘑菌丝的生长密度并改变菌丝分枝的角度[133]。MHB与菌根真菌之间相互识别的信号分子的物质基础目前仍未取得实质性进展[134]。同时,双色蜡蘑-假单胞菌的多种组合接种可以促进杨树次生根的生长。菌根辅助细菌-菌根真菌-杨树形成的亲密互惠关系,对于理解杨树人工林生产力形成机制具有重要的理论价值[133,135]。
Bonito等在美洲杨树根系内生真菌群落研究中分离到多株长孢被孢霉(Mortierellaelongate)[104],该菌只能利用简单的糖类和氨基酸作为碳源,不能利用纤维素和木质素。接种试验表明长孢被孢霉能促进多种植物的生长(与橡树岭国家实验室Labbé Jessy博士私人通讯)。进一步研究发现长孢被孢霉菌丝细胞内被一种命名为新属的内共生细菌(endohyphal bacteria,EHB)-Mycoaviduscysteinexigens定殖。系统发育基因组学(phylogenomics)分析表明两者约在3.5亿年前已经建立了共生关系[136]。M.cysteinexigens的基因组特别小(2.6M),缺失了很多代谢途径,间接说明了M.cysteinexigens对宿主真菌具有较强的依赖性。Li 等整合蛋白质组和代谢组分析技术解析了M.cysteinexigens从长孢被孢霉获取碳氮源的方式[137]。需要指出的是,在丛枝菌根和外生菌根真菌的孢子或菌丝细胞内同样发现有EHB,可以随真菌宿主的繁殖、传代而延续(垂直传播方式)[138]。这表明该生态学现象具有一定的普遍性,与植物种子传播的内生菌具有相似的生物学行为。然而多数EHB细菌难以在人工培养基生长,给研究带来一定困难。不难看出,这种细菌-真菌-杨树之间的三重互作与菌根辅助细菌-真菌-杨树的互惠关系可能有本质的区别。
6 展望
杨树地上地下共生菌系统具有构成的复杂性和功能的多样性(图1)。更多微生物全基因组测序工作的开展,有望阐明更多的共生机理。无论是双元还是多元(混菌)互作,目前开展的工作基本以正向策略来揭示共生菌对杨树生长、生理和适逆的影响,即通过传统分离培养方法获得菌种资源库,再结合接种方法来验证菌株的功能。然而这种研究策略通常比较耗时费力,更重要的是不能全面反映根际微生物群落对宿主表型和生理的调控效应。近年来,以根系为诱饵、通过宿主表型来推测菌群功能的反向“钓鱼”策略已经在少数几种草本植物中开展[139-141],被认为是根际微生物组工程未来的重要研究方向。建立树木-微生物群落互作模型,将加深认识多元土壤微生物群落对林木生产力和适应性的耦合机制。总之,通过正向和反向筛选策略、重组根际功能菌群,有望为今后创制新型菌剂、应用于高效育苗和林木抗性育种等方面提供新的思路。
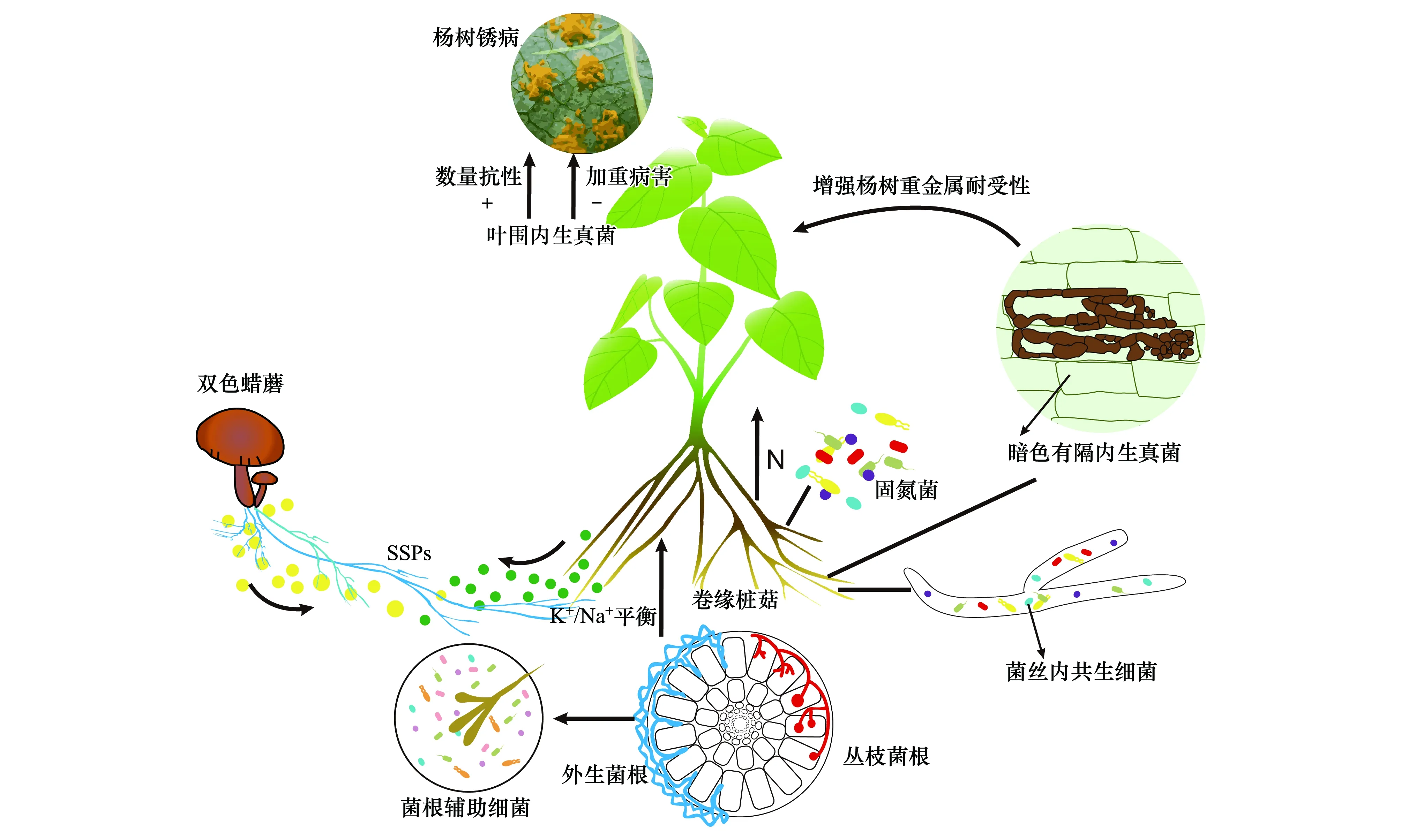
图1 杨树地上和地下部分共生菌类型、互惠机制及主要功能Fig.1 Conceptual illustration of the poplar-associated microbiota and their potential functions杨树锈病(Melampsora)图片仿自https://jgi.doe.gov/news_11_05_03/
