饲料中添加脱毒剂对异育银鲫肌肉中恩诺沙星残留的影响
2019-02-21胡雅楠白卓安韩雨哲叶仕根王连顺刘真卫任同军
■胡雅楠 白卓安 周 婧 韩雨哲 叶仕根 王连顺 刘真卫 任同军*
(1.大连海洋大学农业农村部北方海水增养殖重点实验室,辽宁大连116023;2.北京二商生物科技有限公司,北京100000)
恩诺沙星(Enrofloxacin)又名乙基环丙沙星、恩氟沙星,属于氟喹诺酮类(Fluoroquinolones,FQs),是第三代喹诺酮类(Quinolones)药物,广泛应用于水产动物感染性疾病的预防和治疗[1]。随着我国水产养殖集约化程度不断提高,水产动物病害迅速增多,对鱼药的需求大大增加,滥用药物等时有发生,致使鱼体药物残留超标,药物富集,危害食品安全。在贵阳市场检测淡水鱼体内中氟喹诺酮类抗生素(FQs)的残留情况发现,恩诺沙星和氧氟沙星残留量均超过最大允许限量[2]。鱼药在动物体内残留得到社会广泛关注。
鲫(Carassius auratus),属鲤形目,肉细嫩,味鲜美,为重要食用鱼类和养殖对象[3]。近十多年来,随着我国水产品进出口量的持续增长,鲫鱼的养殖规模和养殖潜力也越来越大,其2016年总产量现已超过300万吨,是产量稳定持续增长的淡水经济鱼类之一,在我国的淡水养殖中占据十分重要的地位[4]。
研究表明,恩诺沙星在水产动物体内代谢消除速率比较慢,需要较长的停药期[1]。目前对恩诺沙星在水产动物的研究,主要在机体内的药物动力学及代谢消除速率等方面的研究,对降低水产动物体内恩诺沙星的残留量或加快恩诺沙星在机体内代谢的研究很少。本研究以异育银鲫(Carassius auratus gibelio)为试验对象,采用拌料给药方式,研究异育银鲫口服新型脱毒剂后,体内恩诺沙星及代谢产物的残留量,控制恩诺沙星及其代谢产物在异育银鲫体内残留,为水产养殖行业提供用药参考。
1 材料与方法
1.1 试验饲料
试验饲料以鱼粉、豆粕、玉米面、面粉、米糠、预混料、微晶纤维素为主要原料,将其混合均匀制作成基础饲料(C),恩诺沙星组(E)饲料在基础饲料中添加恩诺沙星(北京索莱宝科技有限公司,纯度≥98%),脱毒组(RE)饲料在基础饲料中添加脱毒剂(北京二商生物科技有限公司)。具体饲料配方见表1。将饲料成分混匀后,放入制粒机(东南干燥设备有限公司,XL-250)压成粒径为3 mm的颗粒。饲料做好后放入-20℃冰箱保存。
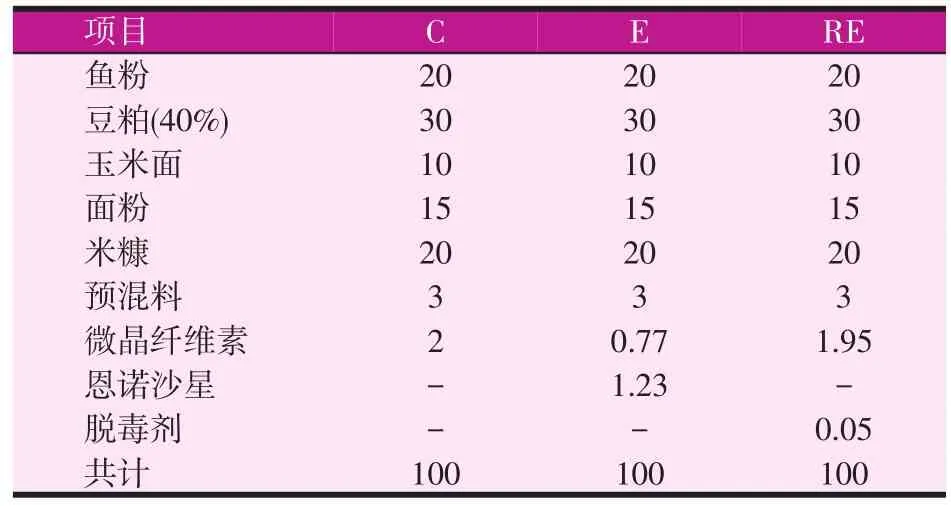
表1 饲料配方(g/100 g)
1.2 试验鱼及饲养
健康无病害的异育银鲫来自于上海市海丰水产养殖有限公司,光明渔业养殖场,初始体重[(204.5±10.30)g]的126尾。试验前将鲫暂养一周并投喂基础饲料以适应试验环境。试验前禁食24 h,将126尾试验鱼随机分配到2×3个1吨圆形水槽中,每槽21尾,分为两组,每组3个重复。24 h连续充气。饲养试验进行28 d,期间每天按照体重的1.5%投喂一次(18:00),投喂0.5 h后利用虹吸法吸取残饵粪便,吸污后换水,换水量占总水体的1/3。养殖过程中每日观察鱼的摄食情况,水体温度为17.2~18.0℃,溶解氧大于6 mg/l,pH值为7.3~7.8(n=28)。
1.3 试验方法与样品采集
1.3.1 建立抗生素模型
驯养后,对照组投喂基础饲料(C),恩诺沙星组(E)投喂含有恩诺沙星的饲料。6 d后,饥饿处理24 h,每缸随机取3条试验鱼测定其体重,之后用2 ml注射器鱼尾静脉采血(提前用肝素钠溶液润洗),4℃静置24 h,4 ℃、3 000 r/min离心10 min,取上清,用于测定血清酶。取血后于冰袋上解剖,取出肝胰脏,置于液氮中速冻,再保存到-80℃冰箱中用于分析非特异性免疫活性,取肌肉保存到-20℃冰箱,用于测定恩诺沙星含量。
1.3.2 脱毒试验
将已建立抗生素模型的试验鱼均分为两组,分别投喂添加脱毒剂的饲料(RE)和基础饲料(GE)连续投喂21 d。分别在试验第14、21 d和28 d,每缸随机取3条,取肌肉检测恩诺沙星含量。28 d后参照第6 d方法采样测定血清及肝胰脏的非特异免疫酶。
1.4 恩诺沙星含量测定
1.4.1 提取和净化
取鱼肌肉适量捣碎均匀,称取均质肌肉5.0 g,置于50 ml聚丙烯离心管中,加入20 ml 0.1 mol/l EDTA Mellvaine缓冲液,1 000 r/min漩涡混合1 min,超声提取 10 min,4℃下1 000 r/min离心5 min,提取三次,合并上清液。HLB固相萃取柱(20 mg,6 ml),使用时用6 ml水活化。将上清液以2~3 ml/min的速度过柱,弃去滤液,用2 ml 5%的甲醇水溶液淋洗,将小柱抽干,再用6 ml甲醇洗脱并收集洗脱液。用氮气吹干洗脱液,用1 ml 0.2%甲酸水溶液溶解,1 000 r/min漩涡混合1 min,用于Agilent(6470)高效液相色谱仪测定。
1.4.2 色谱条件
色谱柱为反相色谱柱C18柱(100 mm×2.1 mm,1.7 μm),流动相为A(甲醇∶乙腈溶液=40∶60)和B(0.2%甲酸溶液),流速为0.2 ml/min,激发波长为280 nm,发射波长为 450 nm,柱温为 40℃,进样量为20 μl。在该色谱条件下,恩诺沙星(20 ng/ml)的保留时间分别为5.84 min。
1.5 肝胰脏非特异性免疫指标测定
准确称取组织样品,在4℃冰箱缓溶,肝胰脏按质量体积比1∶9(W/V)的比例加入0.9%的生理盐水,在冰浴条件下匀浆制成组织匀浆,之后以2 500 r/min,4℃条件下,离心10 min,取上清液保存在-80℃备用。肝胰脏抗氧化酶:碱性磷酸酶(AKP)、过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、总抗氧化能力(TAOC)和丙二醛(MDA)均使用南京建成生物工程研究所的试剂盒测定。
1.6 血清酶测定
鲫的血清酶主要使用迪瑞CS-300B全自动生化分析仪(长春迪瑞医疗科技股份有限公司)检测谷草转氨酶(AST)、碱性磷酸酶(AKP)和肌酐(CREA)。
1.7 数据处理及统计分析
数据以“平均值±标准差(mean±SD)”表示,试验结果用SPSS 21.0软件进行单因素方差分析,用Tukey's多重比较对全部处理组进行方差分析,检验组间差异是否显著,以P<0.05为显著性差异。
2 结果与分析
2.1 脱毒剂对恩诺沙星在鲫肌肉中残留的影响(见图1)
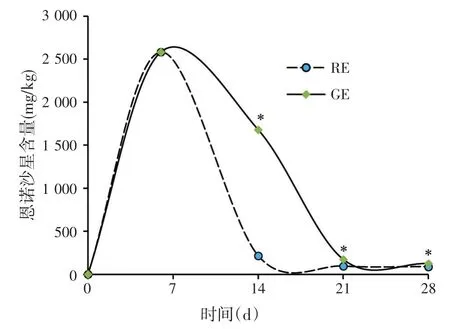
图1 饲料中添加脱毒剂对鲫肌肉中恩诺沙星含量的影响
如图1所示,饲料中添加脱毒剂能够显著降低鲫肌肉中恩诺沙星含量。RE组鲫肌肉中的恩诺沙星含量分别在14、21 d和28 d比GE组降低87.08%,44.97%和28.97%(P<0.05)。RE组鲫肌肉中的恩诺沙星含量在7~14 d时消除速度较快,14 d后消除速度变慢直至21 d后基本趋于平稳。GE组21 d后,恩诺沙星在鲫肌肉中消除速度趋于平稳。
2.2 恩诺沙星对鲫肝胰脏抗氧化能力及MDA含量的影响(见表2)
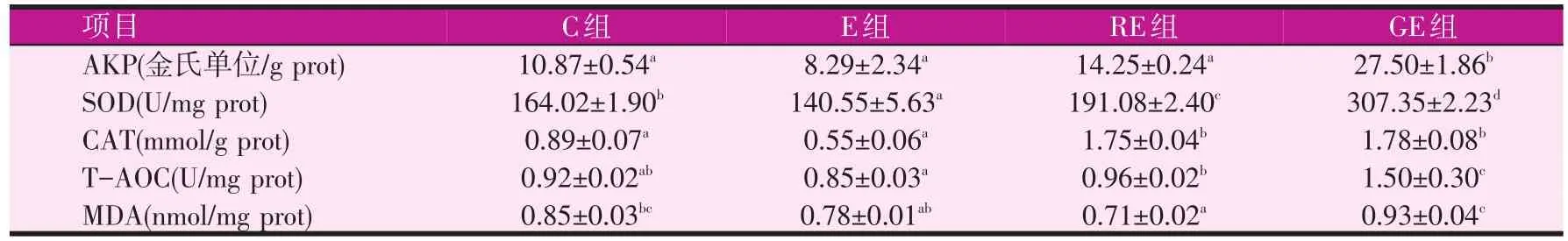
表2 饲料中添加脱毒剂对鲫肝胰脏酶活的影响
如表2所示,与C组相比,投喂恩诺沙星6 d后,E组SOD活性显著下降(P<0.05),AKP、CAT、T-AOC活性和MDA含量都略有下降,但无显著性差异。随着RE组恩诺沙星的减少,肝胰脏AKP、SOD、T-AOC活性和MDA含量显著低于GE组(P<0.05)。
2.3 恩诺沙星对鲫血清酶的影响(见表3)

表3 饲料中添加脱毒剂对鲫血液酶活的影响
如表3所示,投喂添加恩诺沙星的饲料6 d与对照组相比,E组的AST和AKP活性都显著升高,28 d后,RE组AST和AKP活性显著高于C组,且AST活性显著低于GE组(P<0.05)。CREA均无显著差异(P>0.05)。
3 讨论
3.1 脱毒剂对恩诺沙星在鲫肌肉中残留的影响
药物在牛、犬、兔、鸡等动物体内发生代谢反应的类型和程度不尽相同,恩诺沙星在异育银鲫体内以原药存在形式达98%,部分恩诺沙星脱乙基后可以产生活性代谢物环丙沙星(<0.30%)[5]。本研究结果发现,采取拌料给药的方式给予鲫恩诺沙星后,鲫肌肉中有大量恩诺沙星蓄积,这与徐维海等[6]研究结果相似。RE组鲫肌肉中的恩诺沙星含量分别在14、21 d和28 d比GE组降低87.08%、44.97%和28.97%(P<0.05)。且RE组鲫肌肉中恩诺沙星的含量在14 d低于安全浓度(<100 μg/kg)[7],但GE组鲫肌肉中恩诺沙星含量在28 d时,仍然高于安全浓度。由此饲料中添加0.05 g/100 g的脱毒剂促进了恩诺沙星在鲫体内的消除,降低了恩诺沙星的残留量,缩短了恩诺沙星的休药期。药物在体内的代谢反应通常分为Ⅰ相反应(又称引入官能团反应,包括氧化、还原、水解和异构化等)和Ⅱ相反应(即结合反应,药物或者Ⅰ相代谢产物的极性基团与内源性物质生成结合物)[8]。恩诺沙星在体内的Ⅰ相代谢反应是N-去烷氧化,其中细胞色素酶P450发挥重要作用。另一方面陈念祖等[9]研究表明硒能够提高细胞色素氧化酶的活性。由此推测脱毒剂中含有的硒增强了细胞色素氧化酶,加快了恩诺沙星N-去烷氧化,促进了恩诺沙星在鲫体内的代谢。
3.2 恩诺沙星对鲫肝胰脏抗氧化能力及MDA含量的影响
肝脏的代谢功能主要依赖于肝内酶的作用,肝内酶含量及种类极其丰富,同时肝脏是外源性化合物在体内进行生物转化的主要器官,当外源性中毒引起动物肝脏发生损伤时,相应地引起血清中一系列相关酶发生变化[10]。AKP是一种对底物专一性要求较低的磷酸单酯水解酶,是重要的解毒系统,广泛存在于动物的血液和各种器官内,能够通过改变病原体的表面结构,增强被侵袭机体对病原体的识别和吞噬能力,是水产动物生理活动和疾病诊断的一项重要指标。朱建勇等[11]研究表明恩诺沙星对鲫鱼的AKP具有一定的诱导作用,在给药后的第5 d,药物在鱼体肝脏和肾脏组织内浓度逐渐升高,到第10 d,肝脏和肾脏的AKP活性达到最高水平。本试验结果显示,AKP活性在28 d后仍然显著高于C组,但RE组显著低于GE组,原因可能是RE组恩诺沙星含量显著低于GE组,RE组肝胰脏功能开始恢复。SOD是一种重要的抗氧化酶,通过清除氧自由基来防止生物分子损伤。SOD是生物体内唯一的以为底物的酶,可催化发生歧化反应生成 H2O2,反应方程式为+。Wise等[12]曾报道,长期使用恩诺沙星,对鱼的肝胰脏有较大的毒副作用。熊铧龙等[13]研究表明杂交鲟肝脏抗氧化酶活性随着恩诺沙星的暴露呈先诱导后抑制变化,且酶被诱导时间随恩诺沙星的质量浓度升高而下降。本试验高质量浓度恩诺沙星处理鲫6 d后,SOD活性显著下降,已经处于抑制阶段。28 d后,恩诺沙星含量已低于安全浓度,SOD活性显著高于C组,应处于诱导阶段。这与环丙沙星处理鲫后GSH活性变化类似[14]。聂湘平等[14]推测随着暴露时间的延长和恩诺沙星浓度下降,恩诺沙星不足以对酶蛋白产生了破坏时可能对SOD合成的酶活性产生诱导,导致SOD合成增强,含量增加。GE组恩诺沙星含量显著高于RE组,其SOD含量也受诱导作用较强。过氧化氢在CAT的作用下生成水和氧气,消除氧自由基对机体的氧化损伤[15],本试验恩诺沙星处理6 d后CAT无显著性变化,28 d后,RE组和GE组CAT活性显著高于对照组和E组,可能是异育银鲫体内CAT活性的响应比较滞后于药物的积累时间。随着暴露时间的延长和恩诺沙星浓度的下降,恩诺沙星对CAT的合成产生诱导作用。T-AOC就是一个体系中的大小分子和酶总和的水平,体现了该体系的抗氧化能力总和[16]。当污染物存在,机体为了要清除因污染物胁迫产生的提高的氧自由基量而加快了抗氧化酶蛋白的合成,造成酶分泌的增加,这是机体正常的应激反应[17]。GE组T-AOC显著高于RE组,应该是鱼体内仍然存在较高的恩诺沙星,对鲫肝胰脏抗氧化能力的应激作用。且值得注意的是,MDA是脂质过氧化的最终产物,并且测量MDA水平可以反映动物的脂质过氧化程度。在外部环境破坏的情况下,氧自由基会攻击多不饱和脂肪酸的生物膜,导致体内脂质过氧化。E组的MDA含量没有显著性变化,GE组的MDA含量显著高于RE组,并与对照组差异不显著,表明GE组机体仍然受到损害。
3.3 恩诺沙星对鲫血清酶的影响
鱼类的血清生理生化指标与机体的代谢、营养状况及疾病有着密切的关系,当鱼体受到外界因子的影响而发生生理或病理变化时,必定会在血液指标中反映出来[18]。血清生化指标是反映动物环境应激时体内物质代谢和组织器官机能状态变化的一个重要特征[19]。当机体某些因素使细胞膜遭受破坏,使其内的酶释放入血液的速度大大增高,血清中酶的活性才明显升高[20]。AST催化谷氨酸与草酰乙酸之间的转氨作用[21],若肝脏损伤导致线粒体受损,AST会大量释出,使血清AST升高大于ALT[22],血清中AST活性越高,肝损伤则越严重。AKP虽然广泛分布于动物体各脏器器官中,但以酶原的形式存在于肝脏为最多,当肝脏受到损伤或者障碍时经淋巴和肝窦进入血液,同时由于肝内胆道胆汁排泄障碍,反流入血而引起血清碱性磷酸酶明显升高[23-24]。本试验结果显示,在连续6 d给予鲫高浓度恩诺沙星后,鲫血液中AKP和AST活性显著升高,表明恩诺沙星对肝细胞造成损伤。28 d后,RE组与GE组AKP和AST活性有回落趋势,这表明停喂恩诺沙星后,肝胰脏的功能开始恢复。且RE组AST显著低于GE组,表明RE组鲫机体恢复速度快于GE组。CREA是肌肉组织中储能物质肌酸代谢的终产物,血清中肌酐浓度可作为肾小球滤过功能受损的指标之一[24]。汪文选等[20]研究表明较低浓度的恩诺沙星对鲫的机体功能无显著影响。本研究鲫血液中CREA无显著变化,表明本研究中的恩诺沙星浓度对鲫肾脏无明显影响。
4 结论
饲料中添加恩诺沙星投喂异育银鲫6 d,恩诺沙星在鲫肌肉中大量蓄积。饲料中添加脱毒剂投喂异育银鲫后,RE组鲫肌肉中恩诺沙星在21 d达到安全浓度,较GE组缩短一个星期,说明饲料中添加脱毒剂促进了恩诺沙星在鲫体内的消除,显著缩短投喂抗生素后的休药期。
