微生物生产威兰胶的研究进展
2019-02-20,2,2,2,*
,2,2,2,*
(1.广西大学轻工与食品工程学院,广西南宁 530004; 2.广西水牛奶工程技术研究中心,广西南宁 530004)
多糖(polysaccharide)是一类由醛糖或酮糖通过糖苷键连接而成的天然高分子多聚物[1]。其来源广泛,其中由部分微生物在生长代谢过程中分泌到细胞壁外的水溶性多糖被称为胞外多糖(exopolysaccharides)。若聚合物与细胞膜以及培养基中释放的胞外多糖结合紧密,则胞外多糖中还含有荚膜多糖(图1),这些多糖最后可以分泌到周围的液体介质中或嵌入到生物膜中[2]。微生物胞外多糖的聚合通常发生在内膜的细胞质表面或周质,之后被输出到细胞外。除了为微生物提供物理屏障外,它们还可以为细胞提供额外的生物保护[3]。这些微生物具有生产周期短,生产条件不受限制,生产原料广泛(含碳氮源的废渣和废液)的特点,因此利用微生物生产胞外多糖比化学合成法更具经济效益。

图1 胞外多糖的组成:释放于介质的胞外多糖(MRP)与荚膜多糖(CPS)Fig.1 Composition of extracellular polysaccharides:exopolysaccharide(MRP)and capsular polysaccharide(CPS)released from the medium
目前广泛使用的胞外多糖有鞘氨醇单胞菌(Sphingomonassp.)生产的鞘氨醇(sphingans)[4],黄单胞菌生产的黄原胶(xanthan)[5],小核菌生产的小核菌葡聚糖(Scleroglucan)[6],芽短梗霉菌生产的普鲁兰多糖(pullulan)[7],裂褶菌生产的裂裥多糖(Schizophyllan)[8],链球菌生产的透明质酸(hyaluronic acid)[9],根瘤菌生产的琥珀聚糖(succinoglycan)[10]等。其中,由鞘氨醇科菌株合成的生物聚合物具有相似但不相同的结构,被统称为鞘氨醇[11]。现阶段,鞘氨醇有结冷胶(S-60)、威兰胶、Rhamsan(S-194)、Sanxan、S-88、Diutan(S-657)、S-198等。其中,威兰胶因其独特的性质成为研究热点。
威兰胶(S-130)是由摩尔比为3.1∶2.3∶4.5∶1.0的D-葡萄糖、D-葡萄糖醛酸、L-鼠李糖和L-甘露糖以糖苷键连接而成,四糖骨架结构为[→3)-β-D-Glc-(1→4)-β-D-GlcA-(1→4)-β-D-Glc-(1→4)-α-L-Rha(或者Man)-(1→],并且拥有一个连接在葡萄糖单元上的鼠李糖或甘露糖侧链,其侧链的鼠李糖与甘露糖单元比例为3∶1[12]。威兰胶溶液具有在高温(高达150 ℃)与广泛酸碱度(pH2~12)中黏性稳定的独特性质[13];与已广泛使用的黄原胶相比,威兰胶的分子量较低[14],但在相同浓度下,威兰胶溶液呈现出更高的表观粘度和更高的粘弹性模量(损耗和储存模量)。因此其在混凝土、石油、生物医学、药物、化妆品与食品领域具有很高的应用价值与良好的发展前景,例如日本已将威兰胶列入合法的食品添加剂[15],其中建筑、石油与废水处理方面的应用被广泛研究报道(表1)。然而,目前鞘氨醇单胞菌发酵威兰胶的糖转化率较低,一般在30%~40%,而黄原胶在70%~90%[16],这使得威兰胶成为最昂贵的生物胶之一。因此,提高糖转化率,降低成本成为了威兰胶生产发展的关键所在。近期研究人员开始探究各种育种方式和优化培养基的方法,以提高生物质能转化率,降低生产成本。

表1 威兰胶的应用研究Table 1 The application researches of Welan gum
1 鞘氨醇单胞菌中威兰胶的代谢途径解析
微生物胞外多糖生产具有简单、稳健、可重复的性质,且易于通过生长条件控制(例如碳源的类型和浓度,pH或温度)。然而,尽管可以生产具有恒定特性(例如组成、纯度和均匀性)的胞外多糖,但仍需要更好地理解其合成途径,以达到最大化生产并获得经济可行的过程。目前,在鞘氨醇单胞菌中,其合成威兰胶的代谢途径已经阐明,即包括细胞代谢途径(碳源摄取途径与中心代谢途径)和威兰胶合成途径(五糖单元的组装、聚合与分泌)。
1.1 鞘氨醇单胞菌细胞代谢途径
细菌的碳源摄取包括周质直接氧化途径和细胞内磷酸化途径,前者仅存在于某些细菌中,后者在细菌中无处不在。中心代谢途径包括糖酵解途径(EMP)、磷酸戊糖途径(PPP)、2-酮-3-脱氧-6-磷酸葡萄糖酸途径(ED)和三羧酸循环(TCA)为细胞的生理活动和产物合成提供能量和还原能力[26]。研究表明Alcaligenessp. CGMCC2428中的中心代谢酶如KDPG醛缩酶和PGD酶的活性均存在,因此,ED和PPP途径都存在于该生物体中。且鞘氨醇单胞菌为好氧微生物,则一定发生TCA。同时,研究人员测出PFK酶的比活性为零,因此认为在Alcaligenessp. CGMCC2428中没有EMP途径。生产胞外多糖的机制包括以下步骤:糖核苷酸前体的合成;重复单元的聚合;聚合重复单元的输出[27]。
1.2 威兰胶合成途径解析
在鞘氨醇单胞菌合成威兰胶的步骤包括:a. 葡萄糖由葡萄糖激酶磷酸化为葡萄糖-6磷酸或者通过细胞周质,在葡萄糖脱氢酶(GDH)的作用下联合吡咯喹啉醌作为辅助因子产生葡萄糖酸盐葡糖酸盐通透酶的主动转运系统转运到细胞中,然后通过ATP依赖性葡糖酸激酶反应将葡萄糖酸盐磷酸化,并产生6-磷酸葡糖酸盐;b. 形成的葡萄糖-6-磷酸进一步转化为果糖-6-磷酸(Fru-6-Ph)和葡萄糖-1-磷酸(Glu-1-Ph),共同参与核苷酸前体的形成和威兰胶的产生;c. 果糖-6-磷酸转化为甘露糖-6-磷酸,随后转变为甘露糖-1-磷酸,最终成为二磷酸鸟苷-甘露糖(GDP-Man);葡萄糖-1-磷酸则分别转化为二磷酸尿苷-葡萄糖(UDP-Glc)和邻苯二甲酸二异十三酯-葡萄糖(dTDP-Glc),二磷酸尿苷葡萄糖最终转化为二磷酸尿苷-葡萄糖醛酸(dTDP-GlcA)和焦磷酸异戊二烯-葡萄糖(IDP-Glc),邻苯二甲酸二异十三酯-葡萄糖最终转化为邻苯二甲酸二异十三酯-鼠李糖(dTDP-Rha);d. 四种终产物缩合形成威兰胶[28](图2)。

图2 鞘氨醇单胞菌中威兰胶合成途径Fig.2 Metabolic pathways for the production of synthetic Welan gum in Sphingomonas sp.注:F-6-P:果糖-6-磷酸,R-5-P:丙炔酸-5-磷酸,GAP:甘油醛-3-磷酸,6-PG:6-磷酸葡萄糖酸盐,KDPG:2-酮-3-脱氧-6-磷酸葡萄糖酸盐,AcCoA:乙酰辅酶A,E-4-P:赤藓糖-4-磷酸,G-1-P:葡萄糖-1-磷酸,M-6-P:甘露糖-6-磷酸,M-1-P:吡喃糖-1-磷酸,UDP-Glc:UDP-葡萄糖,UDP-GlcA:UDP-葡萄糖醛酸,dTDP-Glc:dTDP-葡萄糖,dTDP-Rha:dTDP-鼠李糖,GDP-man:GDP-甘露糖,IP:类异戊二烯磷酸盐,IDP:类异戊二烯焦磷酸盐。
1.3 提高微生物合成威兰胶的育种策略
1.3.1 威兰胶合成途径关键酶 核苷酸糖前体的生物合成,是威兰胶合成的基础。许多研究已经表明,核苷酸糖前体生物合成途径中,磷酸葡萄糖苷酶(PGMG)、尿嘧啶二磷酸(UDP)-葡萄糖焦磷酸化酶(UGPG)、UDP-葡萄糖脱氢酶(UGDG)、磷酸甘露糖异构酶(PMI)和dTDP-葡萄糖焦磷酸化酶(TGP)是关键酶[29]。其中TGP酶是dTDP-1-鼠李糖生物合成途径中的关键酶[30];PMI是GDP-甘露糖生物合成中的关键酶[31]。
1.3.2 诱变育种技术 诱变育种即通过利用物理、化学等因素诱导动植物的遗传特性产生变异,再通过不同的筛选方式从变异群体中选择符合需求的个体,从而得到新品种的育种方法。诱变育种变异频率高,可大幅度地获得新品种。a.利用诱变技术得到高产菌株。利用低能氮离子束注入技术对Alcaligenessp.NX-3进行诱变,筛选得到突变菌株比野生菌株威兰胶生产量高34.4%,并且发现突变菌株中磷酸葡萄糖苷酶、UDP-葡萄糖焦磷酸化酶、UDP-葡萄糖脱氢酶和dTDP-葡萄糖焦磷酸化酶的比活性均高于野生型菌株[32];b.获得耐高温菌株以减少降温成本。温度耐受性可归因于热休克蛋白和氧化应激蛋白的过度表达[33],通过等离子体诱变获得耐高温菌株Sphingomonassp. HT-1,该菌株在37 ℃生产威兰胶浓度达(26.8±0.34) g/L。
1.3.3 代谢工程技术 代谢工程即利用基因重组技术改造细胞的代谢途径,从而使细菌生产出特定目的产物的育种方法。2012年鞘氨醇单胞菌ATCC 31555测序工作的完成,为其代谢工程发展奠定了基础。代谢工程优化代谢途径,实现威兰胶的高效合成的方法:a. 通过基因工程技术获得高产菌株。向Sphingomonassp. HT-1中插入可表达透明颤菌血红蛋白VHb基因,从而改善发酵过程中的溶氧水平,最终威兰胶的产量从25.3 g/L增加到34.6 g/L,且威兰胶溶液的流变性基本保持不变[34]。b. 减少色素带来的纯化成本。将透明颤菌血红蛋白基因与β-半乳糖苷酶(lacZ)启动子结合,插入到Alcaligenessp. ATCC31555染色体的八氢番茄红素合成酶(crtB)基因区域,从而得到不含胡萝卜素的威兰胶以减少后期乙醇的使用量,最终工程菌株的威兰胶产量高于野生菌株为(24±0.4) g/L,且流变性更好[35]。
2 发酵法生产威兰胶菌株的菌种选育
为实现威兰胶的工业化应用,作为威兰胶的生产菌株则应具备能在胞内高效合成并快速转运威兰胶至胞外,碳源转化率高,生长迅速、发酵周期短,产物杂质少、易纯化分离等特点。近年来,科研工作者通过自然选育、诱变育种及代谢工程等育种策略实现了高产威兰胶菌株的选育,为实现其工业化生产奠定了基础(表2)。
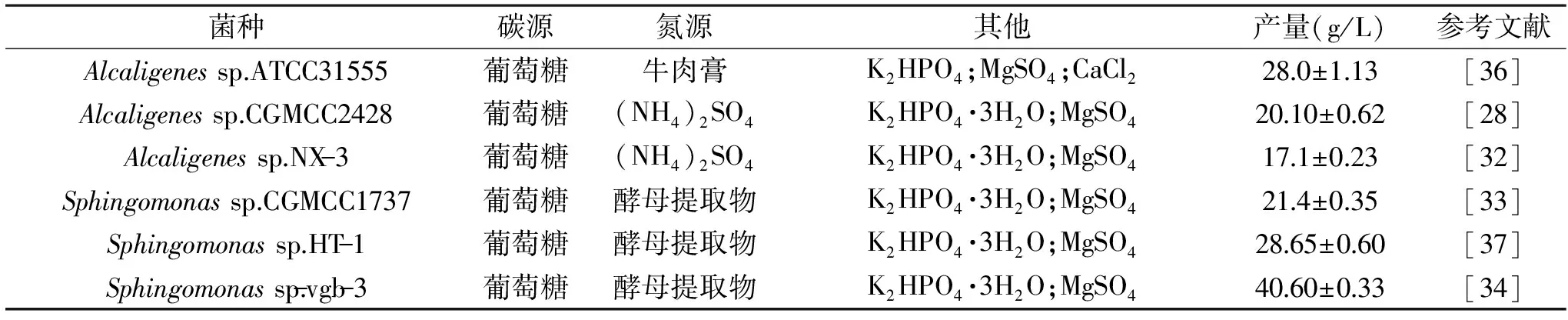
表2 产威兰胶的不同菌株的培养基及威兰胶产量Table 2 Culture medium of different strains producing Welan gum and yield of Welan gum
3 提高威兰胶生产效率的策略
3.1 使用廉价碳源
碳源是微生物胞外多糖生产的关键因素,可占总成本约63%[38]。鞘氨醇单胞菌拥有广泛的底物谱,如最开始用作发酵威兰胶的碳源是单糖(例如葡萄糖)。但由于碳源转化率低,使得威兰胶生产成本高价格昂贵,因此,研究、探索适合生产的廉价碳源:a.利用甘蔗糖蜜作为碳源,采用酸水解法处理糖蜜,发酵液中威兰胶浓度可达33.5 g/L[36],明显高于使用相同浓度糖(葡萄糖、果糖和蔗糖)混合物发酵产量,因此认为糖蜜中含氮类化合物和大量有机酸,比起单糖和双糖更适合该菌生长;b.利用中性蛋白酶、α-淀粉酶和淀粉葡萄糖苷酶处理厨余,在5 L发酵罐中进行威兰胶发酵,威兰胶产量、还原糖和氮源的利用率分别达到5.57 g/L、94.25%和61.96%[39];c.利用制糖工业废料葡萄糖母液和木糖母液生产威兰胶,先利用葡萄糖母液供给鞘氨醇单胞菌繁殖,再使用拟指数补料方法加入木糖母液,得到威兰胶浓度为22.68 g/L,糖转化率达到0.756 g/g[16]。
3.2 氮源优化
微生物可以利用多种氮源,它们通过酶来运输这些化合物和酶,并代谢产生氨。氮源调控旨在防止或减少细胞对酶和通透酶形成的不必要的分歧,以便在优选氮时利用作为非谷氨酸和谷氨酰胺来源的化合物作为氮源。微生物细胞能够灵敏地感应出生长环境中氮源的变化并及时作出代谢调整,利于细胞存活。将六种不同的氮源NaNO3、NH4NO3、(NH4)2SO4、牛肉膏、大豆蛋白胨和酵母粉用于鞘氨醇单胞菌ATCC31555的发酵,初始氮源浓度为3 g/L,NaNO3和牛肉膏对威兰胶的合成影响最大,发酵结束时,威兰胶产量分别达到8.76和12.47 g/L,生物量分别为5.85和7.89 g/L,进一步对这两种氮源进行研究发现,牛肉膏比起NaNO3更适合细菌生长,NaNO3生产的威兰胶粘度更大,随着NaNO3浓度的降低,威兰胶的分子量和甘露糖的摩尔比降低,但葡萄糖醛酸的摩尔比增加[40];与无机氮相比,有机氮的细菌生物量和威兰胶产量更高,通过转录组分析不同氮源培养鞘氨醇单菌ATCC 31555代谢过程中信号转导和细菌趋化性变化相关联的基因的表达水平,这些基因表达变异可能是细菌生物量和威兰胶生产变化的原因[41]。
3.3 溶氧量调控策略
鞘氨醇单胞菌是一种好氧微生物,在生产威兰胶这类粘性多糖的过程中,营养物质和氧气转移的效率很容易受到发酵过程中流体的高粘度的影响[42],因此,威兰胶的合成和特性可能受到溶氧量影响。随着生产时间的增加,产物在细胞外堆积,氧气传送速率降低,导致产量的下降。在好氧微生物发酵的过程中,溶氧量成为限制性控制因素,氧气传递速率影响整个细菌生长和生产代谢过程。氧气量的减少可能导致酶的功能受到影响,从而导致所需产物减少甚至微生物死亡。溶氧因素的优化方式有以下几种:a通过改变转速提高溶氧量。在600 r/min时将溶氧浓度增加至20%,可获得最大威兰胶浓度和分子量为(9.20±0.11)×105Da和(24.5±0.53) g/L,此时葡萄糖-1-磷酸对威兰胶的通量增强,增加的通量也可能是分子量和威兰胶浓度增加的原因[43];使用两阶段转速控制策略,发酵初期22 h期间,搅拌速度控制在800 r/min以维持速率的细胞生长,然后将搅拌速度逐步降低至600 r/min以保持具有稳定溶解氧水平以获得高产量,威兰胶的最大浓度达到(26.3±0.89) g/L,产量为(0.53±0.003) g/g,其与恒定搅拌速度控制的最佳结果相比,产量增加了20.1%[44];b 通过添加氧载体提高溶氧量。与水不混溶且比水具有更高的氧气增溶能力的有机相,通常称为氧气载体[45]。向发酵液加入氧载体正十二烷和正十六烷后,发酵培养基的氧转移量达到显著高于对照组,同时威兰胶浓度和产率分别达到(33.9±0.56) g/L和(0.761±0.010) g/g,且添加正十二烷,菌体浓度达到最大值(7.82±0.18) g/L[37];比较十六烷基三乙基溴化铵、十二烷基硫酸钠、Triton X-100、Span-20、Span-40、Span-80、吐温-20、吐温-40、吐温-80、DMSO和甘油的添加对产量的优化,发现在吐温-40的作用下增产最高,威兰胶浓度为(23.62±0.60) g/L[46]。
综上所述,选用廉价碳源既减少了发酵成本,且适宜的廉价碳源(如糖蜜)也使得产量提升最为明显,可将其与其他提产方式及育种方式进行结合,研究出集最佳的菌种、培养基及发酵条件为一体的发酵体系。
4 威兰胶的分离纯化
从发酵液中分离多糖的最常用方法是除去菌体后用异丙醇、乙醇等有机溶剂进行物理萃取,再通过离心处理获得粗多糖。可在去除菌体前使用超声波处理或加热充分溶解威兰胶胶体,使菌体与威兰胶分离[47]。粗威兰胶中含有少量蛋白质,通常使用Sevage法脱去蛋白,之后放入透析袋中透析,以除去小分子的金属离子及单糖等物质。将透析后的截留液进行真空浓缩、冷冻干燥,可制得精制的威兰胶(图3)。离心和过滤可用于从粗胶中除去不溶物质并除去一定比例的高可溶性物质,透析处理可以除去更低摩尔质量的杂质。其他方法例如离子交换色谱、柱层析等方法也可用于多糖的纯化,需要进一步开发这些技术用于威兰胶的纯化。
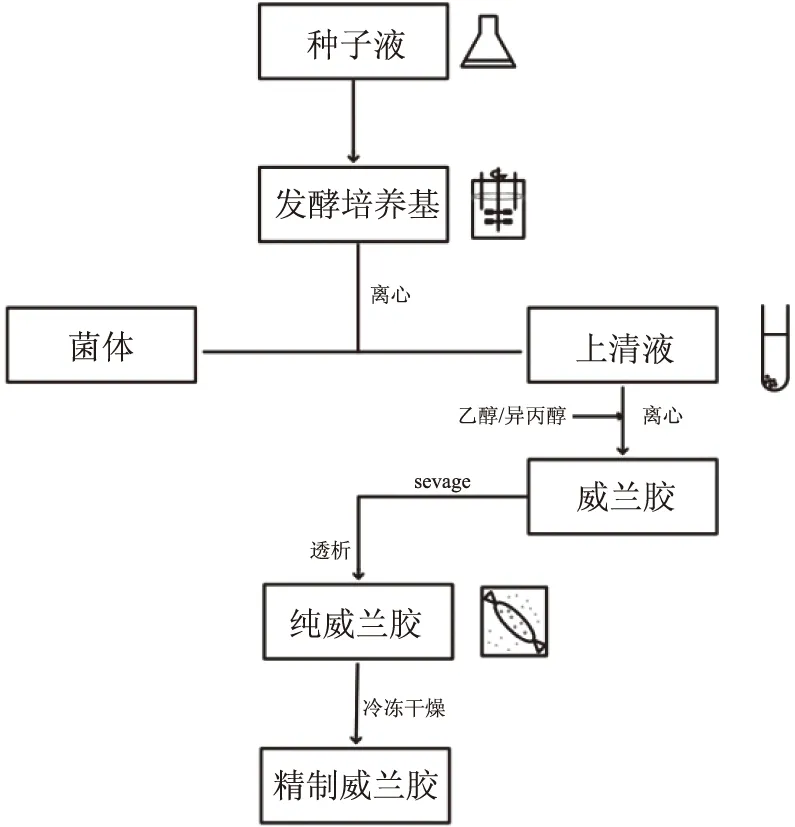
图3 威兰胶的分离纯化Fig.3 Separation and purification of Welan gum
5 结论与展望
威兰胶这种在高温与广泛酸碱度中粘性稳定的性能特殊原料,仍然集中应用在建筑、石油等重工业领域,在食品行业中仅有少部分国家视其为合法的食品添加剂。与其类似的胞外多糖例如黄原胶、结冷胶等,已经在各个工业领域占据一定的地位。威兰胶普及率低的原因与其生产成本高有很大的关系,碳转化率低、分离纯化方法复杂等原因限制其经济性。近年来在合成代谢途径、生产条件优化与提高经济性等方面进行了诸多研究,且有实质性进展。但较已工业化的黄原胶与结冷胶还有一定的差距,因此需要进一步找出提高产量与简易纯化的方法。关于威兰胶生产发展的后期研究应围绕以下几个方面:更深入研究其结构与性能,开发更多应用潜力;与其他试剂相溶性与应用;降低生产成本;开发研究其衍生物。威兰胶生产应用的研究虽然有所进展,但仍然任重而道远。
