天然牛磺酸对肝硬化门静脉高压大鼠门静脉血流动力学及内皮细胞的影响▲
2019-02-19
(广西中医药大学附属瑞康医院感染一科,南宁市 530011,电子邮箱:dwx857@163.com)
肝硬化门静脉高压(portal hypertension,PHT)以门静脉系统压力升高为主要特点,常引起腹水、脾肿大、肝性脑病等并发症,严重影响患者的生存质量,是临床死亡的主要原因之一。门静脉系统血流紊乱是PHT发病机制之一,门静脉内皮细胞内衬于脉管的内壁,是最早感受血流变化并产生应答的效应细胞[1]。有研究表明内皮细胞诱导的血管活性物质与PHT的形成及维持密切相关[2-3]。因此研究血流动力学及效应内皮细胞具有重要价值,也一直是PHT研究的热点。我们在前期研究中发现,结合牛磺酸和天然牛磺酸均有抑制肝纤维化的作用[4-7]。本研究通过观察天然牛磺酸对PHT大鼠血流动力学及其效应内皮细胞的影响,进一步探讨PHT形成的机制及治疗方法。
1 材料及方法
1.1 动物及药物 实验用无特定病原体级雄性SD大鼠80只,6~7周龄,体重(180±20)g,由广西医科大学动物实验中心提供,动物合格证:SCXK桂2009-0002。天然牛磺酸为采用热水提取法[8]从乌蛤肉中提取而得,采用红外光谱仪鉴定药品质量,纯度要求达到98.5%以上。
1.2 实验仪器 MFV-3200型电磁流量计、RM-6300型八道生理记录仪购自日本Nihon Kohden公司,压力换能器、SMUP-PC型生物信号处理系统、计算机图像分析软件MP-100、MFLab 2.00数据采集系统由广西中医药大学生理教研室提供(西安明克斯检测设备有限公司),MT-2型荧光倒置显微镜、显微摄像及录像系统购自Olympus公司,TSD145型激光多普勒组织灌注图像仪购自美国BIOPAC公司,H-7650型透射电子显微镜购自日本日立公司。
1.3 方法
1.3.1 建立动物模型:采用复合因素法建立肝硬化PHT大鼠模型,首次按0.5 ml/100 g体重给予大鼠腹部皮下注射60%橄榄油+40%四氯化碳混合液后,每隔3 d按0.3 ml/100 g体重皮下注射给药1次(配方同上),15%酒精为唯一饮料,同时辅以20%猪油、0.5%胆固醇、79.5%玉米面混合饲料喂养。造模8周后,按随机数字表法抽3只大鼠行门静脉血流及肝脏组织病理学检测,确定肝硬化PHT模型制备成功(以肝脏组织病理学检查可见大小不等的假小叶形成为制备成功)后进行后续干预实验。
1.3.2 分组与干预:建模成功后按随机数字表法抽取45只肝硬化PHT大鼠,采用随机数字表法分为结合牛磺酸组(A组)、天然牛磺酸组(B组)和对照组,每组15只,A组按0.6 g/(kg·d)给予牛磺酸灌胃,B组按0.6 g/(kg·d)给予天然牛磺酸灌胃,对照组大鼠给予相同剂量0.9%氯化钠溶液灌胃,疗程均为21 d。
1.3.3 肝脏血流灌注量(hepatic perfusion volume,HPV)测定:最后一次给药后当晚大鼠禁食,次日用10%水合氯醛按0.3 ml/100 g腹腔注射麻醉。将大鼠以仰卧位四肢无创固定于实验台上,腹部及颈部剪毛,消毒铺巾,取剑突下正中切口,剪开腹壁,暴露肝脏,肝脏周围以温生理盐水纱布包裹,以20滴/min的速度在纱布表面持续滴39℃的0.9%氯化钠溶液,实验室温度控制在24℃~26℃,湿度控制在35%~40%,使肝脏尽量处于接近生理的环境。打开激光多普勒组织灌注图像仪和组织灌注图像软件,固定激光探头与肝脏表面相距约10 cm,保证激光垂直照射到肝脏表面,注意控制实验室的光线强度。计算机控制激光探头自动扫描肝脏表面,检测记录肝脏微循环血液灌流量3 min,连续监测两次,取平均值。
1.3.4 门静脉血流动力学的测定:检测肝脏血液灌流量后,逐层剥离门静脉表面组织,游离出门静脉主干,一侧插入适宜的电磁探头,电磁流量计测量门静脉血流量(portal venous flow,PVF),待血流稳定后,测量5次取其平均值。游离肠系膜静脉,插入PV-50导管至门静脉主干,通过压力换能器,应用八道生理记录仪测定门静脉压力(portal venous pressure,PVP)、门静脉阻力(portal vein resistance,PVR)及平均动脉压(mean arterial pressure,MAP)。操作过程室温均保持24℃~26℃,检测前用肝素钠-生理盐水溶液冲洗各种导管。记录大鼠血流动力学数据并输入计算机,采用MFLab 2.00生理学实验软件包处理数据。
1.3.5 门静脉内皮细胞超微结构的观察:取相同部位新鲜门静脉主干,切成大小约1 mm×1 mm×1 mm标本,置于4℃预冷的4%戊二醛,固定24 h,再经1%四氧化锇固定2 h,常规乙醇和丙酮脱水,加丙酮-环氧树脂812环氧树脂包埋,修块及切片,铀-铅染色,透视电镜下观察门静脉内皮细胞的超微结构。
1.4 统计学分析 采用SPSS 19.0软件进行统计学分析。计量资料以(x±s)表示,组间比较采用单因素方差分析,两两比较采用LSD-t法。以P<0.05为差异具有统计学意义。
2 结 果
2.1 3组大鼠门静脉血流动力学指标比较 A组及B组PVP、PVR、PVF均低于对照组(均P<0.05),见表1。对照组、A组、B组MAP、HPV水平依次升高(P<0.05),见表2。
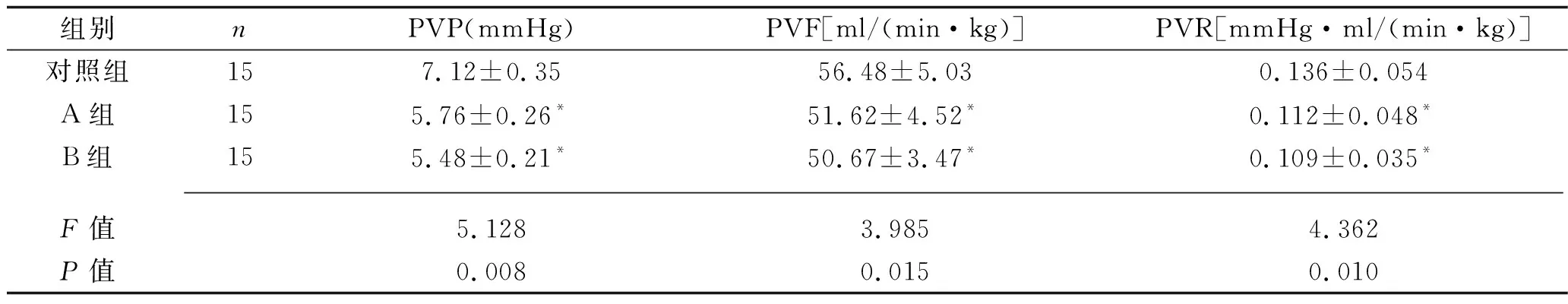
表1 3组大鼠PVP、PVR、PVF比较(x±s)
注:与对照组比较,*P<0.05。
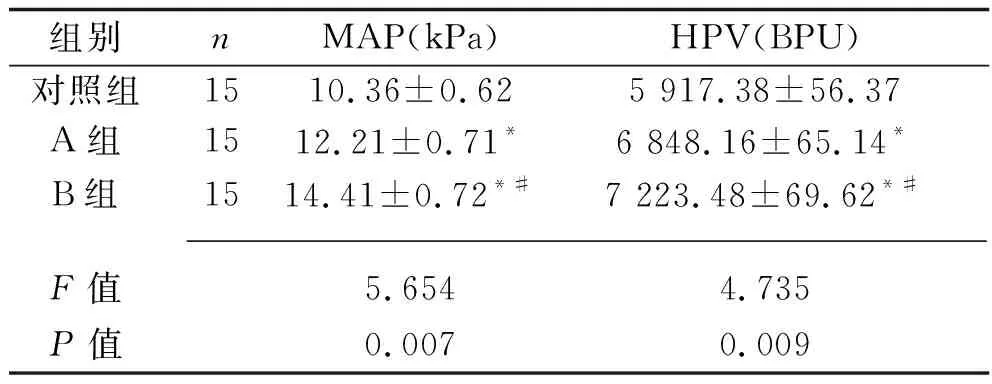
表2 3组大鼠MAP及HPV比较(x±s)
注:与对照组比较,*P<0.05,与A组比较,#P<0.05。
2.2 3组大鼠门静脉内皮细胞的超微结构 对照组大鼠门静脉内皮细胞有不同程度变性,细胞核变性或脱落,基底膜完整性遭到破坏,连接松散;A组门静脉内皮细胞结构完整,细胞膜、细胞质、细胞核基本正常,但基底膜较厚;B组大鼠门静脉内皮细胞结构完整,基底膜无增厚,细胞膜、细胞质、细胞核正常。见图1。
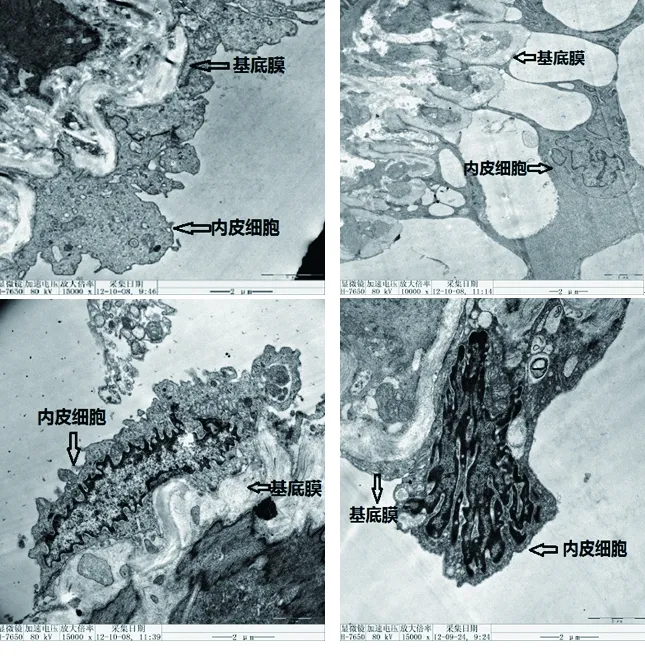
图1 3组大鼠门静脉内皮细胞超微结构(透视电子显微镜,×15 000)
3 讨 论
门静脉系统血流动力学的紊乱是PHT形成与进展的重要机制之一,“后向血流”与“前向血流”是PHT发病机制的两种学说。“后向血流”学说认为肝内血管收缩和舒张调节失衡导致门脉血管阻力的增加是PHT形成与进展的主要决定因素。“前向血流”学说认为门静脉高压的始动因子是周边血管扩张,MAP降低,血管阻力降低,血容量增多,从而形成全身高动力循环综合征。这两种机制在PHT的形成中均发挥了重要的作用[9-10]。
内皮细胞是血流接触的效应细胞,其诱导产生的血管活性物质一氧化氮(nitric oxide,NO)及一氧化氮合酶(nitric oxide synthase,NOS)与PHT的形成密切相关[3]。正常情况下NO、NOS与内皮素-1(endothelin-1,ET-1)处于相对平衡状态[11]。我们在前期研究中发现[2],PHT形成后,门静脉内皮细胞损伤变性,其分泌的血管活性物质(如NO、NOS与ET-1)平衡失调,血浆中NO、NOS水平升高而ET-1水平降低,使PHT得以维持或恶化,这与PHT的“前向血流”学说相似。本研究结果显示:与大鼠相关指标正常参考值[2,7]比较,肝硬化PHT大鼠PVP、PVR、PVF升高,MVP降低,门静脉内皮细胞超微结构异常,符合PHT “前向血流” 机制学说;而HPV下降,则说明肝内血管收缩和舒张失调,符合“后向血流”机制学说。因此围绕PHT的“后向血流”与“前向血流”机制学说,恢复和维持肝脏及门脉系统正常血流动力学,是预防和治疗PHT的重要措施。
目前西药治疗PHT的途径较单一,而中医药治疗具有多途径、多环节、多靶向干预的特点,针对PHT发生机制中的多个环节起作用,可弥补西医作用途径单一的缺点。天然牛磺酸从乌蛤肉中提取,现代药理学研究表明其具有解毒护肝抗肿瘤、增强机体免疫功能等作用,大剂量使用无相关不良反应。我们的前期研究显示,天然牛磺酸可减轻肝细胞炎症反应及肝脏线粒体脂质过氧化,改善肝脏微循环,降低肝内血管阻力,从而抑制PHT[4-7]。
本研究结果显示,天然牛磺酸和结合牛磺酸均可改善肝硬化PHT大鼠门静脉血流动力学指标(PVP、PVR、PVF),而天然牛磺酸改善MVP及HPV的效果优于结合牛磺酸(P<0.05),改变门静脉内皮细胞超微结构的效果更佳。这些提示天然牛磺酸在改善PHT大鼠的“后向血流”效果优于结合牛磺酸,而其逆转PHT的作用机制可能与同时干预“后向血流”与“前向血流”有关。
综上所述,天然牛磺酸可减轻肝硬化PHT大鼠门静脉压力,改善效应内皮细胞的超微结构,且其效果优于结合牛磺酸。本研究主要观察天然牛磺酸对血流动力学指标及内皮细胞的影响,但肝硬化PHT病因及发病机制尚未完全清楚,“后向血流”与“前向血流”学说蕴含多学科的交叉融合,涉及细胞分子水平、蛋白、生物力学及各种信号传导因子等,今后将从这几方面进一步深入研究天然牛磺酸治疗对肝硬化PHT的作用机制。
