沙粒病毒及所致人类疾病的研究进展
2019-02-19,
,
沙粒病毒(Arenaviruses,ARV)因在电镜下观察,病毒内部有宿主细胞核糖体成分形成电子致密颗粒,形如沙粒,故取名“沙粒”病毒(拉丁语:Arena,沙粒的意思)[1]。沙粒病毒科(如拉沙病毒)、丝状病毒科(如埃博拉病毒)、布尼亚病毒科(如汉坦病毒)和黄病毒科 (如登革病毒) 4科病毒可引起人类致命的病毒性出血热(Viral hemorrhagic fever, VHF)[2],2015年我国科学家张永振等[3]在鼠类中也检测到一类新的ARV,引起人们的高度警觉。现将ARV的结构、分类、疫苗、治疗及与人类相关疾病的研究进展综述如下。
1 沙粒病毒及其基因组
ARV属于沙粒病毒科(Arenaviridae),病毒颗粒从圆形到多形,直径为50-300nm,有包膜,包膜表面有“T”型刺突。病毒基因组由2个片段的单股负性RNA组成,2个片段为:大(L)和小(S),片段的5′端和3′端由17-30个核苷酸非编码区(Noncoding untranslated regions,NUR)反向互补形成手柄结构,见图1。L片段约7.2 kb,通过双义编码策略分别编码病毒RNA依赖的RNA酶(L蛋白)和锌结合的基质蛋白(Z蛋白)[4-5],L蛋白为病毒基因组转录和复制的酶,Z蛋白形成一小的锌指结构,促使病毒的出芽和装配;S片段约3.5 kb,也通过双义编码策略分别编码病毒核衣壳蛋白(N蛋白)和包膜糖蛋白前体(GPC蛋白),GPC蛋白在高尔基体内水解成成熟的病毒包膜糖蛋白GP1、GP2和信号稳定肽(Signal stable peptide, SSP )[6],GP1结合病毒受体,GP2为跨膜蛋白,调节病毒与细胞的融合[7-8]。ARV每个片段都有2个开放读码框 (Open reading frames, ORFs),每个ORF被一形成茎环结构的基因间非编码区(Intergenic noncoding region,IGR)分开,IGR的功能主要为:结构依赖的转录终止和病毒装配和出芽。GPC能介导病毒装配、进入、脱壳和决定细胞取向。N蛋白有4个、GP1有2个和GP2有6个的抗原显位,可以产生特异性抗体,用于病毒的诊断[9-10]。N蛋白具有多种功能:它与ARV基因组片段形成核糖核蛋白体(Ribonucleoprotein,RNP),与L蛋白形成RNA复制和转录的RNP核心,结合Z蛋白进行病毒组装,抑制宿主I型干扰素的产生和炎症发生,并具有核酸外切酶和核酸结合活性,是病毒最重要的免疫原[11]。
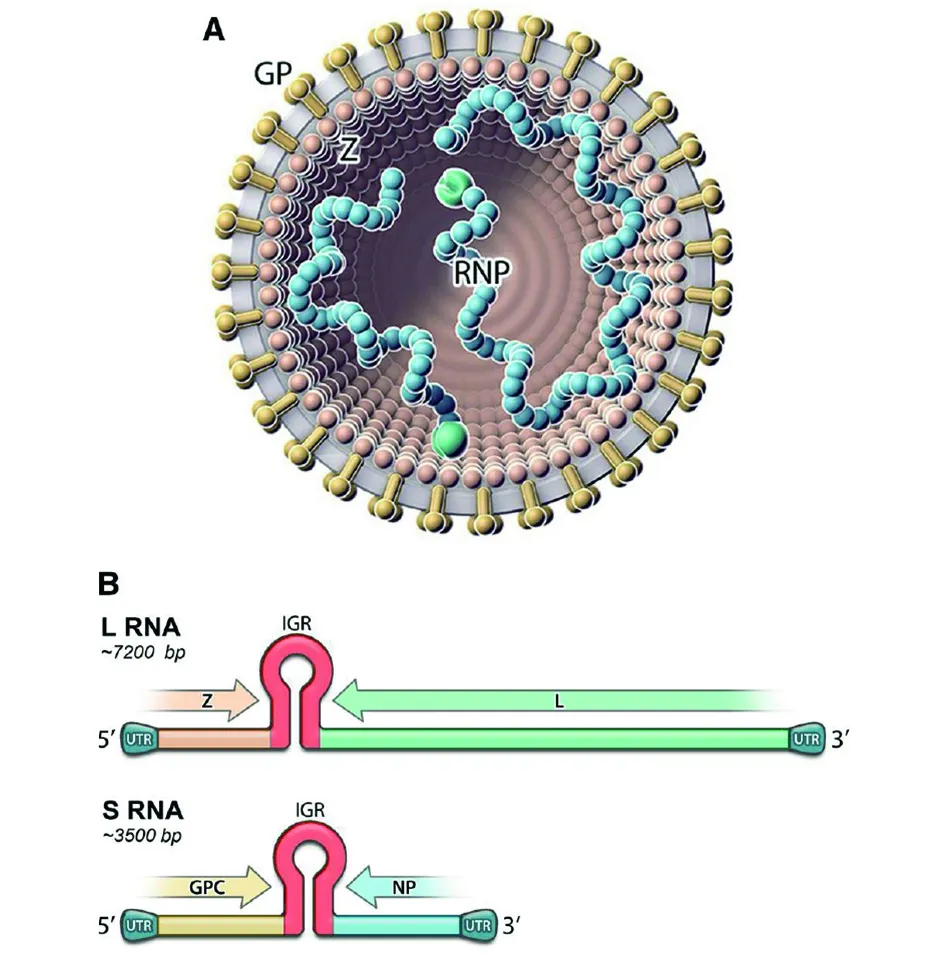
图1 沙粒病毒颗粒模式图(A);沙粒病毒L和S片段RNA基因组结构图(B)[1]Fig.1 Schematic diagrams of an arenavirus particle (A) and the organization of the bi-segmented arenavirus L and S RNA genome segments (B) [1]
2 沙粒病毒分类及致病性
沙粒病毒科按地理位置的分布可分为:新大陆沙粒病毒(New world arenaviruses,NWARV)和旧大陆沙粒病毒(Old world arenaviruses,OWARV)两大类,NWARV主要包括分布于美洲的ARV,OWARV主要包括分布于非洲、欧洲和亚洲的ARV[12]。根据ARV分类的“病毒种(Species)”的定义应符合下列5个条件[1]:①病毒具有独特的生态位,与一种或一类特异的宿主动物相关;②病毒具有特定的地理分布;③病毒是或不是人的病原体;④病毒抗原交叉反应存在足够的不同,不同病毒之间不存在中和抗体交叉反应;⑤在核苷酸水平,不同病毒之间S片段至少存在20%和L片段至少存在24%的不同,在氨基酸水平,不同病毒之间N蛋白至少存在12%的不同。根据最新的国际分类委员会(ICTV)第10次会议,现将沙粒病毒科共有大约30种病毒,按宿主动物的不同分为3个属:爬行动物沙粒病毒属(Reptarenavirus,RARV)、哈特曼病毒属(Hartmanivirus, HARV)和哺乳动物沙粒病毒属(Mammarenavirus,MARV)[12]。RARV共有5种,主要感染蛇类,引起蛇的包涵体病,不引起人类疾病[13-14]。HARV为2017年才划分的病毒属,现仅在芬兰的德国蟒蛇(Boa constrictor)发现哈特曼研究所蛇病毒(Hartman Institute snake virus)1种。MARV共有35种,除1956年在北美洲牙买加果蝠(Artibeusjamaicensis)中发现的塔卡里伯病毒(Tacaribe virus, CTRV)外[15],其余绝大多数病毒以啮齿动物为宿主,鼠类感染MARV一般不表现任何临床症状,然而人直接或间接接触鼠类(包括排泄物)感染病毒而发病[1]。这些MARV至少有10种可引起人类疾病(表1):①早在1933年报道的以小家鼠(Musmusculus)为宿主动物的淋巴细胞性脉络丛脑膜炎病毒(Lymphocytic choriomeningitis virus, LCMV),全球分布,引起人类的无菌性脑膜炎[16]。②1958年在阿根廷壮暮鼠(Calomysmusculinus)中发现的胡宁病毒(Junin virus,JUNV),引起人类的阿根廷出血热(Argentine hemorrhagic fever, AHF)[17-18]。AHF病死率高达20%~30%,虽然JUNV病毒主要分布在阿根廷,但该病毒从刚发现时只存在于1.5万km2的面积,到2000年,受危害的面积扩大到15万km2,增加了10倍,大约有5百万人口受到威胁,是当地一个重要的公共卫生问题[19]。③1963年在玻利维亚胼胝暮鼠(Calomyscallosus)中发现的马丘波病毒(Machupo virus, MACV)引起人类的玻利维亚出血热(Bolivian hemorrhagic fever, BHF)[20]。BHF病死率25%~35%,在病毒分布的地区,时有流行或散发BHF报道[21]。④1969年在西非多乳鼠(Mastomysnatalensis)中发现了著名的拉沙病毒(Lassa virus, LASV),引起人类致命性的拉沙热(Lassa fever,LF),欧洲、美国和日本有输入病例报道[22]。在西非,LASV每年引起10万~30万的病例和大约5 000人死亡[23]。对正常人群进行LASV特异抗体血清学调查发现病毒流行率为1.8%~50%[24],每年LASV特异抗体转阳率为5%~20%[25],这些结果提示:LASV感染还有些病例是轻微或无临床症状,许多人没有到医院就诊,未被发现。⑤1989年在委内瑞拉短尾茎鼠(Zygodontomysbrevicauda)中发现瓜纳里托病毒(Guanarito virus, GTOV)引起人类委内瑞拉出血热(Venezuelan hemorrhagic fever,VHF)[26],病死亡率高达23.1%[27]。⑥1990年在巴西出血热病人中分离到萨比埃病毒(Sabia virus,SABV),引起人类的巴西出血热(Brazilian hemorrhagic fever,BHV),其宿主动物未知,推测是某种啮齿动物[28]。BHV记录在案的虽然只有3例,但该病毒可以引起实验室感染:第1例为一名女性农业工程师,发病4 d后死亡[29]。第2例为对第1例尸检材料进行离心操作时被感染的病毒学家,第3例为事隔4年后,在BSL3级实验室对SABV进行操作的另一名科学家,由于离心管破碎而感染[30]。后2例BHV病例虽然治疗后生还,但病死率仍为33.3%。⑦1993年在美国新墨西哥州的白喉林鼠(Neotomaalbigula)中发现的怀特沃特阿罗约病毒(Whitewater Arroyo virus, WWAV),可引起人类的肝衰竭出血热,病死率为100%[31]。⑧2002年在巴西的某种米鼠(Oryzomysspp)中发现的弗莱克索病毒(Flexal virus, FLEV),可引起人类的VHF[32]。⑨2004年在玻利维亚的出血热病人中分离到恰巴雷病毒(Chapare virus, CHPV),引起人类的恰巴雷出血热(Chapare hemorrhagic fever, CHHF),其宿主动物未知,推测是某种啮齿动物[33]。⑩2008年在赞比亚和南非的出血热病人中发现卢约病毒(Lujo virus, LUJV ),引起人类的卢约出血热 (Lujo hemorrhagic fever, LUHF),其宿主动物未知,推测也是某种啮齿动物[34]。虽然LUHF只报道了5例,但造成医院内爆发流行,其中4人死亡,病死率高达80%[35]。从上世纪30年代开始,人类在与ARV相关疾病抗争进程中,由于它们所引起的VHF许多是致命性的,以至于这些ARV所造成的人类疾病,让人“谈虎色变”的程度,因此,高致病性的ARV越来越引起了各国科学家的高度警觉。
长期以来,在中国仅证实存在LCMV一种ARV,主要是因为LCMV的宿主动物小家鼠是全球性分布的[36]。直到2015年我国科学家张永振[3]等报道在浙江省温州市的5种啮齿动物:黑家鼠(Rattusrattus,感染率75.0%=3/4,分子表示阳性数,分母表现调查数,下同)、褐家鼠(R.norvegicus, 17.1%=28/164)、黄胸鼠(R.flavipectus,15.4%=8/52)、黄毛鼠(R.losea,11.8%=2/17 )和社鼠(Niviventerniviventer, 1.9%=1/53)以及1种食虫动物:臭鼩(Suncusmurinus,4.4%=12/272)中检测到一类新的MARV,并从褐家鼠中分离到病毒,命名为:温州病毒(Wenzhou virus, WENV),但WENV对人的致病性和疾病负担未知。Blasdell等[37]2016年报道在柬埔寨、泰国和老挝3国7个地方进行了MARV感染状况调查,共捕获20种10属627只啮齿动物和食虫动物,MARV感染率为4.3%(27/627),其中在柬埔寨捕获的褐家鼠(21.1%=4/19)和缅甸小鼠(R.exulans,5.1%=13/254)中检测到WENV样病毒(该类病毒最接近WENV,在核苷酸水平,S片段与WENV的相似性为88.5%~88.8%,L片段与WENV的相似性为86.0%~86.3%)。而在缅甸板齿鼠(Bandicotasavilei, 11.4%=4/35)、泰国板齿鼠(B.indica,9.8%=3/31)和针毛鼠(Niviventerfulvescens, 1.8%=1/55)中检测到一种新的MARV,命名为:黎府河哺乳动物沙粒病毒(Loei River mammarenavirus,LORV)(该类病毒最接近WENV,在核苷酸水平,S片段与WENV的相似性为70.3%~70.6%,L片段与WENV的相似性为62.7%~63.1%)。同时,该课题组在柬埔寨对不同地区8组人群中WENV样病毒IgG抗体水平和病毒核酸感染现状进行了调查。①病毒IgG调查:以原核表达和纯化WENV样病毒的N蛋白为抗原,应用酶联免疫吸附实验(ELISA)检测人血清中病毒的IgG:第1组(流感和登革热样病人)WENV样病毒IgG阳性率高达17.4%(89/510);第2组(登革热流行区健康人群),WENV样病毒IgG隐性感染率也高达13.2%(70/529);②病毒核酸调查:第3组(200份脑膜脑炎病人脑脊液)用Real-time RT-PCR法检测,结果皆为阴性;对后5组病人样品用RT-PCR法进行病毒RNA检测。第4组(253份登革热样发热期病人血清)皆为阴性;第5组(流感样病人咽拭子)病毒核酸阳性率1.2% (4/328);第6组(急性下呼吸道感染咽拭子)病毒核酸阳性率0.7%(2/279);第7组 (266份健康人咽拭子)和第8组(238份狂犬病病毒疫苗接种健康的志愿者咽拭子)病毒核酸皆为阴性。这些结果揭示:在柬埔寨发热、呼吸道感染等症状的病人和健康人群中都存在WENV样病毒的感染,该病毒对人有致病性[37]。
目前,还有20多种ARV无证据能否引起人类疾病:1956年在北美州牙买加果蝠(Artibeusjamaicensis)中发现塔卡里伯病毒(Tacaribe virus, TCRV);1964年在巴西圭亚那鬃鼠(Neacomysguianae)中发现阿马帕里病毒(Amapari virus, AMAV),同年在美国棉鼠(Sigmodonhispidus)中发现太米阿米病毒(Tamiami virus, TAMV);1965年在巴西大头稻鼠(Oryzomys megacephalus)中发现卡皮生病毒(Cupixi virus, CPXV),在巴拉圭米鼠(Oryzomys angouya)中发现巴拉那病毒(Parana virus, PARV),同年在哥伦比亚白喉稻鼠(Oryzomys albigularis)中发现皮钦德病毒(Pichinde virus, PICV),及在玻利维亚胼胝暮鼠(Calomys callosus)中发现拉蒂诺病毒(Latino virus,LATV);1970年在中非共和国无纹草原鼠(Arvicanthis spp.)中发现伊派病毒(Ippy virus, IPPYV);1977年在南非多乳鼠(Mastomysnatalensis)中发现莫佩亚病毒(Mopeia virus, MOPV);1983年在中非共和国软毛鼠(Praomysspp )中发现莫巴拉病毒(Mobala virus, MOBV);1990年在阿根廷雷鼠(Necromys benefactus)中发现奥利华恩病毒(Oliveros virus, OLVV);1995年在委内瑞拉棉鼠(Sigmomysalstoni)中发现皮雷特尔病毒(Pirital virus,PIRV);1997年在秘鲁巴西屋鼠(Oecomysparicola)中发现奥尔帕瓦约病毒(Allpahuayo virus, ALLV),在阿根廷黑大刀小鼠(Bolomyssp.)中发现潘帕病毒(Pampa virus,PAMV);1998年在美国鹿鼠(Peromyscuscalifornicus)中发现熊峡谷病毒(Bear Canyon virus,BCNV);1999年在北美德克萨斯州小足林鼠(Neotomamicropus)中发现卡塔琳娜病毒(Catarina, CTNV);2002年在北美亚利桑那州墨西哥林鼠 (Neotomamexicana)中发现斯金纳坦克病毒(Skinner Tank virus,SKTV);2008年在北美亚利桑那州白喉林鼠(Neotomaalbigula)中发现大布拉希坦克病毒 (Big Brushy Tank, BBTV)及克里克印第安人病毒(Tonto Creek, TTCV);2009年在赞比亚多乳鼠(Mastomysnatalensis)中发现露娜病毒(Luna virus, LUNV)[38]。
表1 沙粒病毒名、宿主动物、分布及所致人类疾病
Tab.1 Name, host, distribution and causing human diseases ofArenaviridae

病毒种类宿主动物地理分布致人类疾病病死率报道年份淋巴细胞脉络丛脑膜炎病毒LCMV小家鼠(Mus muscu-lus)全球无菌性脑膜炎<1%1933胡宁病毒JUNV壮暮鼠(Calomys mus-culinus)南美洲,阿根廷潘帕斯草原 阿根廷出血热20%~30%1958马秋博病MACV胼胝暮鼠(Calomys callosus)南美洲,玻利维亚贝尼地区玻利维亚出血热25%~35%1963拉沙病毒 LASV多乳鼠(Mastomys na-talensis)西非,输入病例(欧洲、美国、日本)拉沙出血热1.7%~5%1969瓜纳瑞托病毒GTOV短尾茎鼠(Zygodonto-mys brevicauda)南美洲,委内瑞拉委内瑞拉出血热23.1%1989萨比亚病毒SABV未知(疑似啮齿动物) 南美洲,巴西巴西出血热1/31990怀特沃特阿罗约病毒WWAV白喉林鼠(Neotoma al-bigula)北美洲,美国新墨西哥州发热性感染,呼吸窘迫综合征3/31993弗莱克索病毒FLEV米鼠 (Oryzomys spp)巴西病毒性出血热未知2002恰巴雷病毒CHPV未知南美洲,玻利维亚恰巴雷出血热未知2004卢约病毒LUJV未知赞比亚,南非卢约出血热80%2008
3 沙粒病毒疫苗、治疗及预防
虽然研究出ARV疫苗是防治ARV引起的VHF的最好办法,但到目前为止,各国仍无上市的有资质的ARV疫苗。JUNV的减毒活疫苗Candid#1株在动物模型中可以产生很强的中和抗体,在人体可以有效抵抗AHF,且不产生严重的副作用,但该疫苗不能对抗疾病负担较重的LASV[39]。虽然各国都在投入人员和经费研究LASV疫苗,但还没有一种有效的疫苗进入临床研究阶段。MOPV/LASV重组株ML29减毒活疫苗和水泡性口炎病毒(Vesicular stomatitis virus,VSV)重组疫苗在动物模型包括非人灵长类可以产生很好的保护性抗体,但2种疫苗的安全性仍需长时间的观察[40]。最近,用反向遗传学方法用于JUNV和LASV毒力遗传性状的评价,加快了ARV疫苗的研制[39]。
体外和体内实验证实利巴韦林(1-β-D-ribofuranosyl-1,2,4-triazole-3-carboxa-mide,Rin)可以用来预防和治疗ARV感染,大大减低了由LASV、MACV和JUNV对人的感染造成的病死率和死亡率。Rin可以作为RNA病毒的RNA依赖的RNA酶的底物,引起病毒RNA的胞嘧啶(C)突变成尿嘧啶(U),或鸟嘌呤(G)突变成腺嘌呤(A),这种点突变往往是致命性的,所以Rin对于许多ARV有抗病毒作用。此外,肌苷酸脱氢酶、法匹拉韦和嘧啶生物合成抑制剂A3对ARV感染也有很强的抗病毒作用[39]。
控制传染源、切断传播途径和保护易感人群是防止ARV感染的主要预防措施,通过灭鼠,减少人与鼠类的接触和搞好个人防护是预防控制ARV感染的有效途径。发生ARV感染病例应立即进行隔离治疗,同时应防止院内感染的发生。
4 结 语
随着生态环境的不断恶化和人为因素的干预,ARV发生跨种传播的频率大大增加,新发和再发相关疾病的机会也随之增大。我国周边国家已有ARV感染的人间病例报道,同时,我国鼠间也存在ARV感染,而鼠类与人的生产和生活密切相关,ARV会引起人类严重的VHF,故我们有必要对这类ARV进行系统的研究,推进我国“一带一路”卫生战略,保障澜沧江—湄公河地区经济的繁荣发展。
利益冲突:无
