山莨菪碱预处理对大鼠肝缺血再灌注诱发肺损伤的影响
2019-02-19薛小红周荣胜
薛小红,李 璐,周荣胜
肝脏手术特别是肝移植手术中常出现肝缺血/再灌注(I/R)的操作过程,这可导致肺脏等多器官的损伤,严重者出现功能衰竭。肝脏手术I/R所致急性肺损伤的发病机制目前尚不清楚。山莨菪碱为M胆碱受体拮抗剂,研究[1]证实其对多个器官I/R损伤具有良好的保护作用。本研究制作70%肝脏I/R损伤模型,以山莨菪碱进行预处理,旨在探讨山莨菪碱预处理对大鼠肝I/R诱发肺损伤的影响,为临床防治研究提供理论支持。
1 材料与方法
1.1 实验动物及主要试剂、仪器 本实验选择健康清洁成年雄性SD大鼠48只,体质量210~280 g,由西安交通大学医学部动物实验中心提供。盐酸消旋山莨菪碱注射液(天津金耀氨基酸有限公司,批号:1409051);SP试剂盒购自北京中山生物技术有限公司;丙二醛(MDA)、髓过氧化物酶(MPO)与超氧化物歧化酶(SOD)试剂盒购自南京生物建成工程研究所;图像采集系统、光学显微镜等由西安交通大学医学院病理学实验室提供。
1.2 动物分组和模型制备 48只大鼠按随机数字表法平均分成3组,分别为假手术组(S组)、肝脏缺血再灌注组(IR组)和山莨菪碱预处理组(A组),每组16只。S组:大鼠开腹后分离肝门不做结扎;IR组:大鼠开腹后结扎肝门,60 min后恢复肝脏血流,开放血流3 h后处死大鼠;A组:制模过程同IR组,阻断入肝血流前30 min,自尾静脉注射稀释成1 mL的山莨菪碱(约2 mg/kg),其余同IR组。S组和IR组自尾静脉注射等剂量的0.9%氯化钠溶液。
按NAUTA等[2]的方法制作70%肝脏I/R模型:动物于术前禁食12 h,自由饮水,采用腹腔内注射10%水合氯醛(400 mg/kg)麻醉大鼠,2~4 min后以钳夹四肢无反应作为麻醉成功标志,然后将大鼠仰卧位固定于操作台上。经阴茎背静脉注入稀释肝素(200 U/kg),使其肝素化。自腹下部沿正中线纵行向上剪开皮肤,直至胸腹交界处。逐层打开腹腔,分离肝门及肝十二指肠韧带,寻找到肝门,IR组和A组用小动脉夹夹闭肝左叶和肝中叶部分肝门,30 min后松开小动脉夹肝脏恢复血流,然后逐层关闭腹腔,3 h后处死大鼠。S组只解剖,肝门不作血管夹闭。
1.3 标本的采集 大鼠处死后,取右肺上叶置于10%中性甲醛溶液浸泡固定,待行HE染色和免疫组织化学(免疫组化)。取右肺下叶组织,称重为湿重,然后放入70 ℃烤箱中烘烤48 h后,称重为干重,计算肺组织湿重/干重(W/D)比值。取部分右肺组织用滤纸吸干,置于-70 ℃冰箱保存,待进一步检测MDA含量、MPO和SOD活性。
1.4 指标检测
1.4.1 组织形态学观察(HE染色) 取部分肺组织经过脱蜡,水化,染色,脱水,透明,封片,在100倍和400倍光镜下观察肺组织病理形态学变化,采集图像。
1.4.2 免疫组化法检测HO-1和iNOS蛋白 取部分右上叶肺组织标本,石蜡包埋,制成3 μm厚的切片。SP法免疫组化染色按SP试剂盒操作说明实施。随机抽取上述切片,以PBS代替HO-1和iNOS多克隆抗体作为阴性对照(其余步骤不变)。全自动图像分析系统对阳性染色进行分析,测定HO-1和iNOS阳性表达的吸光度值,随机测定5个高倍视野,计算其平均值作为该切片的代表值。
1.4.3 肺组织MDA、SOD和MPO的测定 取部分肺组织50 mg用冷0.9%氯化钠溶液制成肺组织匀浆,4℃ 3 000 r/min离心10 min,上清液-80 ℃保存,检测前再次离心取上清液;用试剂盒分别采用硫代巴比妥酸法测定MDA含量、黄嘌呤氧化酶法测定SOD活性和过氧化氢还原法测定MPO活性,严格按照试剂盒说明书操作步骤进行检测。
1.5 统计学方法 采用单因素方差分析和q检验。
2 结果
2.1 大鼠肺组织病理形态学观察
2.1.1 肺脏组织大体观察 S组双肺组织表面光滑,呈淡粉红色,打开胸腔后很快萎缩;IR组肺脏体积增大颜色变深,组织包膜下可见点状、片状出血灶,肺泡腔有渗出液;A组肺组织轻度增大,肺组织可见点状、片状出血灶,但较IR组轻。
2.1.2 光镜下肺组织HE染色结果 S组肺组织结构完整,未见明显的异常,肺泡腔完整,由单层肺泡上皮细胞组成;IR组肺组织血管充血,肺泡腔破裂且大小不一,可见红色渗出液,肺间质增厚水肿,有大量炎性细胞浸润;A组肺组织可见充血水肿,肺间质增厚有炎性细胞浸润,但较IR组轻(见图1)。
2.2 大鼠肺组织HO-1和iNOS表达
2.2.1 肺组织HO-1表达 光镜下,IR组、A组大鼠肺组织肺泡上皮细胞、肺间质炎性细胞及血管内皮细胞等细胞内HO-1的表达呈阳性(呈棕黄色),A组表达最强,S组表达最弱(呈弱阳性)。与S组比较,IR组和A组肺组织HO-1蛋白表达均明显增加(P<0.01);与IR组比较,A组肺组织HO-1蛋白表达明显增加(P<0.01)(见表1、图2)。

2.2.2 肺组织iNOS蛋白表达 光镜下,IR组和A组大鼠肺组织中肺泡间质的血管平滑肌细胞、单核-巨噬细胞、支气管上皮细胞、血管内皮细胞等胞内iNOS的表达呈阳性(呈棕黄色),IR组表达最强,S组表达最弱(呈弱阳性)。与S组比较,IR组和A组肺组织iNOS蛋白表达均明显增加(P<0.01);与IR组比较,A组肺组织iNOS蛋白表达明显降低(P<0.01)(见表1、图3)。

表1 3组大鼠肺组织HO-1和iNOS蛋白表达的比较
2.3 肺组织W/D比值、MDA含量、SOD和MPO活性的变化 与S组比较,IR组和A组肺组织W/D比值、MDA含量、MPO活性均明显增高(P<0.01),SOD活性均明显降低(P<0.01);与IR组相比较,A组肺组织W/D比值、MDA含量、MPO活性均明显降低(P<0.01),SOD活性明显增高(P<0.01)(见表2)。
3 讨论
肝脏I/R损伤在临床上十分常见,创伤、休克、肝叶切除、肝移植等过程中都有可能发生,不仅引起肝脏本身的损害,还可导致远隔器官如肺、肾、小肠等器官的功能受损,肺脏是其中最易受累的器官之一。我们的前期研究[3]发现,肝I/R损伤能加重大鼠肺损伤,上调肺组织中的HO-1及iNOS表达。本实验研究结果显示,与S组比较,IR组和A组肺组织HE染色病理改变显著加重,肺叶W/D比显著升高,肺组织MDA、MPO表达显著升高,而SOD显著降低,表明肝I/R过程中造成了肺损伤。

表2 3组肺组织W/D比值 、MDA含量、MPO和SOD活性的比较
山莨菪碱是提取自茄科植物山莨菪中的一种生物碱,与阿托品等莨菪烷类药物同属于M胆碱受体拮抗剂[4]。主要用于治疗胃肠道痉挛收缩所引起的腹痛、感染中毒性休克等[5]。近年来研究[6]发现山莨菪碱对生命重要器官脑、肝、肾、心等器官的I/R损伤具有良好的保护作用,但其机制尚不清楚。研究[7-8]证实山莨菪碱对大鼠肝脏I/R损伤有保护作用,其机制可能是山莨菪碱能改善再灌注后的肝脏微循环障碍、减少氧自由基的生成。山莨菪碱可能通过抑制细胞因子肿瘤坏死因子-α、白细胞介素-6、白细胞介素-1等的释放,抑制中性粒细胞聚集和氧自由基的产生、稳定细胞膜和溶酶体膜、改善和疏通微循环等作用,对重要器官I/R损伤发挥保护作用[9]。实验过程中我们发现,山莨菪碱对I/R的肝脏具有保护作用。山莨菪碱是否对肝脏I/R损伤过程中肺损伤具有保护作用,目前尚少报道。因此,本实验首先建立70%肝脏I/R损伤模型,探讨山莨菪碱预处理对大鼠肝I/R诱发肺损伤的保护作用。
本研究参照文献[7-8]确定山莨菪碱剂量为2 mg/kg进行预处理,结果表明,与IR组比较,A组肺组织HE染色病理改变显著减轻,肺叶W/D比显著降低,肺组织MDA、MPO表达显著降低,而SOD表达显著升高,表明山莨菪碱预处理对肝脏I/R后肺损伤具有一定的保护作用。
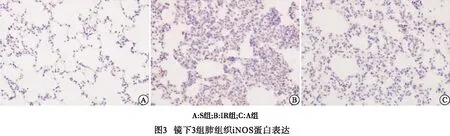
HO-1又称热休克蛋白32 (HSP32),是血红素的限速酶和关键酶,有研究[10]表明HO-1活性的上调,可产生抗炎、抗氧化、抗凋亡等生物学效应,对肝脏I/R损伤起重要的保护作用[10]。iNOS主要存在炎性细胞中,是一种重要炎性介质,病理状态下iNOS受炎性介质诱导生成增加,可产生大量NO,然而病理情况下大量的NO参与介导许多病理过程如肝脏I/R损伤、炎症及休克等,导致器官损伤[11]。本实验研究发现,与S组比较,IR组和A组的HO-1和iNOS蛋白表达显著增加;与IR组比较,A组的HO-1蛋白表达显著增加,而iNOS蛋白表达显著降低。表明肝脏I/R损伤后肺组织中HO-1和iNOS蛋白表达都显著增加,而山莨菪碱预处理可以显著增加HO-1蛋白表达和减少iNOS蛋白表达,这可能与山莨菪碱预处理能减轻肝脏I/R后肺损伤的机制有关。
综上所述,山莨菪碱预处理可减轻大鼠肝I/R肺损伤,其机制可能与上调肺组织中的HO-1及下调iNOS蛋白表达有关。但肝脏I/R肺损伤是个多环节构成、多因素参与的复杂过程,是否存在其他方面的因素,有待我们进一步研究。
