五味子乙素对链脲佐菌素诱导的糖尿病大鼠视网膜病变的保护作用及机制研究①
2019-02-18刘青
刘 青
(西京学院医学院,西安 710000)
糖尿病视网膜病变(Diabetic reinopathy,DR)是糖尿病最常见的微血管并发症[1,2]。目前,DR发病的增长速度虽然已得到了一定的控制,但其仍是导致成年人失明的主要原因之一[3]。研究表明,视网膜炎症、细胞凋亡、脂质过氧化及异常血管增生都是导致DR恶化的主要原因[4-7]。因此,若能有效调控DR的多个病理环节将有利于DR的治疗。五味子乙素(Schisandrin B,SB)是中药五味子的主要有效成分之一,其具有抗炎、抗癌、抗氧化等药理学功效[8-10]。研究表明,五味子可抑制糖尿病大鼠钠葡萄糖共转运载体的活性[11]。五味子素可对抗烟酰胺腺嘌呤二核苷酸磷酸(Nicotinamide adenine dinucleotide phosphate,NAPDH)诱导的糖尿病肾病氧化损伤,提高糖尿病大鼠对胰岛素的敏感性[12,13]。也有研究表明,SB可减轻四氯化碳(Carbon tetrachloride,CCl4)诱导的糖尿病大鼠肝损伤[14]。但其对DR的作用还未见报道。因此,本文将采用链脲佐菌素(Streptozotocin,STZ)复制大鼠DR模型,探讨SB对DR的作用及作用机制。
1 材料与方法
1.1试剂与仪器 超氧化物歧化酶(Superoxide dismtase,SOD)、丙二醛(Malondiadehyde,MDA)和乳酸盐脱氢酶(Lactate dehydrogenase,LDH)试剂盒购自南京建成生物工程研究所。白介素-6(Lnterleukin-6,IL-6)、IL-1β和肿瘤坏死因子(Tumor necrosis factor,TNF-α)ELISA试剂盒购自美国Miliipore公司。SB购自北京索莱宝公司。内皮细胞生长因子(Vascular endothelial growth factor,VEGF)抗体购自英国Abcam公司,细胞分裂周期蛋白42(Cell division cycle,Cdc42)和p-p38一抗购自美国CST公司。
1.2方法
1.2.1动物模型的建立 Wistar大鼠购自上海实验动物研究中心。将大鼠适应性喂养3 d后,随机分为对照组、SB 组、STZ组和STZ+SB 组。实验前12 h禁食禁水。STZ组和STZ+SB 组大鼠一次性腹腔注射STZ(58 mg/kg)诱导高血糖,对照组和SB组注射等量生理盐水,3 d后尾静脉取空腹血,用血糖仪检测血糖浓度,血糖浓度高于400 mg/dl(22 mmol/L)视为造模成功。剔除造模未成功的大鼠,SB组和STZ+SB 组大鼠连续灌胃给予SB(50 mg/kg)9个月。9个月后摘取眼球并收集血液进行后续实验。
1.2.2TUNEL 摘取大鼠眼球,用4%多聚甲醛固定过夜后,去除晶状体,使余下组织包含全部视网膜,制作视网膜石蜡切片。根据TUNEL试剂盒说明书检测凋亡小体。切片脱蜡后,用3%的H2O2处理10 min。滴加0.5%的Proteinase K 37℃孵育10 min,随后加入TdT和生物素标记的dUTP混合液37℃处理30 min,弃去混合液,待玻片干后,滴加TUNEL混合液,最后滴加DAB显色,苏木精复染、脱水、封片。于显微镜下每片随机选取6个视野进行计数统计。
1.2.3SOD、MDA和LDH含量的检测 将实验所得全血以3 000 r/min的转速4℃离心15 min,取上清液,根据试剂盒说明书检测上清液中SOD、MDA和LDH的含量。
1.2.4ELISA 根据ELISA试剂盒说明书检测全血上清液中IL-6、TNF-α和IL-1β的含量。
1.2.5Western blot 用蛋白裂解液和蛋白酶抑制剂混合液提取视网膜组织蛋白。用BCA试剂盒检测总蛋白质浓度并调平。10% SDS-PAGE分离各组蛋白质并转移至PVDF膜。用5%脱脂牛奶室温封闭PVDF膜2 h,随后加入一抗(VEGF,1∶1 000;Cdc42,1∶1 000;p-p38,1∶1 000),4℃封闭过夜。第2天用TBST洗膜3次后,加入HRP标记的二抗于室温孵育1 h,最后加入ECL显色液曝光显影。

2 结果
2.1SB 对DR大鼠血糖的影响 为了检测DR大鼠模型是否建立成功,我们检测了STZ注射3 d后大鼠的血糖浓度。实验结果表明,与对照组比较,SB组大鼠血糖无明显变化(P>0.05,图1),STZ组血糖浓度明显升高(P<0.001,图1),且高于22 mmol/L,表明造模成功;同时,SB 能明显减弱STZ诱导血糖升高的作用(P<0.05,图1)。
2.2SB对视网膜细胞凋亡的影响 为了探究SB 对DR大鼠视网膜细胞凋亡的影响,我们检测了凋亡小体的形成情况。STZ可显著促进视网膜凋亡小体的形成(P<0.001,图2),SB 则能明显减弱STZ对凋亡小体形成的诱导作用(P<0.05,图2)。
2.3SB 对DR大鼠氧化应激的影响 为了探究SB对STZ诱导的DR大鼠氧化应激的影响,我们检测了外周血中SOD、MDA和LDH的含量。实验结果表明,STZ可明显降低血清中SOD的含量,促进MDA和LDH的分泌(P<0.01,图3)。SD能显著减弱STZ对SOD分泌的抑制作用,降低MDA和LDH的含量(P<0.05,图3)。
2.4SB 对DR大鼠炎症反应的影响 ELISA实验结果表明,与对照组比较,SB组炎症因子IL-6、TNF-α和IL-1β的含量无显著变化(P>0.05,图4),STZ组IL-6、TNF-α和IL-1β的含量明显增多(P<0.01,P<0.001,图4);与STZ 组比较,STZ+SB组血清中IL-6、TNF-α和IL-1β含量明显增多(P<0.05,图4)。
2.5SB 对Cdc42/P38通路的影响 为了探究SB对STZ诱导的DR的作用机制,我们检测了血管新生标记分子VEGF及其下游信号通路蛋白的表达情况。实验结果表明,STZ能显著促进VEGF、Cdc42和p-p38的表达(P<0.01,P<0.001,图5),SB能显著下调DR大鼠视网膜VEGF、Cdc42和p-p38的蛋白表达水平(P<0.05,图5)。
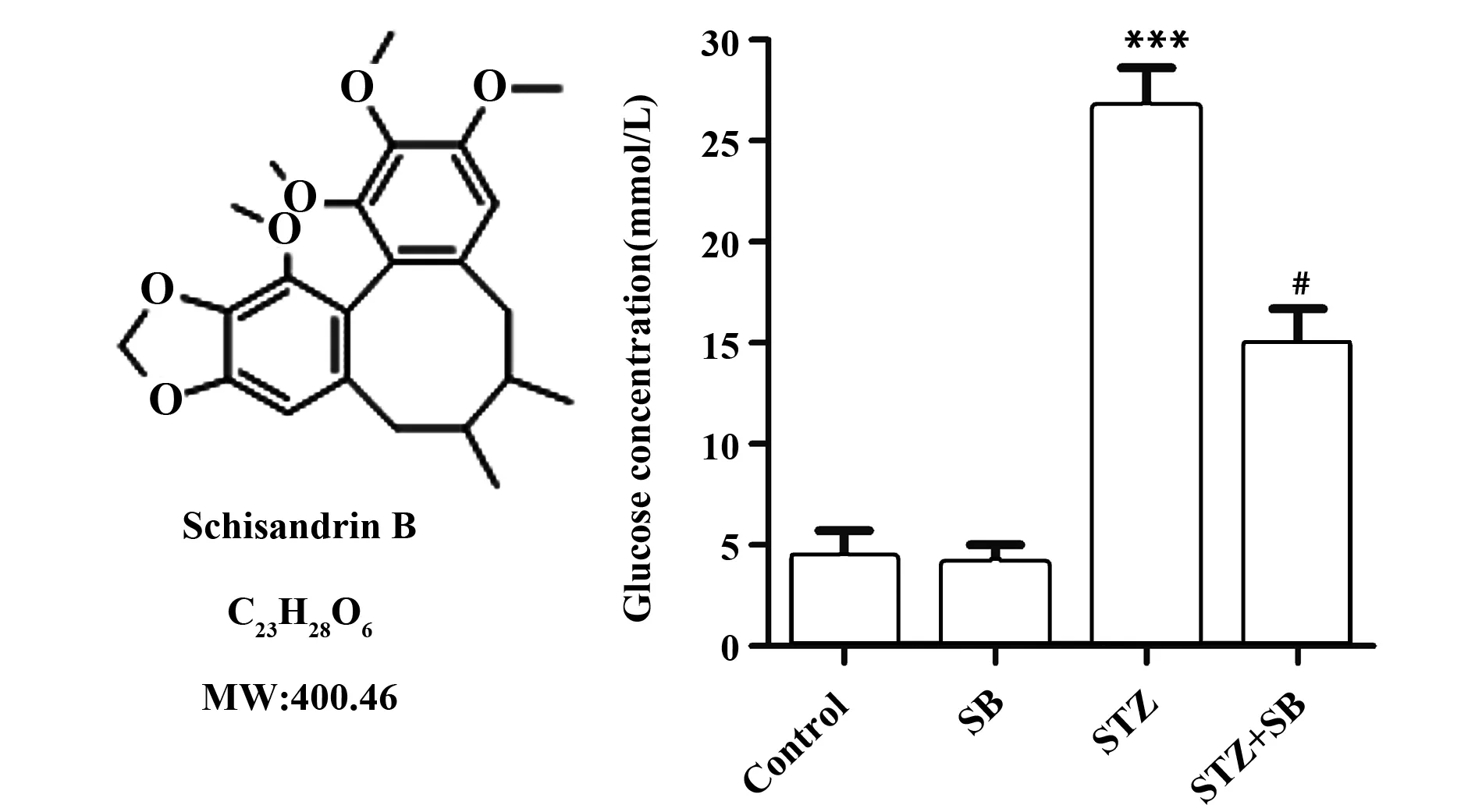
图1 SB对DR大鼠血糖的影响Fig.1 Effect of SB on blood glucose level of ratsNote: A.The chemical structural formula of SB;B.The quantification of blood glucose of rats.***.P<0.001 vs control group;#.P<0.05 vs STZ group.


图2 SB对视网膜细胞凋亡的影响

图3 SB对DR大鼠氧化应激的影响Fig.3 Effect of SB on oxidative stress of DR ratsNote: The concentrations of SOD,MDA and LDH were measured by kits.**.P<0.01 vs control group;#.P<0.05 vs STZ group.
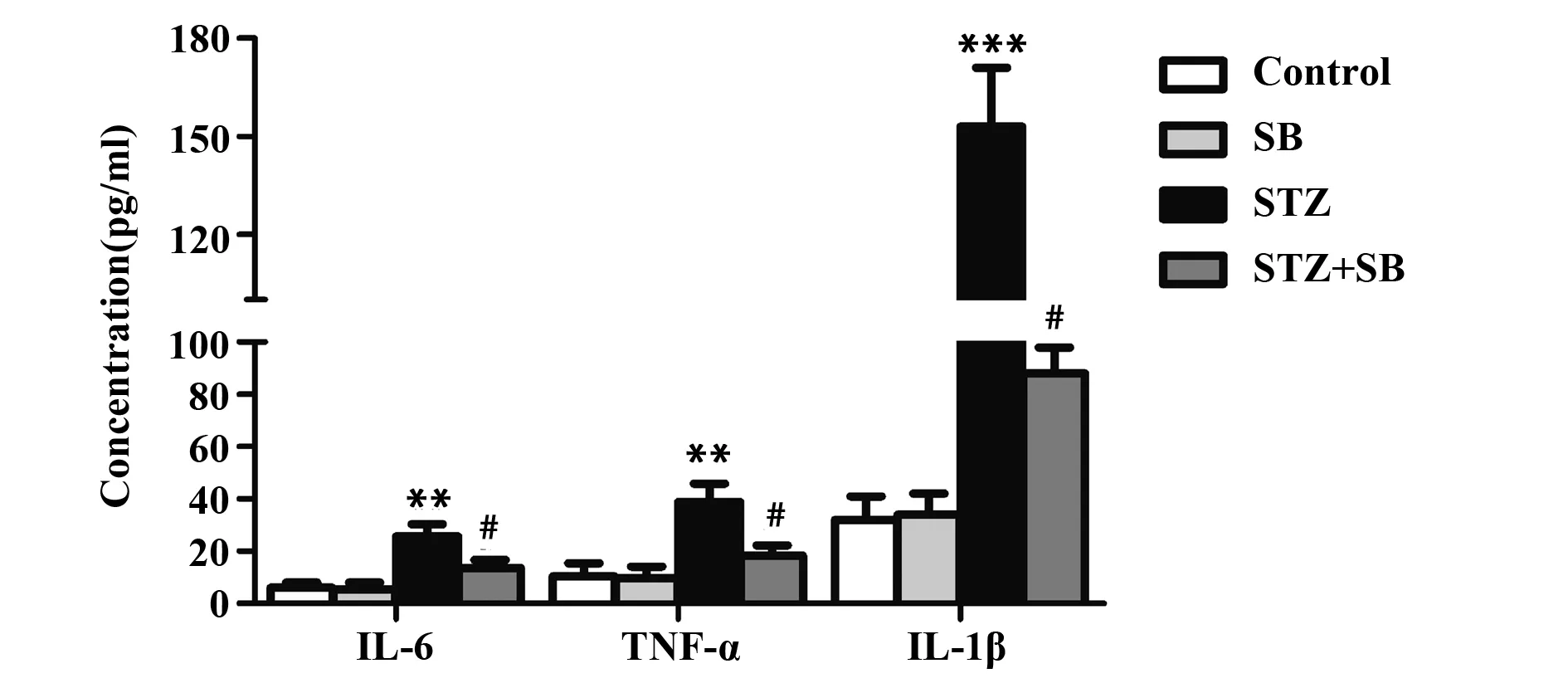
图4 SB对DR大鼠炎症反应的影响Fig.4 Effect of SB on inflammation of DR ratsNote: The concentrations of IL-6,TNF-α and IL-1β were determined by ELISA assay.**.P<0.01,***.P<0.001 vs control group;#.P<0.05 vs STZ group.

图5 SB 对Cdc42/p38通路的影响Fig.5 Effect of SB on Cdc42/p38 signaling pathwayNote: A.The protein levels of VEGF,Cdc2 and p-p38 were measured by Western blot;B.The quantification of protein levels of VEGF,Cdc2 and p-p38.GAPDH was used as loading control.**.P<0.01,***.P<0.001 vs control group;#.P<0.05,##.P<0.001 vs STZ group.
3 讨论
细胞凋亡是导致DR的重要机制之一[15]。在DR中,新陈代谢紊乱会导致视网膜细胞凋亡、糖基化终产物的形成、白细胞聚集及氧化应激的发生[6]。研究表明,视网膜神经细胞的凋亡会导致视网膜功能减退,周细胞及血管内皮细胞的凋亡是引起血管渗透性增高的主要原因[4,16,17]。在本研究中,我们采用腹腔注射STZ的方法复制大鼠DR模型并给予大鼠SB 9个月。实验结果显示,SB对正常大鼠的凋亡小体形成没有明显影响,表明该剂量下的SB对视网膜细胞没有明显的毒副作用。但SB能显著抑制DR大鼠视网膜凋亡小体形成,表明SB具有抗DR大鼠视网膜细胞凋亡的作用。
研究表明,DR的高糖和高脂肪酸环境能通过激活线粒体电子传递链诱导过氧化物的生成,从而导致脂质过氧化,脂质过氧化能进一步降低细胞膜的流动性、影响Na+-K+平衡、使细胞膜通透性升高,同时还能改变线粒体膜电位,诱导细胞凋亡[18,19]。大量研究表明,中药有效成分具有抗DR氧化应激的作用。如柚苷、橙皮素和生草酚等均可通过调控SOD、MDA及NO等的表达减缓DR的发展[20-22]。也有研究表明,SB可通过调控ROS通路减轻NAPDH氧化酶对糖尿病肾病系膜细胞的损伤[12]。本文研究发现,SB可明显促进SOD的分泌,降低DR大鼠血清MDA和LDH的含量。其中,SOD是超氧阴离子自由基清除剂,可减少过氧化氢的生成[23]。MDA是脂质过氧化反应链的终产物,因此,其含量的变化反映了脂质过氧化程度[24]。LDH是参与糖酵解和糖异生的重要酶。在正常情况下,血清中LDH的含量较少,但当细胞膜通透性增加时,LDH可大量的进入血液[25]。结合实验结果表明,SB可减轻STZ诱导的DR大鼠视网膜的脂质过氧化,增强DR大鼠抗自由基损伤的能力,从而降低细胞膜通透性。
研究表明,TNF-α、IL-1β、IL-6等炎症因子表达增多可诱导DR模型鼠视网膜结构和功能的改变[26,27]。下调IL-1β的表达可抑制视网膜毛细血管的退化[26]。玻璃体内注射TNF-α可抑制糖尿病大鼠视网膜周细胞凋亡和毛细血管变性[27]。敲除TNF-α基因可降低糖尿病小鼠视网膜血管通透性、减少白细胞黏附[28]。本文研究发现,TNF-α、IL-1β和IL-6在STZ诱导的DR大鼠外周血中均呈高表达状态,SB能显著降低血清中TNF-α、IL-1β和IL-6的含量,表明SB可抑制STZ诱导的炎症反应。
VEGF是调控血管新生的重要细胞因子,能够促进内皮细胞的增殖、迁移及基底膜的降解,在促进视网膜血管新生过程中发挥重要作用[29]。视网膜血管新生是指视网膜血管的异常生长,也是增殖性DR的重要特征[30]。同时,VEGF还可调控DR炎症反应,可促进黏附因子及炎症的表达,诱导白细胞激活[31]。因此,下调VEGF表达被认为是目前治疗DR最可行的方法。并且哌加他尼、兰尼单抗及阿伐斯汀等VEGF抑制剂已进入治疗DR的临床试验阶段[30]。我们的研究发现,SB可明显抑制VEGF的表达。此外,SB还能明显抑制DR大鼠Cdc42和p-p38的表达。Cdc42和p38是VEGF下游Cdc42/p38信号通路的标记蛋白。研究表明,VEGFR2是主要参与调控内皮细胞增殖和迁移的VEGF受体[32]。VEGF与VEGFR2结合后,VEGFR2首先进行自身磷酸化进而激活Cdc42,活化的Cdc42和VEGFR2又可进一步激活p38,诱导内皮细胞迁移[33]。也有研究表明,IL-4可通过调控Cdc42-p38 MAPK通路促进IL-6的表达,提示Cdc42/p38信号通路可能也参与了炎症反应的调控[34]。结合实验结果表明,SB可下调VEGF表达并可通过Cdc42/p38信号通路抑制STZ诱导的DR大鼠视网膜炎症反应和血管新生。
综上所述,SB可降低DR大鼠血糖水平、抑制视网膜细胞凋亡及氧化应激,可通过抑制炎症因子及VEGF的表达抑制视网膜炎症反应及血管新生,并且其机制与抑制Cdc42/p38信号通路激活有关。
