抑制免疫抑制因子COX-2对视网膜神经节细胞凋亡的影响及p38MAPK信号的调控作用
2019-02-18崔春梅李月华
崔春梅 李月华 刘 颖 陶 勇
(首都医科大学附属北京朝阳医院眼科,北京 100020)
多种眼部疾病及肿瘤压迫、机械性损伤等可引起视神经损伤,患者的视神经严重损伤后可引起视神经的萎缩,易造成失明,目前临床上有效的治疗视神经损伤的方法不多,且达不到预期的效果[1,2]。视网膜神经节细胞(Retinal ganglion cells,RGCs)位于视网膜底层,有研究显示,视神经损伤、糖尿病视网膜病变、青光眼等多种疾病均可引起RGCs的凋亡,而RGCs在受损的视神经中的再生比较困难[3-5]。因此,如何降低视神经受损后RGCs的凋亡成为研究热点。环氧合酶-2(Cyclooxygenase-2,COX-2)是环氧合酶的诱导酶,在炎症过程中发挥重要作用,可促进血管的生成,因而成为血管增生性疾病治疗的一个新型候选药物。此外,也有多项研究发现,COX-2可导致视网膜的损伤[6,7]。NS-398是COX-2的一种选择性抑制剂,有研究显示,NS-398可降低NMDA诱导的视网膜神经节细胞层神经元凋亡,从而对视网膜起到保护作用,也可抑制视网膜新生血管形成[8,9],但NS-398如何调控RGCs生物学特性目前还未清楚。RGC-5细胞在RGCs研究中有广泛应用,有多种细胞凋亡模型,如H2O2损伤模型、高血糖损伤模型等,其中H2O2细胞凋亡模型在基础研究中应用最为广泛,且在大量研究中也使用此模型研究RGCs凋亡。因此,本研究建立H2O2诱导RGC-5细胞凋亡,检测NS-398对细胞活力及凋亡的影响,并进一步探讨对p38MAPK信号通路的影响。
1 材料与方法
1.1材料 视网膜神经节RGC-5细胞购自美国ATCC;H2O2(10 mol/L)购自广州化学制药厂;NS-398(纯度>98%)购自美国Sigma,用DMSO溶解;SB203580购自上海西宝生物科技;DMEM培养基、胎牛血清均购自美国Hyclone公司;胰蛋白酶、MTT和NS-398购自美国Sigma公司;细胞增殖核抗原(Proliferating cell nuclear antigen,PCNA)、p53、p38丝裂原活化蛋白激酶(p38 Mitogen-activated protein kinases,p38MAPK)、p-p38抗体均购自美国Cell signal公司;膜联蛋白V-FITC(Annexin V-FITC)/碘化丙锭(PI)凋亡试剂盒购自南京凯基生物科技发展公司;二喹啉甲酸(Bicinchoninic acid,BCA)试剂盒购自上海申能博彩生物科技有限公司;酶标仪购自瑞士TECAN公司;流式细胞仪购自美国BD公司。
1.2方法
1.2.1细胞培养 取出在液氮罐中保存的视网膜神经节RGC-5细胞的冻存管,37℃水浴解冻,细胞解冻后用含10%胎牛血清的DMEM培养基进行常规培养,观察到细胞达到80%~90%生长密度时可进行传代。实验为生长至对数期的细胞。
1.2.2H2O2损伤模型建立 接种RGC-5于96孔板,培养24 h后以0、200、300、400、600、800 μmol/L的H2O2浓度处理细胞,培养箱内继续培养,培养7 h后将原培养基吸出,加入含有MTT溶液的DMEM培养基(不含血清)继续培养细胞4 h以使细胞能与MTT充分反应,吸出MTT后加入150 μl的DMSO溶液,振荡器振荡混匀10 min,酶标仪测定各浓度的细胞吸光度值(A值),计算细胞存活率。实验重复3次。
1.2.3COX-2抑制剂NS-398对H2O2诱导的RGC-5细胞活力的影响 实验分为3组:即空白对照组(DMSO+含有10%胎牛血清的培养基培养细胞7 h)、H2O2组(DMSO+含有400 μmol/L的H2O2及10%胎牛血清的培养基培养细胞7 h)、H2O2+NS-398组(含有400 μmol/L的H2O2及100 μmol/L的NS-398培养细胞7 h)。每孔细胞中加入MTT溶液(5 mg/ml)20 μl,于培养箱内4 h,加入DMSO溶液150 μl,振荡器上充分混匀10 min,酶标仪测定A值,计算细胞存活率。实验重复3次。
1.2.4COX-2抑制剂NS-398对H2O2诱导的RGC-5细胞凋亡的影响 收集按照1.2.3分组培养7 h的细胞,磷酸盐缓冲液洗涤细胞,胰酶消化细胞3 min,观察到细胞变圆时,吹打细胞使细胞悬浮在消化液中,含血清的培养基终止细胞消化,细胞消化完全后离心,轻轻吸取上清,加入200 μl的Loading buffer制备成单细胞悬液,置于避光环境中加入FITC标记的Annexin V和PI各5 μl,避光环境中反应15 min,1 h内用流式细胞仪检测各组细胞的凋亡情况。实验重复3次。
1.2.5蛋白质印迹(Western blot) 各组细胞中加入适量裂解液于冰上裂解30 min提取细胞总蛋白,BCA试剂盒对蛋白样品进行粗略定量,4∶1比例混匀蛋白样品与上样缓冲液,100℃煮沸变性5 min,每孔道取等量蛋白样品行SDS-PAGE,电泳后电转移至PVDF膜,室温5%脱脂奶粉封闭2 h,4℃孵育PCNA、p53、p38、p-p38及内参GAPDH抗体过夜,洗膜,加入二抗37℃孵育2 h,洗膜,ECL显色液显色,置于暗室中显影曝光条带。
1.2.6COX-2抑制剂NS-398对H2O2诱导的RGC-5细胞p38MAPK信号通路的调控RGC-5细胞经H2O2、NS-398和p38MAPK信号通路抑制剂SB203580(10 μmol/L)处理,细胞分为H2O2+NS-398组和H2O2+NS-398+SB203580组,参照1.2.3和1.2.4方法检测两组细胞的活力和凋亡率。

2 结果
2.1不同浓度H2O2对RGC-5细胞活力的影响 不同浓度的H2O2处理RGC-5细胞后,通过MTT法检测各组细胞活力,结果如表1所示,与0 μmol/L组比较,不同浓度的H2O2均可抑制RGC-5细胞活力,且随H2O2浓度升高细胞的活力降低,差异均具有统计学意义(P<0.05)。由于400 μmol/L的H2O2可抑制一半的细胞活力,选择作为研究对象。
2.2COX-2抑制剂NS-398对H2O2诱导的RGC-5细胞活力和凋亡的影响 通过MTT法检测COX-2抑制剂NS-398对H2O2诱导的RGC-5细胞活力的影响,流式细胞仪检测各组细胞凋亡,结果如图1所示,与空白对照组比较,H2O2组细胞活力显著降低,凋亡率显著升高,与H2O2组比较,H2O2+NS-398组细胞活力显著升高,凋亡率显著降低,差异具有统计学意义(P<0.05)。
2.3COX-2抑制剂NS-398对H2O2诱导的RGC-5细胞PCNA、p53、p38、p-p38蛋白表达的影响 通过Western blot检测 COX-2抑制剂NS-398对H2O2诱导的RGC-5细胞增殖相关蛋白PCNA、凋亡相关蛋白p53及p38和p-p38的蛋白表达,结果如图2所示,与空白对照组比较,H2O2组PCNA表达显著降低,p53和p-p38的表达显著升高,与H2O2组比较,H2O2+NS-398组PCNA表达显著升高,p53和p-p38的表达显著降低,差异均具有统计学意义(P<0.05)。三组间p38的蛋白表达差异无统计学意义(P>0.05)。
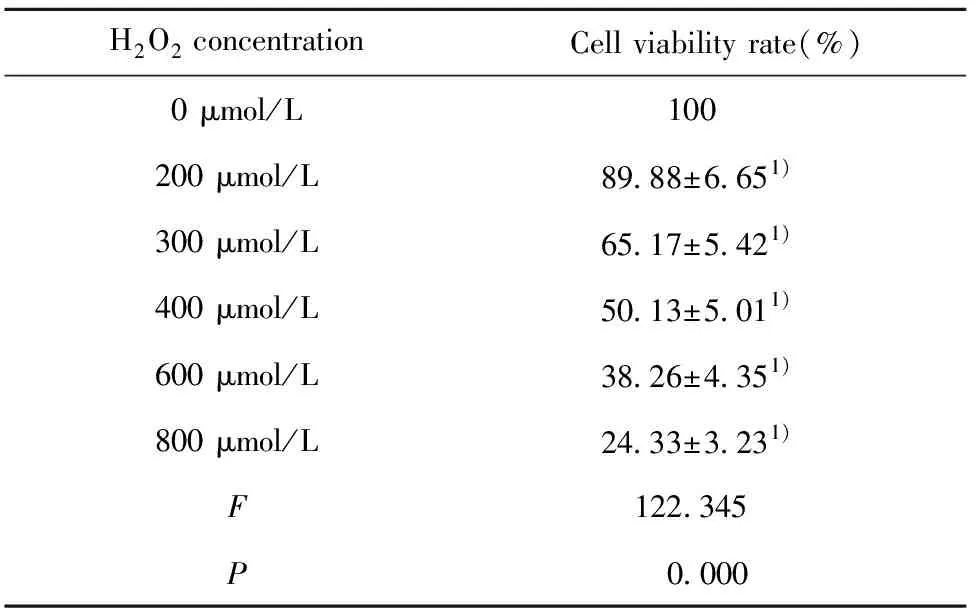
表1 不同浓度H2O2对RGC-5细胞活力的影响
Note:Compared with 0 μmol/L,1)P<0.05.

图1 COX-2抑制剂NS-398对H2O2诱导的RGC-5细胞活力和凋亡的影响Fig.1 Effect of COX-2 inhibitor NS-398 on activity and apoptosis of RGC-5 cells induced by H2O2Note: A.Cell viability;B.Detection results of flow cytometry;C.Cell apoptosis rate in each group.Compared with the control group,*.P<0.05;compared with the H2O2group,#.P<0.05.
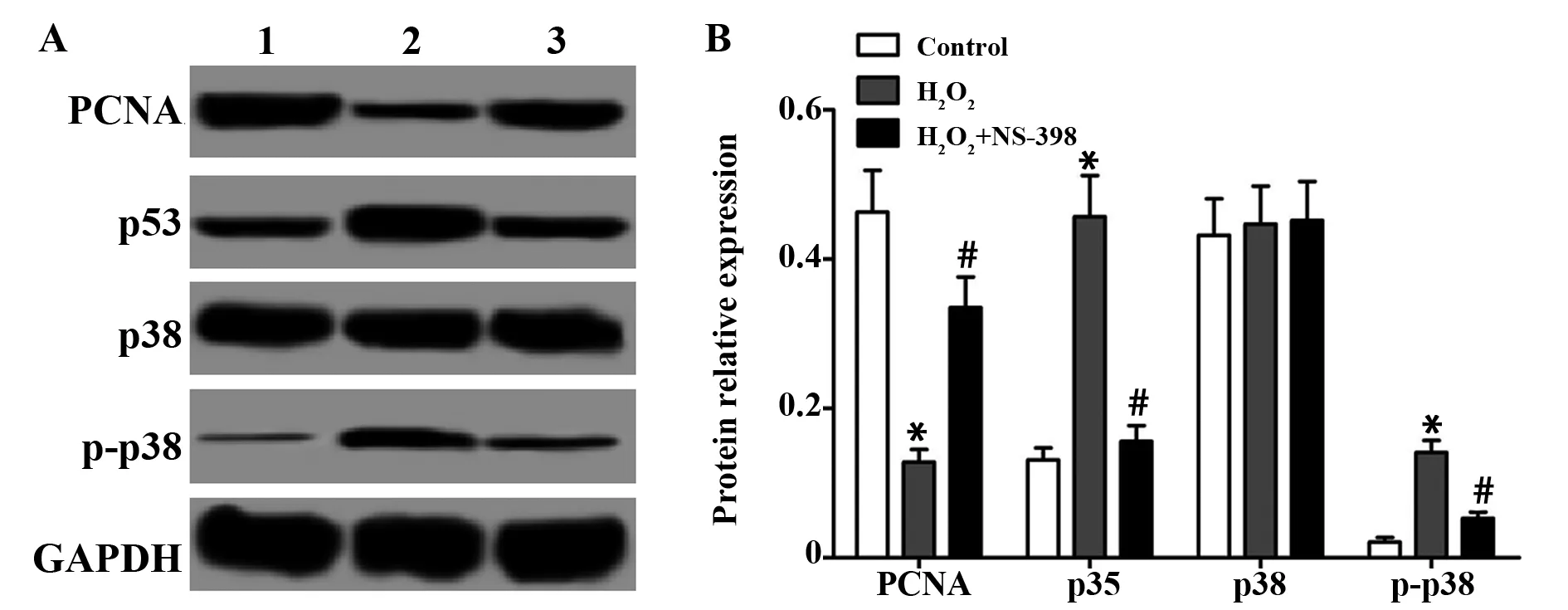
图2 COX-2抑制剂NS-398对H2O2诱导的RGC-5细胞PCNA、p53、p38、p-p38蛋白表达的影响Fig.2 Effect of COX-2 inhibitor NS-398 on expression of PCNA,p53,p38 and p-p38 proteins in RGC-5 cells induced by H2O2Note: 1.Control group;2.H2O2group ;3.H2O2+NS-398 group.A.Western blot test result diagram;B.The relative expression of each protein.Compared with the control group,*.P<0.05;compared with the H2O2group,#.P<0.05.

图3 COX-2抑制剂NS-398通过p38MAPK信号通路对H2O2诱导的RGC-5细胞凋亡的影响Fig.3 Effect of COX-2 inhibitor NS-398 on apoptosis of RGC-5 cells induced by H2O2through p38MAPK signaling pathway
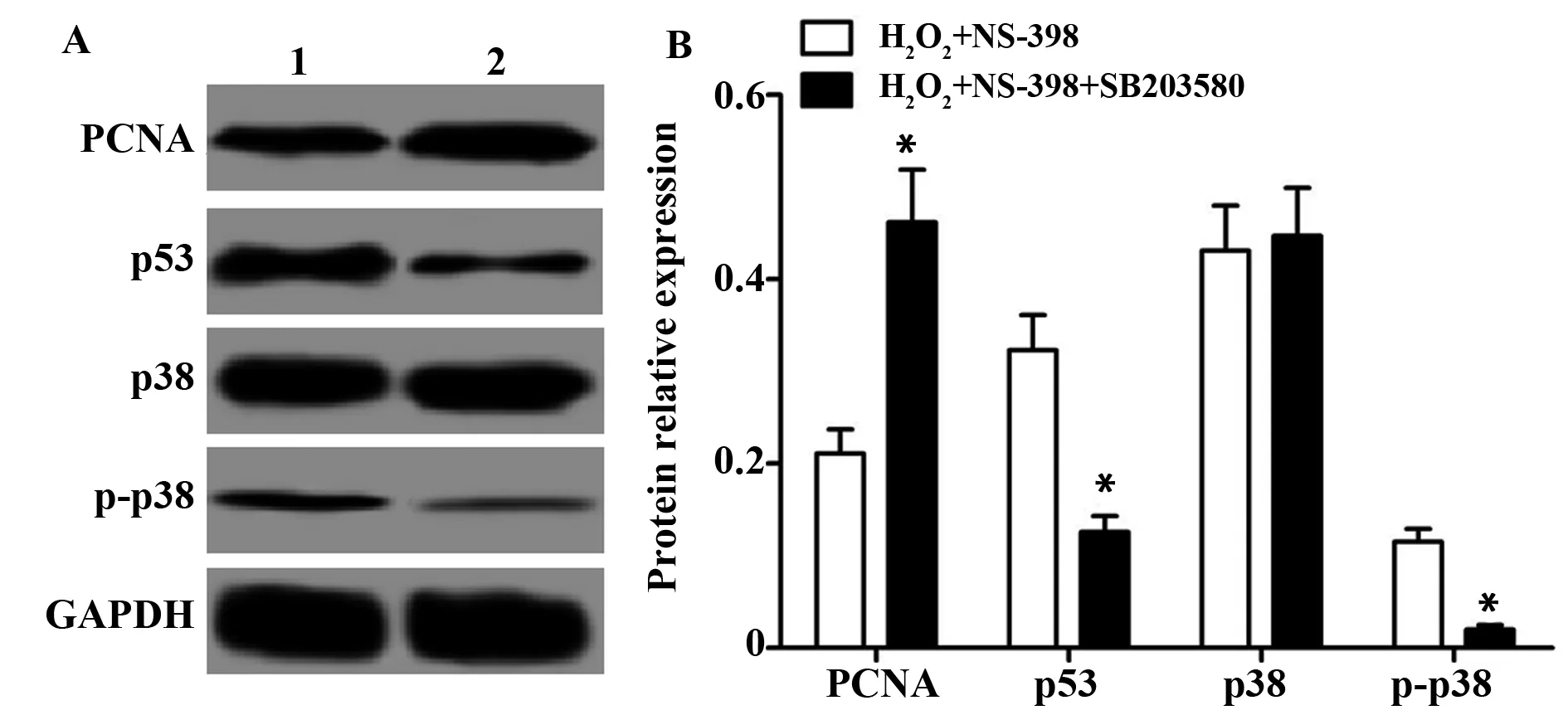
图4 COX-2抑制剂NS-398通过p38MAPK信号通路对H2O2诱导的RGC-5细胞PCNA、p53、p38、p-p38蛋白表达的影响Fig.4 Effect of COX-2 inhibitor NS-398 on expression of PCNA,p53,p38 and p-p38 protein in H2O2induced RGC-5 cells through p38MAPK signaling pathwayNote: A.Western blot test result diagram;B.The relative expression of each protein.1.H2O2+NS-398 group;2.H2O2+NS-398+SB203580 group.Compared with the H2O2+NS-398 group,*.P<0.05.
2.4COX-2抑制剂NS-398通过p38MAPK信号通路对H2O2诱导的RGC-5细胞活力和凋亡的影响 各组细胞活力及凋亡率检测结果如图3所示,与H2O2+NS-398组比较(68.77±5.22)%、(3.63±0.37)%,H2O2+NS-398+SB203580组细胞活力(86.46±6.17)%显著升高,细胞凋亡率(2.44±0.31)%显著降低,差异具有统计学意义(t1=3.792,t2=4.270,P<0.05)。
2.5COX-2抑制剂NS-398通过p38MAPK信号通路对H2O2诱导的RGC-5细胞PCNA、p53、p38、p-p38蛋白表达的影响 各组细胞中PCNA、p53、p38、p-p38的蛋白表达结果显示,与H2O2+NS-398组比较,H2O2+NS-398组+SB203580组PCNA的蛋白表达显著升高(t=6.940,P<0.05),p53和p-p38的蛋白表达均显著降低(t1=8.197,t2=6.063,P<0.05),两组间p38的蛋白表达差异无统计学意义(t=0.388,P>0.05)。见图4。
3 讨论
细胞凋亡是细胞的一种自然死亡过程,既可由生理性引起,也可由病理刺激引起[10]。有研究证实,RGCs的死亡可通过细胞凋亡的方式,Caspase、p53等细胞内部基因均可直接对细胞凋亡进行调控,而外部因素则可通过信号转导途径对细胞凋亡进行调控[11,12]。氧化应激为一种细胞外部因素,参与白内障、青光眼、干眼症、角膜炎等多种眼部疾病[13-15]。H2O2为一种引起细胞凋亡的介质,可通过氧化应激引起细胞凋亡,也有多项研究证实氧化应激可引起RGCs的凋亡[16]。COX-2主要分布于核膜,内皮素、生长因子、促肿瘤剂等多种因素均可引起COX-2基因的表达,COX-2的高表达可参与多种生理及病理过程[17,18]。有研究显示,在糖尿病大鼠模型中随着诱导时间延长,COX-2的表达升高,COX-2在大鼠角膜新生血管中表达升高,而美洛昔康可抑制其作用[19]。NS-398为一种新型的COX-2的抑制剂,可特异性的抑制COX-2在细胞内的表达,有研究显示,在研究角膜新生血管模型中,NS-398可降低COX-2表达,通过阻断VEGF和PGE2的产生而抑制角膜新生血管化[20,21]。但NS-398对RGCs的影响还未清楚。
本研究中通过H2O2刺激RGC-5,建立H2O2诱导RGC-5细胞凋亡,检测NS-398对细胞活力及凋亡的影响。结果显示H2O2可降低RGC-5细胞的活力,诱导细胞凋亡,而NS-398可提高细胞活力,降低细胞凋亡。这提示COX-2的抑制剂NS-398可降低由H2O2诱导的RGC-5细胞的凋亡,提高细胞活力。p38MAPK信号通路是细胞内一条重要的信号系统,活化的p38信号通路可引起细胞的免疫反应及炎症,或引起细胞凋亡、衰老等,在糖尿病视网膜病变形成及发展中有重要作用[22,23]。SB203580为p38MAPK信号抑制剂,有研究显示,SB203580可通过对下游p53、PCNA等因子的调节减轻糖尿病鼠视网膜RGCs凋亡及破坏[24]。
PCNA是细胞分裂增殖的一个必要条件,现多用其作为细胞增殖评价的指标[25]。p53为一个促进细胞凋亡基因,在对青光眼模型RGCs凋亡进行观察时,可发现细胞上有p53的表达[26]。本研究结果显示,H2O2可上调磷酸化的p38和p53表达,下调PCNA表达,而NS-398可降低其表达。RGC-5细胞加入SB203580可增加细胞活力,降低细胞的凋亡,上调PCNA表达和下调p53表达。这提示COX-2抑制剂NS-398可通过调控p38MAPK信号影响RGC-5细胞生物学特性。
综上所述,抑制免疫抑制因子COX-2表达可通过调控p38MAPK信号通路提高视网膜神经节细胞活力和抑制细胞凋亡。其对细胞增殖及凋亡的影响方式是上调PCNA表达和下调p53表达。该研究为视神经损伤治疗提供了一定的理论基础,但本研究内容有限,还需更多的研究证实。