伊维菌素吡喹酮咀嚼片溶出度方法的建立
2019-02-17马秋冉董玲玲赵富华于晓辉
杨 星,马秋冉,董玲玲,赵富华,于晓辉
(中国兽医药品监察所,北京100081)
伊维菌素吡喹酮咀嚼片是“十二五”国家科技支撑计划项目研制的新制剂,是由伊维菌素、吡喹酮和赋形剂制成的咀嚼片,用于宠物犬体内外寄生虫的治疗[1]。伊维菌素[2]是大环内酯类体内外驱虫药,对丝虫、钩虫、圆虫、鞭虫、蛔虫等具有效果;吡喹酮[3]对动物体内线虫、吸虫、绦虫有效。通过两种药物组合,扩大驱虫谱,可提高一次性驱虫效果。
溶出度试验技术是评价口服固体制剂内在质量的一种重要手段[4],为有效控制伊维菌素吡喹酮咀嚼片的质量,需建立相应的溶出度测定方法。本文参考《普通口服固体制剂溶出度试验技术指导原则》[5]及相关文献[6-8],建立了同时测定伊维菌素与吡喹酮的溶出度方法。
1 材 料
1.1 仪器 高效液相色谱仪-二极管阵列检测器(Waters e2695 2998,Empower2色谱工作站软件);分析天平(梅特勒XS 205,十万分之一);RCZ-8B溶出试验仪(天津市天大天发科技有限公司)。
1.2 试药 伊维菌素对照品(含量:91.0%,批号:K0191406,中国兽医药品监察所);吡喹酮对照品(含量:99.7%,批号:100046-201205,中国食品药品检定研究院);伊维菌素吡喹酮咀嚼片3批(批号:20170501、20170502、20170503,规格:伊维菌素2 mg与吡喹酮50 mg,生产企业:东方澳龙制药有限公司);甲醇、乙腈为色谱纯,水(超纯水),十二烷基硫酸钠(Merck),其余试剂均为分析纯。
2 方法与结果
2.1 色谱条件 用十八烷基硅烷键合硅胶为填充剂(Agilent XDB -C18,75 mm ×4.6 mm,3.5 μm);以水为流动相A,乙腈为流动相B,照表1进行梯度洗脱;流速1.0 mL/min;进样量:伊维菌素50μL,吡喹酮20μL;柱温为30℃;伊维菌素检测波长为245 nm,吡喹酮检测波长为210 nm。伊维菌素H2B1a与H2B1b峰的分离度应符合要求。
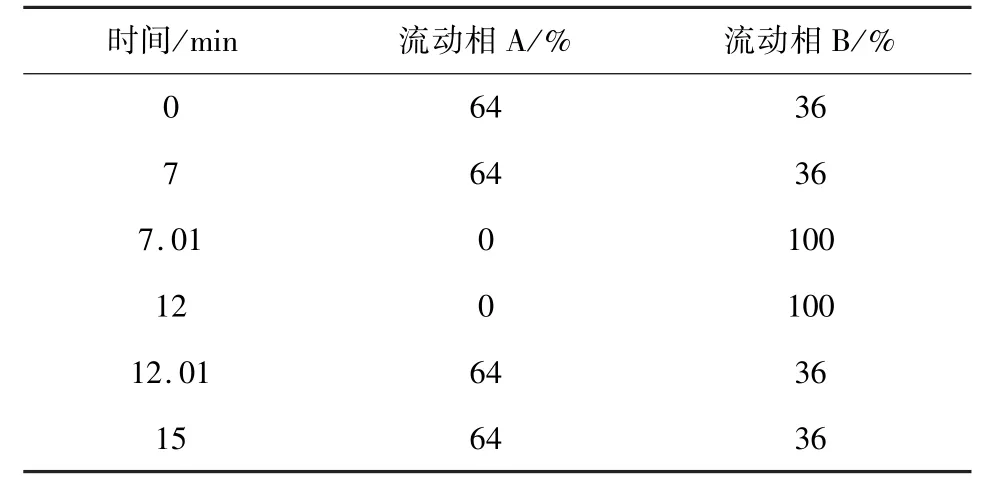
表1 梯度洗脱条件Tab 1 Procedure of gradient elution
2.2 溶液的制备
2.2.1 供试品溶液 取本品,照溶出度测定法(《中国兽药典》2015年版一部附录 0931,第二法),以含0.2%十二烷基硫酸钠(SDS)的磷酸二氢钠溶液500 mL为溶出介质,转速为50转/min,依法操作,在45 min时,取溶液适量,滤过,取续滤液,作为伊维菌素供试品溶液;精密量取续滤液1 mL,置10 mL量瓶中,加溶出介质稀释至刻度并摇匀,作为吡喹酮供试品溶液。
2.2.2 对照品溶液 取伊维菌素对照品20 mg,吡喹酮对照品50 mg,精密称定,置100 mL量瓶中,加甲醇溶解并稀释至刻度,摇匀;精密量取2 mL,置100 mL量瓶中,用溶出介质稀释至刻度并摇匀,制成每1 mL中含伊维菌素4μg和吡喹酮10μg的溶液,作为对照品溶液。
2.2.3 溶出介质 含0.2%SDS的pH1.0盐酸溶液的配制:取盐酸9.0 mL与SDS 2.0 g,加水使溶解并稀释至1000 mL;含0.2%SDS的pH4.0醋酸盐缓冲液的配制:取2 mol/L醋酸溶液20.5 mL、醋酸钠1.22 g与SDS 2.0 g,加水使溶解并稀释至1000 mL;含0.2%SDS的pH7.0磷酸盐缓冲液的配制:取无水磷酸二氢钠1.2 g与SDS 2.0 g,加水1000 mL使溶解,用饱和氢氧化钠调节pH值至7.0;含0.05%SDS的pH7.0磷酸盐缓冲液的配制:取无水磷酸二氢钠1.2 g与SDS 0.5 g,加水1000 mL使溶解,用饱和氢氧化钠调节pH值至7.0;含0.1%SDS的pH7.0磷酸盐缓冲液的配制:取无水磷酸二氢钠1.2 g与SDS 1.0 g,加水1000 mL使溶解,用饱和氢氧化钠调节pH值至7.0。
2.3 溶出方法的确定
2.3.1 溶出装置的选择 首选通用性强、耐用性好、广泛普及的篮法与桨法,对于片剂的溶出考察,通常采用桨法,故本方法采用桨法。
2.3.2 溶出介质pH值的选择 由于伊维菌素几乎不溶于水,吡喹酮在水中不溶[9],根据《普通口服固体制剂溶出度试验技术指导原则》,对于不溶于水或难溶于水的药物,可考虑在溶出介质中加入十二烷基硫酸钠或其他适当的表面活性剂。参考《中国兽药典》2015年版一部“吡喹酮片”的溶出介质“含0.2%SDS的盐酸溶液(9→1000)”与《USP 40-NF 35》“伊维菌素片”的溶出介质“含0.5%SDS的pH7.0磷酸盐缓冲液”,选择SDS作为表面活性剂。根据“溶出度试验应尽可能在生理条件下进行”[5]的原则,尽量使用低浓度的表面活性剂,初步拟定0.2%作为表面活性剂的浓度,考察在pH1.0盐酸溶液(胃液pH值)、pH7.0磷酸盐缓冲液(肠液pH值)和中间pH值4.0醋酸盐缓冲液的溶出介质中,伊维菌素吡喹酮片的溶出情况,结果如下。
伊维菌素在pH1.0盐酸溶液和pH4.0醋酸盐缓冲液中均不稳定,随着时间增加降解产物峰面积逐渐增大,且60 min累积溶出量均小于85%;伊维菌素在pH7.0磷酸盐缓冲液中稳定,未检出降解产物峰,60 min累积溶出量大于85%且达到平台期(图1~图3)。因此,pH1.0盐酸溶液和pH4.0醋酸盐缓冲液对伊维菌素不适用,pH7.0磷酸盐缓冲液满足伊维菌素溶出度测定要求。
吡喹酮在不同pH值溶出介质中,60 min累积溶出量均大于80%,溶出曲线基本一致(图4)。因此,不同pH值溶出介质对吡喹酮影响较小。
因此,初步选定含0.2%SDS的pH7.0磷酸盐缓冲液作为溶出介质。

图1 不同pH值溶出介质中伊维菌素5 min色谱图Fig 1 The chromatograms of ivermectin in different p H of dissolution mediums at 5 minute
2.3.3 表面活性剂浓度的选择 为了避免过量使用表面活性剂,考察伊维菌素吡喹酮片在含0.05%、0.1%和0.2%SDSpH7.0磷酸盐缓冲液中的溶出情况,结果如下。
伊维菌素在含0.05%SDS的溶出介质中不能溶出,在含0.1%SDS的溶出介质中60 min累积溶出量小于80%且未达到平台期,在含0.2%SDS的溶出介质中60 min累积溶出量大于85%且达到平台期(图5)。因此,0.2%SDS为伊维菌素溶出度测定的最低浓度。
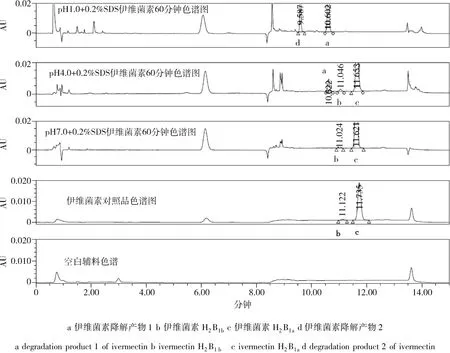
图2 不同pH值溶出介质中伊维菌素60 min色谱图Fig 2 The chromatograms of ivermectin in different p H of dissolution mediums at sixty minute

图3 不同p H值溶出介质中伊维菌素溶出曲线Fig 3 The dissolution curves of ivermectin in different p H of dissolution mediums
吡喹酮在不同SDS浓度的溶出介质中,60 min累积溶出量均大于80%,溶出曲线基本一致(图6)。因此,不同SDS浓度对吡喹酮影响较小。
因此,确定0.2%SDS作为表面活性剂的使用浓度,溶出介质为含0.2%SDS的pH7.0磷酸盐缓冲液。

图4 不同pH值溶出介质中吡喹酮溶出曲线Fig 4 The dissolution curves of praziquantel in different pH of dissolution mediums
2.3.4 转速的选择 通常桨法选用的转速为50和75 r/min,为了使溶出方法具有更好的区分力[10],考察伊维菌素吡喹酮片在含0.2%SDS的pH7.0磷酸盐缓冲液中转速分别为50和75 r/min的溶出情况,结果如下。

图5 三种SDS添加浓度中伊维菌素溶出曲线Fig 5 The dissolution curves of ivermectin in three concentrations of SDS

图6 三种SDS添加浓度中吡喹酮溶出曲线Fig 6 The dissolution curves of praziquantel in three concentrations of SDS
伊维菌素 50 r/min比 75 r/min在 5、10、20、30 min时的累积溶出量低约5% ~10%,在45、60 min时的累积溶出量大于85%且达到平台期(图7)。因此,对于伊维菌素溶出度测定,50 r/min的区分力优于75 r/min。
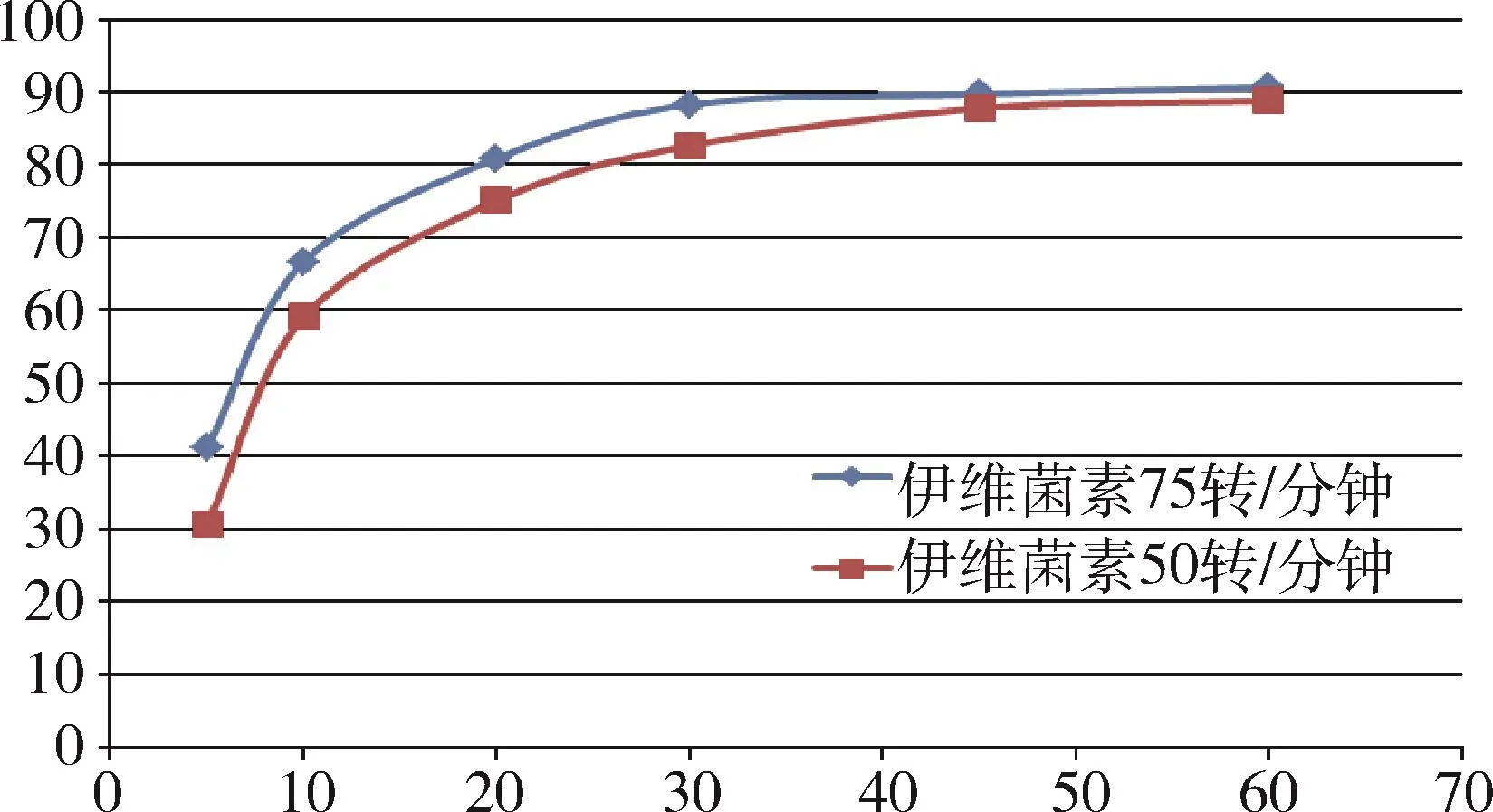
图7 50 r/min与75 r/min时伊维菌素溶出曲线Fig 7 The dissolution curves of ivermectin at 50 r/min and 75 r/min
吡喹酮 50 r/min 比 75 r/min 在 5、10、20、30 min时的累积溶出量低约10% ~20%,在45、60 min的时累积溶出量大于85%且达到平台期,曲线平滑(图8)。因此,对于吡喹酮溶出度测定,50 r/min的区分力优于75 r/min。
因此,确定50 r/min作为转速。

图8 50 r/min与75 r/min时吡喹酮溶出曲线Fig 8 The dissolution curves of praziquantel at 50 r/min and 75 r/min
2.3.5 溶出介质体积的选择 伊维菌素吡喹酮片中伊维菌素规格为2 mg/片,检测方法的定量限以伊维菌素H2B1b峰计约为1.2μg/mL。当溶出介质体积为900 mL,溶出量小于54%时伊维菌素H2B1b浓度低于定量限浓度,影响溶出曲线绘制的准确性。当溶出介质体积为500 mL,溶出量大于30%时伊维菌素H2B1b浓度即大于定量限浓度,更能保证溶出曲线绘制的准确性。因此,拟初步选择500 mL作为溶出介质体积。
考察伊维菌素和吡喹酮在含0.2%SDS的pH7.0磷酸盐缓冲液中的溶解情况,结果显示,50 mg的吡喹酮和2 mg的伊维菌素分别在约100 mL和150 mL的溶出介质中达到饱和,500 mL符合漏槽条件即“溶出介质体积一般至少为药物达到饱和溶液所需体积的三倍”的要求。
因此,确定500 mL为溶出介质体积。
2.3.6 取样时间与限度的选择 三批样品的伊维菌素和吡喹酮30 min累积溶出量均大于85%且达到平台期(图9~图10),根据“溶出度取样时间点常选择溶出曲线拐点处后推10至20 min,并将该点溶出量减去15%作为限度”的原则[11],选择45 min作为取样时间点,并将45 min的累积溶出量减去15%作为溶出限度。因此,取样时间确定为45 min,吡喹酮和伊维菌素的限度规定为不少于标示量的70%。

图9 三批样品伊维菌素溶出曲线Fig 9 The dissolution curves of ivermectin for three batches of ivermectin and praziquantel chewable tablet

图10 三批样品吡喹酮溶出曲线Fig 10 The dissolution curves of praziquantel for three batches of ivermectin and praziquantel chewable tablet
2.3.7 溶出方法的确定 综上所述,最终拟定溶出条件为:以含0.2%十二烷基硫酸钠的pH7.0磷酸盐缓冲液(称取2 g十二烷基硫酸钠,1.2 g无水磷酸二氢钠,加水1000 mL使溶解,用饱和氢氧化钠溶液调节pH值至7.0)500 mL为溶出介质,转速为50 r/min,在45 min取样测定,吡喹酮和伊维菌素的限度为不少于标示量的70%。
3 讨论与结论
3.1 色谱条件的确定 由于篇幅原因,同时检测伊维菌素和吡喹酮溶出量的高效液相色谱法的建立过程及方法学验证不在此篇论述。
3.2 SDS浓度的确定 在进行SDS浓度的选择时,通过伊维菌素溶出曲线的比较,确定了0.2%SDS作为表面活性剂的最低浓度,考虑到在该浓度水平下伊维菌素和吡喹酮的溶出曲线满足30 min累积溶出量大于85%,以及“溶出度试验应尽可能在生理条件下进行”的原则,尽量使用低浓度表面活性剂,且更容易具有区分力,因此,未进一步增加SDS的浓度进行考察,确定0.2%作为SDS的浓度。
3.3 转速的确定 在进行转速的选择时,吡喹酮75 r/min的溶出曲线在45和60 min时发生下降,分析原因,可能是由于转速较高时,吡喹酮溶出过快,在5 min时大于70%,10 min时大于85%,20和30 min时达到90%,溶出完全,而溶出曲线绘制时每个时间节点取液5 mL与补液5 mL存在一定的操作误差、精密量取1 mL稀释至10 mL的操作误差、仪器测定误差以及完全溶出后溶出杯中残余的不溶性辅料干扰取液等造成的,明确的原因有待进一步试验验证。对于伊维菌素和吡喹酮,50 r/min的区分力均优于75 r/min,因此,确定50 r/min作为溶出方法的转速。
3.4 结论 本文通过采用高效液相色谱法测定在不同pH值溶出介质、不同浓度表面活性剂和不同转速的条件下伊维菌素吡喹酮咀嚼片两种主药的溶出曲线,确定了伊维菌素吡喹酮咀嚼片的溶出条件,建立了同时测定伊维菌素吡喹酮咀嚼片两种主药溶出度的测定方法。该方法操作简便、快速、准确,可用于伊维菌素吡喹酮咀嚼片溶出度的测定。
