板蓝根注射液的HPLC特征图谱研究
2019-02-17王亚芳段文龙周艳飞张连彦钟昆芮
王亚芳,段文龙,周艳飞*,李 浛,张连彦,钟昆芮
(1.北京市兽药监察所,北京102629,2.中国兽医药品监察所,北京100081)
板蓝根系十字花科植物菘蓝(Isatis indigotica Fort.)的干燥根,性寒、味苦,具有清热解毒,凉血利咽的功效,为我国常用中药材,其药材和制剂质量控制方法经多年研究探索,正往多指标系统性质量控制方向发展。近10年间,板蓝根及其制剂指纹图谱研究通过改变流动相系统、优化梯度洗脱程序以获得更多共有峰信息,并采用LC-ESI-MSn鉴定结构和对照品指认的方法,确定共有峰中氨基酸类、核苷类、黄酮类、嘌呤和靛蓝、靛玉红等成分[1-4]。板蓝根指纹图谱研究为特征图谱研究提供了有力支撑,形成了(R,S)-告依春为参照峰,特征峰为尿苷、腺苷的板蓝根特征图谱以及表告依春为参照峰,特征峰为尿苷、鸟苷、腺苷的板蓝根特征图谱等。特征图谱色谱条件进一步简化流动相为甲醇-磷酸溶液系统[5-6]。板蓝根注射液是一种常见兽药品种,在治疗家禽流感、仔猪黄痢方面具有良好的治疗效果,兽医临床应用范围尝试逐渐拓宽,如治疗畜禽败血霉形体感染、水貂阿留申病等[7-9],目前收录于《兽药质量标准》2017年版中。在现行的质量标准中只包括对其中的精氨酸、亮氨酸、L-脯氨酸进行薄层鉴别和对(R,S)-告依春组分进行含量测定[10]。为了从整体上控制板蓝根注射液的质量,同时进一步控制原料质量和生产工艺的稳定性,本实验采用高效液相色谱法,综合现有板蓝根及其制剂特征图谱标定的特征峰,参考现行的质量标准[10]板蓝根注射液(R,S)-告依春含量测定法使用甲醇-水系统,建立了板蓝根注射液的HPLC特征图谱分析方法,为进一步全面控制板蓝根注射液的质量提供了技术依据。
1 仪器与材料
1.1 仪器 Waters e2695液相色谱仪,Waters 2998 PDA检测器(美国沃特世公司);METTLER XS205型电子分析天平(梅特勒-托利多仪器有限公司);DTL 500型超声波清洗机(北京德泰隆科技发展有限责任公司);Milli-Q 型超纯水仪(Advantage A10)。
1.2 材料 甲醇为色谱纯;水为超纯水;(R,S)-告依春对照品(批号 111753-201706,含量100.0%,中国食品药品检定研究院);尿苷对照品(批号111887-201803,含量99.5%,中国食品药品检定研究院);鸟苷对照品(批号 111977-201501,含量93.6%,中国食品药品检定研究院);腺苷鸟苷对照品(批号 111879-201703,含量99.7%,中国食品药品检定研究院);板蓝根注射液样品14批,来源见表1。

表1 板蓝根注射液样品信息Tab 1 Banlangen injection sample information
2 方法与结果
2.1 色谱条件 采用Waters Atlantis T3(5μm,4.6×250 mm)色谱柱,以甲醇为流动相A,以水为流动相B,按表2中的规定进行梯度洗脱;流速为0.8 mL/min;柱温30℃;检测波长为250 nm;进样体积10μL。
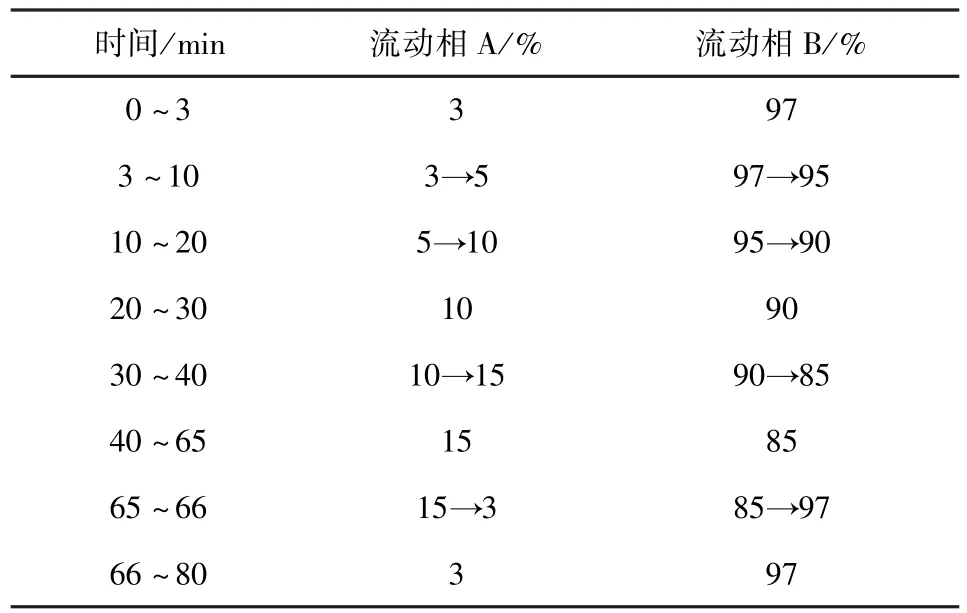
表2 板蓝根注射液特征图谱梯度洗脱条件Tab 2 Gradient elution conditions of Banlangen injection characteristic spectrum
2.2 对照品溶液的制备 分别精密称取 (R,S)-告依春对照品、尿苷对照品、鸟苷对照品和腺苷对照品各5 mg,置同一100 mL量瓶中,加5%甲醇适量,超声溶解后并稀释至刻度,摇匀;精密量取2 mL,置5 mL量瓶中,用5%甲醇稀释至刻度,摇匀,作为对照品混标溶液。
2.3 供试品溶液的制备 取板蓝根注射液样品,经0.45μm滤膜滤过,取续滤液,即得。
2.4 检测波长的选择 以PDA检测器进行全波长扫描,比较板蓝根注射液样品在200~400 nm的吸收谱图,发现板蓝根注射液在250 nm波长处得到的色谱峰响应值较理想,且各峰分离良好。
2.5 方法学考察
2.5.1 精密度试验 取同一份样品,连续进样6次,按上述色谱条件测定,各色谱峰相对保留时间的RSD<0.2%,各色谱峰峰面积的RSD<2%,结果表明仪器系统精密度良好。
2.5.2 稳定性试验 取同一份样品,按上述色谱条件测定,分别在 0、2、4、8、16、24、30 h 检测,各色谱峰相对保留时间的RSD<0.5%,结果表明板蓝根注射液样品稳定。
2.6 板蓝根注射液特征图谱的建立及相似度评价
2.6.1 特征图谱的建立 在上述色谱条件下,测定混合对照品溶液及板蓝根注射液样品,将色谱图的数据导入“中药色谱指纹图谱相似度评价系统(2012版)”,以S2样品色谱图为参照图谱,采用平均数相关系数法进行多点校正,时间窗宽度0.1 s,进行自动匹配,建立共有模式,共建立9个共有峰,得到典型色谱图见图1,不同批次样品叠加图见图2,板蓝根注射液样品部分放大图见图3。
2.6.2 共有峰的确认 将9个共有峰与对照品色谱图比对,确认其中的3号峰为尿苷,7号峰为鸟苷,8号峰为(R,S)-告依春,9号峰为腺苷,由于(R,S)-告依春是板蓝根药材中的质控指标组分,并且在注射液中的含量相对较高,因此,设定为参考峰,标记为峰S。计算各特征峰与S峰的相对保留时间,结果表明各特征峰的相对保留时间RSD<1.8%,具有较好的重现性。按照技术要求,初步得到板蓝根注射液的特征图谱的技术参数(表3)。

图1 板蓝根注射液样品和对照品的HPLC色谱图Fig 1 HPLC chromatogram of samples and reference materials of Banlangen injection

表3 板蓝根注射液HPLC特征图谱中特征峰保留时间Tab 3 Characteristic peak retention time in HPLC characteristic spectrum of Banlangen injection
2.6.3 相似度评价结果 将14批板蓝根注射液样品数据导入“中药色谱指纹图谱相似度评价系统(2012版)”,得出相似度评价结果表(表4)。

图2 板蓝根注射液样品不同批次叠加图谱Fig 2 Overlay spectrum of different batches of Banlangen injection samples
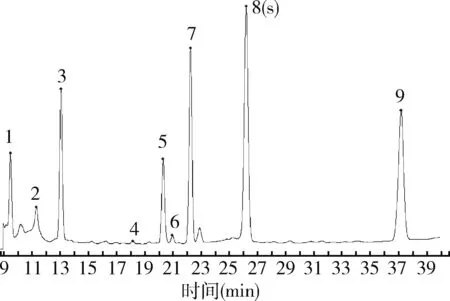
图3 板蓝根注射液样品部分放大图Fig 3 Partial enlargement of Banlangen injection sample

表4 样品特征图谱与对照图谱的相似度评价结果Tab 4 Similarity evaluation results of sample characteristic spectrum and reference characteristic spectrum
3 讨论与结论
3.1 色谱柱的选择 本文共测试4支色谱柱,另外3支分别是Agilent HC-C18(2)、Agilent Eclipse XDB -C18、Waters SunFireTMC18,虽然都能较好的分离板蓝根注射液中的组分,但是相对保留时间差异较大,RSD约为8%。因此,本实验需要固定色谱柱型号,使用Atlantis T3柱来检测特征图谱,9个共有组分峰的相对保留时间RSD均小于5%,满足实验要求。
3.2 检测波长的选择 本文采用PDA检测器,由各组分的光谱图可以得出最大吸收波长:若检测波长为260 nm(尿苷和腺苷最大吸收波长)时,告依春响应值最低,由于告依春是主要成分,在色谱图中峰高较小,若含量低时可能检不出;若检测波长为240 nm(告依春最大吸收波长)和245 nm(常用波长)时,腺苷组分响应值最低,若含量低时可能检不出;比较检测波长250、252、254 nm时,3种核苷类组分响应值相似,告依春组分是在250 nm响应最大,因此,最终选用250 nm作为检测波长。
3.3 不同生产企业、不同产地药材的差异 样品S1~S10来自不同生产企业,板蓝根药材也来自不同产地,药材品质也存在不同。相似度评价结果表明14批样品中只有8批其相似度均在0.90以上,说明不同来源的样品间相似度有差异,但是并不影响特征峰的判断。
本文所建立特征图谱与现行标准[10]板蓝根注射液(R,S)-告依春高效液相色谱法含量测定方法相比,梯度洗脱条件不同、检测波长更优化。本方法在尽可能获得更多共有峰的同时可使包括(R,S)-告依春在内的所有特征峰出峰时间适宜、分离度良好、峰形更佳。板蓝根注射液特征图谱未见报道,本方法与已报道的板蓝根药材或其制剂特征图谱相比,特征峰选择更接近现行标准质量控制指标成分,流动相系统由甲醇-磷酸溶液系统简化为甲醇-水系统,与同流动相系统指纹图谱比较标定了更多特征峰、特征峰分离度更好。
迄今为止,尚无公认能反映板蓝根内在质量的指标成分用于控制其药材及制剂的质量,现行的标准[10-11]主要在高效液相色谱法测定(R,S)-告依春的含量、薄层色谱法鉴别氨基酸类成分等方面对板蓝根注射液进行质量控制。本实验采用HPLCPDA法,建立板蓝根注射液HPLC特征图谱,灵敏度更高,准确性更好。板蓝根注射液特征图谱中9个特征峰包括(R,S)-告依春、核苷类成分和另外5个特征性成分,能更好、更全面地表达中药复杂体系,有效评价板蓝根注射液内在质量的稳定性和均一性。该方法简便灵敏,重复性好,进一步优化洗脱条件能提升分离效果,获得更多成分信息,可作为板蓝根注射液有效的鉴别和质量评价方法,是现行标准的有益补充,为中兽药标准化提供参考。
