颈动脉内中膜厚度与血栓调节蛋白联合检测对血液透析患者并发心血管疾病的预测价值
2019-02-16王一琳李声宏
王一琳,李声宏
(苏州大学附属第一医院,江苏苏州215000)
维持性血液透析(MHD)是目前临床缓解肾衰竭、尿毒症和提高患者生命质量的常见手段。但报道表明,MHD患者常伴发不同程度心肌梗死、心力衰竭等心血管并发症,脑出血及脑梗死等脑血管并发症[1,2]。其中心血管疾病(CVD)是导致MHD患者死亡的主要原因,约占50%[3]。早期发现高危因素并采取针对性干预措施对减少MHD患者CVD的发生和提高预后具有重要意义。颈动脉内中膜厚度(cIMT)是动脉粥样硬化的重要标志,而动脉粥样硬化是CVD的重要诱因。研究证实,cIMT增厚是CVD发生的独立危险因素[4]。血栓调节蛋白(Tm)是由血管内皮细胞合成的跨膜单链糖蛋白。研究表明,血管内皮细胞受损释放大量Tm进入血液,因此血浆Tm水平升高是反映血管内皮损伤的重要指标,而血管内皮损伤与CVD密切相关[5]。关于cIMT、Tm与MHD患者CVD发病的关系,目前相关研究尚不足。本研究探讨cIMT、Tm对血液透析患者并发心血管疾病的预测价值。现报告如下。
1 资料与方法
1.1 临床资料 选择2015年8月~2017年6月本院血液透析中心收治的尿毒症患者97例。纳入标准:病情稳定且透析时间≥3个月;②近3个月内未发生心血管事件(冠心病、心肌梗死等)。排除标准:妊娠期及哺乳期;心功能不全;乙型、丙型肝炎及其他肝功能障碍;合并急、慢性感染性疾病及自身免疫性疾病、恶性肿瘤、其他可能影响研究结果的疾病。MHD患者均采用费森尤斯4008B(710200T)血液透析机及一次性聚砜膜(膜面积为1.6 m2)的透析器,血流量200~300 mL/min,碳酸氢盐透析液流量500 mL/min,低分子肝素抗凝,每次透析时间为4 h,1周透析3次。根据是否发生CVD[6]将其分为CVD组、非CVD组。CVD组45例,男25例,女20例;年龄46~73(58.23±9.22)岁;透析龄5~23(16.38±4.27)个月;原发病为糖尿病肾病13例、慢性肾小球肾炎24例、高血压肾损害5例、多囊肾3例。非CVD组52例,男29例,女23例;年龄43~77(56.90±10.38)岁;透析龄7~22(15.67±5.02)个月;原发病为糖尿病肾病18例,慢性肾小球肾炎26例,高血压肾损害7例,多囊肾1例。同期随机选取体检健康者40例为对照组,男22例,女18例;年龄37~81(59.63±9.05)岁。各组性别、年龄有可比性,CVD组、非CVD组透析龄、原发病具有可比性。本研究经医院伦理委员会批准,各组均签署知情同意书。
1.2 相关实验室指标检测 均在透析前采集各组静脉血,用拜耳1650全自动生化分析仪进行检测,指标包括血红蛋白(Hb)、血肌酐(Scr)、尿素氮(BUN)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)及甘油三酯(TG)等。
1.3 cIMT检测 采用劲动脉超声检测cIMT,检测仪器为美国Philips Sonos 5 彩色多普勒超声仪,探头频率设置为7~14 MHz。受试者仰卧于检查台上,将超声探头放在颈前部气管的外侧,以保证声速能够处于垂直方向,且呈前后向投射,观察双侧颈总动脉、分叉部、颅外段颈内动脉的二维图像,血液至内膜界面为第一声波界面,中膜至外膜界面为第二声波界面,cIMT为两界面的垂直距离。
1.4 血浆Tm检测 收集MHD患者透析当日清晨空腹肘静脉血5 mL,体检健康者体检当日清晨空腹肘静脉血5 mL,以2 000 r/min的转速(半径13 cm)离心10 min,留取血浆置于-70 ℃环境下保存待检。采用酶联免疫吸附法检测血浆Tm。检测试剂盒由上海森珏公司提供,严格按照试剂盒说明进行相关操作。

2 结果
2.1 各组临床资料比较 CVD组有高血压史16例、糖尿病史25例、吸烟史7例;非CVD组有高血压史9例、糖尿病史18例、吸烟史11例。两组高血压史、糖尿病史比例比较差异有统计学意义(P均<0.05)。其他指标比较见表1。
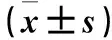
表1 各组临床资料比较
注:与对照组比较,*P<0.05;与非CVD组比较,#P<0.05。
2.2 MHD患者并发CVD的影响因素 以MHD患者是否并发CVD为因变量,将表1中有统计学意义的变量作为自变量,多元逐步Logistic回归,结果显示,BUN、cIMT、Tm是MHD患者并发CVD的独立危险因素(OR分别为1.449、1.791、1.642,P均<0.05)。见表2。

表2 MHD患者并发CVD的影响因素分析
2.3 cIMT、Tm对MHD患者并发CVD的预测价值 cIMT对MHD患者发生CVD预测的AUC为0.869,95%CI(0.792,0.946),最佳截断值为1.73 mm,此时的灵敏度、特异度分别为0.86、0.77,准确度为0.82;Tm对MHD患者发生CVD预测的AUC为0.818,95%CI(0.734,0.901),最佳截断值为19.36 mg/L,此时的灵敏度、特异度分别为0.82、0.71,准确度为0.76;cIMT联合Tm对MHD患者CVD预测的AUC为0.956,95%CI(0.915,0.998),此时的灵敏度、特异度分别为0.93、0.85,准确度为0.87。见图1。

图1 cIMT、Tm对MHD患者并发CVD预测的ROC曲线
3 讨论
动脉粥样硬化诱发的CVD是MHD常见的并发症,也是导致患者死亡的主要因素。寻找MHD患者并发CVD的高危因素,并针对高危人群采取干预措施,对改善患者预后,降低病死率具有积极意义。高血压、高血糖、高血脂常见的“三高”是MHD患者CVD高发率和高病死率的主要原因,但并不是惟一因素[7,8]。研究表明,血管内皮损伤、内皮细胞功能紊乱等介导了动脉粥样硬化发生、发展过程,检测并评估血管内皮损伤或内皮细胞功能紊乱是判断动脉粥样硬化病情严重程度的重要指标,也对研究CVD发病因素具有重要作用[9~11]。
cIMT是指动脉内膜与中膜平滑肌层之间的厚度,目前临床主要采用7.5~10 MHz的高频超声线阵探头进行动态、实时测定,范围包括颈总动脉、颈动脉窦以及颈内动脉近段。研究表明,cIMT增厚提示动脉粥样硬化[12]。许先进等[13]报道cIMT增厚增加了心肌梗死发生的风险,cIMT每增加0.1 mm,心肌梗死发病风险增加11%。Tm结构与低密度脂蛋白受体相似,广泛存在于细胞膜表面,正常生理状态下血液中Tm水平较低,当血管内皮细胞损伤时,内皮细胞表面合成并释放大量Tm进入血液,因此,检测血浆Tm浓度可作为评估血管内皮损伤的重要标记物[14,15]。
关于cIMT、Tm对MHD患者CVD发病的预测价值,目前相关研究相关较少。本研究结果显示,MHD患者SBP、DBP、BUN、TG、cIMT、Tm均高于健康体检者,提示MHD患者存在不同程度血压异常、肾功能障碍、颈动脉增厚、血管内皮功能障碍。MHD合并CVD患者SBP、DBP、BUN、TG、cIMT、Tm高于单纯MHD患者,提示上述指标可能是引发MHD患者CVD的危险因素。采用Logistic回归校正混杂因素后发现,BUN、cIMT、Tm是MHD患者CVD的独立危险因素,BUN每升高1 mmol/L,MHD患者CVD发病风险增加1.449倍,与有关研究结果相似[16],即BUN水平与心肌梗死、心绞痛等心血管疾病发生率呈正相关。推测其原因,可能是因为BUN升高提示肾脏有明显的炎症反应,而持续的炎症反应是MHD患者隐匿的病理状态,可明显加重内皮细胞损伤[17]。cIMT每增厚1 mm,CVD发病风险增加1.791倍,cIMT增厚提示患者存在颈动脉粥样硬化,而颈动脉粥样硬化患者斑块不稳定直至破裂可造成血栓,进而引发心肌梗死等心血管疾病。Tm水平升高反映患者存在不同程度血管内皮损伤或者功能紊乱,而这恰恰也是MHD患者动脉粥样硬化过程中的重要诱发因素。上述结果提示cIMT增厚、血浆Tm水平升高是MHD患者发生CVD的独立危险因素,早期检测cIMT、Tm对评估CVD发生具有重要意义。
采用ROC曲线下面积AUC评估cIMT、Tm对MHD患者CVD的预测价值,结果显示,cIMT和Tm预测MHD患者CVD的AUC分别为0.869、0.818,cIMT的灵敏度、特异度分别为0.86、0.77,Tm的灵敏度、特异度分别为0.82、0.71,cIMT联合Tm对MHD患者CVD预测的AUC为0.956,灵敏度、特异度分别为0.93、0.85,提示两指标早期联合检测对CVD具有较高的预测价值。
综上所述,MHD患者存在不同程度cIMT增厚和血浆Tm水平升高,并且二者是CVD发生的独立危险因素。早期联合检测cIMT、血浆Tm可有效预测CVD的发生。
