食管癌组织中miRNA-375表达及其甲基化与肿瘤发生发展的关系
2019-02-16张雪梅田浩魏微微宋文琦刘亮卓越杜井峰
张雪梅,田浩,魏微微,宋文琦,刘亮,卓越,杜井峰
(1佳木斯大学附属第一医院,黑龙江佳木斯154002;2佳木斯市中心医院;3佳木斯市肿瘤医院)
食管癌是我国也是世界范围内常见恶性肿瘤之一,以手术为主的综合治疗是目前主要治疗方式,但因其发病隐匿、早期症状不明显,多数患者发现时已到中晚期,错过了手术最佳时机,5年生存率低于15%[1],寻找更有价值的生物标记物与治疗靶点成为各国学者共同关注的焦点。微小RNA(miRNA)是一类存在于各种真核生物中的小分子非编码RNA,主要调节内源性基因表达,参与细胞增殖、凋亡、分化等过程[2]。DNA甲基化调控是表观遗传学的主要方式,基因启动子区CpG岛的DNA甲基化可决定特定miRNA的表达与沉默[3]。相关研究表明,miRNA-35作为抑癌基因在大肠癌、原发性肝癌中呈异常低表达状态[4,5],但目前还少有miRNA-375在食管癌表达及甲基化调控的研究。本研究观察食管癌组织中miRNA-375表达变化,并探讨其表达发生变化的机制及临床意义。
1 资料与方法
1.1 临床资料 收集2016年3月~2017年3月佳木斯大学附属第一医院经胃镜采集的110例新鲜组织标本,根据活检结果分为食管癌组42例、非癌对照组68例。食管癌患者男30例、女12例;年龄50~72(61.54±7.12)岁;肿瘤高、中分化14例,低分化28例;淋巴结转移19例;TNM分期为Ⅰ~Ⅱ期15例,Ⅲ~Ⅳ期27例;病理类型为髓质型20例,溃疡型13例,覃伞型9例。非癌对照组患者男48例、女20例;年龄55~74(61.32±7.24)岁。两组性别、年龄比较差异无统计学意义(P均>0.05)。标本采集后迅速置于液氮中冷冻,保存于-80 ℃冰箱。本研究经医院伦理委员会批准,患者或家属均知情同意。
1.2 两组miRNA-375表达检测 采用实时荧光定量PCR。使用Invitrogen公司TRIzol试剂裂解提取食管癌组织与正常食管组织RNA,采用紫外分光光度计滴定RNA浓度,控制RNA吸光度(OD)260/OD280为1.9~2.1,用无酶水稀释RNA至500~1 500 ng/μL。用miRcte miRNA Cdna第一链合成试剂逆转录合成cDNA。采用ABI 7900HT荧光定量PCR仪,荧光染料购自凯基生物SYBR GreenⅠ,试剂盒购自miRcute miRNA。反应体系12.5 μL,扩增条件:热启动(95 ℃ 5 min)、变性(95 ℃ 10 s)、退火(56 ℃ 10 s)、延伸(72 ℃ 10 s),共40个循环。以U6为内参。用2-△△Ct法计算miRNA-375相对表达量。
1.3 miRNA-375启动子区甲基化检测 采用甲基化特异性PCR。CpG岛预测:采用美国加州大学对克鲁兹分校基因数据库提取miRNA-375序列,通过预测相应基因调控区域,显示miRNA-375启动因子存在CpG岛(表达可能受DNA甲基化调控)。采用欧洲生物信息学研究所CpG plot软件预测上述基因调控区域序列,验证CpG岛的存在。用天根生化公司DNA/RNA提取试剂盒提取DNA,检测含量与纯度后,采用亚硫酸氢钠修饰DNA样本,使用DNA纯化试剂盒进行脱硫处理。采用引物设计程序“MethPrimer”设计合成miRNA-375甲基化、非甲基化特异引物序列,由南京金斯瑞生物科技公司合成。甲基化miRNA-375上游序列:5′-GATTTATAATATTTTGGGGAGGC-3′,下游序列:5′-ATAAACGTAAAAACGAAACTTCGAA-3′;非甲基化miRNA-375上游序列:5′-ATTTAGAATATTTTGGTGGAGGTGA-3′,下游序列:5′-ATAAACATAAAAACAAAACTTCAAA-3′。甲基化阳性判断:甲基化特异性引物扩增出目的条带,非甲基化特异性引物有或无条带扩增出;非甲化:非甲基化特异性引物扩增出目的条带,甲基化引物未扩增出条带。

2 结果
2.1 两组miRNA-37表达比较 食管癌组miRNA-375相对表达量为0.028±0.008、非癌对照组为0.042±0.012。食管癌组miRNA-375相对表达量低于非癌对照组(t=6.692,P<0.05)。
2.2 两组miRNA-375启动子区甲基化阳性率比较 食管癌组miRNA-375启动子区甲基化阳性阳性率为71.43%(30/42),非癌对照组为23.53%(16/68)。食管癌组miRNA-375启动子区甲基化阳性率高于非癌对照组(χ2=24.483,P<0.01)。
2.3 miRNA-375表达与食管癌患者临床病理特征的关系 不同性别、年龄、病理类型食管癌组织miRNA-375相对表达量比较差异无统计学意义(P均>0.05);低分化、淋巴结转移、TNM分期Ⅲ~Ⅳ期食管癌组织miRNA-375相对表达量低于高中分化、淋巴结无转移、TNM分期Ⅰ~Ⅱ期食管癌组织(P均<0.05)。见表1。
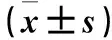
表1 miRNA-375表达与食管癌患者临床病理特征的关系
2.4 miRNA-375启动子区甲基化与食管癌患者临床病理特征的关系 不同性别、年龄、病理类型食管癌组织miRNA-375启动子区甲基化阳性率比较差异无统计学意义(P均>0.05);低分化组织学类型、淋巴结有转移、TNM分期Ⅲ~Ⅳ期食管癌组织miRNA-375启动子区甲基化阳性率高于高中分化、淋巴结无转移、TNM分期Ⅰ~Ⅱ期食管癌组织(P均<0.05)。见表2。

表2 miRNA-375启动子区甲基化阳性与食管癌临床病理特征的关系[例(%)]
3 讨论
我国是食管癌高发地区,每年食管癌死亡人数高达20万,约占所有恶性肿瘤死亡人数的16.05%[6]。食管癌发病原因尚不清楚,随着分子生物学研究的不断深入,越来越多学者认为食管癌的发生是一个多因素、多基因、多阶段共同作用的结果,是致癌基因、抑癌基因结构与功能发生异常不断累积与协同作用的过程[7]。miRNA、DNA甲基化作为重要表观遗传学调控机制,不仅调节机体正常生长发育,也直接参与了肿瘤发生、发展过程[8]。
miRNA是一类小分子单链RNA,长度约为18~25个核苷酸,可调节内源性基因表达,参与肿瘤的生成与发展。有研究表明,不同miRNA异常表达或抑制肿瘤细胞增殖、或诱导致癌基因生长。如miRNA-222异常高表达可诱导侵袭性甲状腺乳头状癌的侵袭与转移[9]。miRNA-375位于人染色体上2q35区上cryba2和Cadc108的基因区域间的片段,是一种胰岛特异性miRNA,现已发现在不同肿瘤发病过程,其表达升高或降低各不相同[10]。如在胃癌组织中明显降低,而在前列腺癌组织中表达明显升高[11]。对食管癌组织中miRNA-375表达变化的研究较少。本研究食管癌组织中miRNA-375表达低于非癌对照组,且低分化、淋巴结转移、TNM分期Ⅲ~Ⅳ期食管癌组织miRNA-375相对表达量更低,与陆翰杰等[12,13]文献报道基本相似。
miRNA表达异常的机制尚末完全阐明,可能与转录因子、表观遗传修饰等因素有关。DNA甲基化作为表观遗传修饰的一种方式,影响着细胞发育与基因表达。DNA甲基化发生于启动子区CpG岛,通过甲基化、去甲基化调节基因的表达或沉默。相关研究表明,人类许多肿瘤中均存在不同程度的DNA异常甲基化现象,启动子区CpG岛出现异常超甲基化可诱导基因转录沉默,降低抑癌基因、凋亡基因表达水平,参与肿瘤发生发展。而且启动区CpG岛超甲基化存在于恶性肿瘤癌前病变阶段,通过检测基因甲基化状态,可作为诊断肿瘤的敏感指标。本研究中,食管癌组织miRNA-375启动子区甲基化阳性率高于非癌对照组,同样与肿瘤分化程度、淋巴结转移、TNM分期相关。
综上所述,食管癌组织中miRNA-375呈低表达,miRNA-375甲基化可能是导致miRNA-375低表达的主要原因;miRNA-375低表达与组织分化程度、有无淋巴结转移、TNM分期明显相关。临床可将miRNA-375甲基化水平、miRNA-375表达作为食管癌早期诊断及预后判断的依据。
