微生物实验室进化的研究进展
2019-02-15朱晁谊朱牧孜
朱晁谊,朱牧孜,李 爽
(1.华南理工大学 生物科学与工程学院,广东 广州 510006;2.广东省微生物研究所 省部共建华南应用微生物国家重点实验室 广东省菌种保藏与应用重点实验室 广东省微生物应用新技术公共实验室,广东 广州 510070)
近年来,随着合成生物学的快速发展,通过基因工程及代谢工程构建微生物细胞工厂生产高附加值化合物变得极具吸引力。尽管微生物细胞工厂在化工、食品、制药、医疗和农业等领域已取得诸多成果,如已处于商业规模生产的1,4-丁二醇(1,4-butanediol)[1]和重要药物前体青蒿酸(artemisinic acid)[2],但获得适用于工业化大规模生产的高产菌种仍是目前一大难题[3]。微生物细胞生长及生产往往涉及多种表型的协调优化,受多个基因及环境因素相互作用的影响,即使以基因背景充分解析的微生物为宿主,依然存在许多不可预测的因素,限制了人们对微生物工厂的合理设计。因为微生物普遍具备遗传与变异的进化特性,所以让微生物通过进化自主完成系统表型优化,实现目标化合物的高产,是21世纪由石油化工向生物化工转型过程中科学研究的一大热点。
1 微生物自适应实验室进化
一般来说,微生物在适应环境过程中,菌体必然会发生变异,改变某些表型,这是进化的必然趋势。在该理论的支持下,微生物自适应实验室进化(adaptive laboratory evolution,ALE)应运而生。ALE是指通过施加人为干扰及控制微生物生长环境实现微生物进化。与代谢工程相比,ALE不需要考虑菌体错综复杂、相互交叉的代谢网络,只需根据目标设计对应的干扰因素,具有微生物适用性广泛及实用性强的优点,易于发现新机制、实现表型优化[4]。
自20世纪末开始,越来越多的学者使用ALE技术改造菌株以实现所需的功能。Caspetal等[5]通过对S.cerevisiaeCEN.PK113-7D实行ALE实验以筛选耐热性菌株,在39.5 ℃条件下连续传代超过300代,最终突变株在40 ℃条件下的比生长速率提高了1.57倍,乙醇与甘油的产量分别提高了1.6和1.3倍。菌株全基因组测序及转录组测序分析表明,酵母耐热性提高与固醇合成途径某些基因的突变及表达增加有关。笔者所在的课题组的Zhu等[6]和Yang等[7]也曾利用ALE实验对2株经代谢工程改造过的嗜热厌氧杆菌T.aotearoenseSCUT27进行了高浓度底物耐受进化实验,产乙醇突变株SCUT27/Δldh和产乳酸突变株LA1002分别在梯度增加碳源的培养基中经过58和40次传代;在5 L发酵罐研究中,突变株SCUT27/Δldh-G58比出发菌株的迟滞期缩短75 h,乙醇产量提高了1.6倍;LA1002-G40在48 h内完全发酵含100 g/L糖的厨余水解液,乳酸产量和转化率分别达68.03 g/L和0.79 g/g,而LA1002未见生长。最后,转录组数据和胞内溶质研究显示,高渗透压环境促使嗜热厌氧杆菌调控自身UDP-glucose代谢、氨基酸代谢等多个通路,使可作为渗透压保护剂的谷氨酸(Glu)和甘氨酸(Gly)等氨基酸胞内的含量增加了1.42~2.90倍,并上调了应对环境压力的DNA修复相关基因的表达。这充分说明了ALE实验在实现菌株定向进化方面的便捷性和有效性。
在具体实践中,ALE实验以特定的选择压力为基准筛选表型增强的突变体,多应用于提高工业菌种在不同生产条件下的稳定性及耐受性,如温度耐受性[5]、离子液体耐受性[8]及有效利用次优碳源[9]等。然而,在获得高产化合物的进化研究中,由于化合物的生产通常会加重细胞负担或产生细胞毒性,这种传统的ALE实验方法往往出现相反的结果[10]。因此,在提高化合物产量的进化研究中,将目标化合物的生产与微生物生长耦联起来,是目前应用ALE实验的一种有效方法。Reyes等[11]利用类胡萝卜素具有抗氧化的特性,删除了酵母细胞体内正常清除活性氧(ROS)的途径而使得类胡萝卜素成为细胞抵御ROS的主要来源,通过周期性施加过氧化氢刺激的方法进行ALE实验,最终类胡萝卜素产量提高约3倍。
2 提高微生物实验室进化速度的策略
ALE实验可不需要预先产生目标基因的突变库,通过施加环境压力促进微生物进化,但微生物自发突变率很低,需要通过长期传代培养以富集突变。因此,为提高微生物进化速度,通常需增加出发菌株的基因多样性。
基因多样性可以通过多种方法产生,从完全无靶向的全基因组诱变到针对特定基因的完全靶向方法,皆有文献报道。早期研究中,常使用增变菌株为宿主(如E.coliXL1-Red,其全基因组突变率为野生型菌株的5 000倍)[12],利用紫外诱变或化学诱变[13]构建突变库等方法建立基因多样性,但其不稳定性及无目的全靶向等弊端限制了其大范围使用。
近年来,比起完全无靶向的全基因诱变或对目的基因深入了解的全靶向突变方法,连续定向进化方法更受广大学者青睐,其最重要的一个特征是能以这一种不会扰乱宿主生长的方式调节目的基因进行进化[14]。以下介绍将突变局限于目标基因的定向进化方法(体外或体内构建突变体),很大程度地避免宿主其他基因的突变。
2.1 体外构建突变库
在体外采取随机突变产生目的基因突变库是一种较为有效的半靶向方法,如易错倾向的PCR(error-prone PCR,epPCR)[15]。这种基于PCR的方法利用低保真DNA聚合酶可快速构建基因突变库,经济省时,但低保真DNA聚合酶倾向于产生特定类型的突变,导致epPCR突变库产生某种偏向性,缩小了突变库的有效规模。目前,可以通过改变PCR反应中dNTPs的比例或使用多种不同偏向的易错DNA聚合酶来克服该缺点。此外,一些常规的体外构建突变库的方案,如DNA shuffling等可以详细参考相关综述[16]。
近年来,体内位点特异性突变及自动化技术的进步为微生物持续定向进化提供了机遇[17-18],在初步了解与表型相关基因组区域的情况下,这些方法可有效规避随机突变的偏向性及不可控性等问题。
Wang等[19]成功开发出多重自动化基因工程技术(multiplexed automated genome engineering,MAGE),如图1(a)所示,通过单链DNA(single-stranded DNA,ssDNA)实现E.coli染色体上多位点的同时突变,实现基因组合多样性。通过改造E.coli的限制修饰系统,引入噬菌体的λ-Red ssDNA结合蛋白β,大大提高ssDNA的整合效率,并通过自动化装置实现快速连续定向进化。应用这套系统优化E.coliEcNR2的1-脱氧-d-木酮糖-5-磷酸盐(DXP)合成途径生产番茄红素,针对DXP途径中的24个基因,设计一系列特异性突变的ssDNA,利用MAGE技术连续随机整合至宿主染色体,每天可创造超过43亿个的突变体,并在3 d内使番茄红素产量提高超过5倍。MAGE技术自首次实现多基因位点的快速突变以来,目前已多次成功用于大肠杆菌的代谢途径优化[20-21],并有学者将此方法用于酿酒酵母中,演化出酵母寡聚核苷酸介导的基因工程技术(yeast oligo-mediated genome engineering,YOGE)[22]。
CRISPR(clustered regularly interspaced short palindromic rep)系统的问世大大方便了生物基因组的靶向编辑,同时也被学者们研究发展应用于定向进化中。Ronda等[23]将CRISPR-Cas9与MAGE技术结合创造了CRMAGE技术,将重组效率由0.68%~5.4%提高至96.5%~99.7%,大大提高了进化效率。此外,Gill课题组的Garst等[24]开发了一套CRISPR激活的可追踪基因工程技术(CRISPR-enabled trackable genome engineering,CREATE),如图1(b)所示,该系统关键在于构建包含gRNA与同源修复片段的CREATE表达盒,既完成位点突变,实现基因组的多样性,也充当追踪标记,筛选完成后快速发现基因型与表型间的联系。此后,Gill课题组的Liang等[25]将此技术应用于提高E.coli异源生产异丙醇中,在常规实验室条件下,不依赖全基因组测序,几天内生成并鉴定了近千个单基因和多基因组合突变体,最终获得异丙醇产率提高3倍的E.coli突变菌株。
2.2 体内构建突变库
前述的方法均是在ALE实验前获得基因多样性,如果能够在ALE实验过程中获得基因多样性而不影响宿主菌株的正常生长,可简化操作、减少人为干扰,更有利于实现定向进化的连续性。
2011年,Esvelt等[26]开发的噬菌体辅助连续进化技术(phage-assisted continuous evolution,PACE)(图2(a)),将目的蛋白活性与噬菌体的生命周期耦联,在恒化连续装置的辅助下,8 d内实现无人为干扰的目标蛋白质200代进化。整套系统利用噬菌体M13的增殖依赖于pIII蛋白这一特性,将需进化的目的基因替换原来的pIII蛋白基因,构建1个含目的基因的pIII蛋白缺陷型的选择噬菌体(selection phage,SP),而宿主E.coli则包含2个主要质粒:辅助质粒(accessory plasmid,AP)和致突变质粒(mutagenesis plasmid,MP)。AP主要包含与目的基因活性相耦联的pIII蛋白基因,SP必须进化出有活性的突变,才可启动AP上pIII蛋白表达,噬菌体才可获得增殖能力并持续侵染其他宿主,实现连续进化。而MP则含有4个dnaQ926、umuC、umuD′和recA730受阿拉伯糖调控的基因,经诱导可产生随机突变,提高整个系统的突变率。此外,为了将作用于所有基因的随机突变限制于噬菌体的目的基因处,他们引入恒化器装置,流入新鲜的宿主细胞,并设置流出速度稍快于宿主的复制速度,故只有获得有益突变从而完成增殖的噬菌体可以持续侵染新宿主,在恒化器中富集,而无法实现突变完成增殖的噬菌体则最终会流失。利用这套系统可进化任何与pIII蛋白表达耦联的蛋白,而目前将酶的多种功能与报告蛋白的表达相耦联的研究进展为PACE技术应用于多种蛋白或酶的改造提供了可能。目前该技术已应用于RNA聚合酶[27]、aminoacyl-tRNA合成酶[28]或毒素[29]等蛋白的进化研究中。
尽管PACE在连续定向进化蛋白质方面有突出的贡献,但目前它的宿主只限于大肠杆菌,无法用于酵母等真核生物。2016年,Crook等[30]建立了一套以转座子为基础的酵母体内定向进化方法(invivocontinuous evolution,ICE)(图2(b))。ICE系统的关键在于易错倾向的Ty1逆转录酶。具体来说,整合至Ty1逆转录识别区域的目的基因首先被转录,接着易错倾向的Ty1逆转录酶表达并逆转录目的基因形成cDNA,产生基因多样性之后,Ty1整合酶再将其重新整合至基因组上,完成一轮突变。这套利用逆转录转座子进行体内诱变的系统可以扩展到任何支持LTR逆转录转座子活性的真核生物内,宿主应用范围广泛,他们应用这套系统增强转录因子SPT15对1-丁醇的耐受性,改变脱羧酶的底物特异性,提高木糖分解途径通量,展示出ICE系统对转录因子、单酶甚至多酶途径进化的高效可行性。
利用正交复制的突变质粒来实现靶基因突变也是目前较受欢迎的一种方法,这种方法最大的特点就是几乎不改变宿主基因组,不影响宿主的正常生长,适合于酶的进化。这一策略最早期是由Fabret 等[31]在大肠杆菌中实现,他们利用DNA聚合酶Ⅰ(DNA PolⅠ)在细胞内优先复制质粒上的基因且只复制染色体一小部分的特点,构建低保真度的DNA PolⅠ突变体,完成质粒基因的突变而不影响宿主基因。后来,Camp等[32]进一步增强了DNA PolⅠ的错配率,实现TEMβ-内酰胺酶的连续进化。除了在大肠杆菌中应用,这种策略后来还被Liu Chang课题组的Ravikumar等[33-34]推广至酿酒酵母的靶向突变中,他们在酿酒酵母中建立1个由正交DNA质粒-DNA聚合酶对组成的细胞核外复制机制,并通过构建易错倾向的DNA聚合酶建立一套独立于宿主的体内连续进化系统(OrthoRep),其体内质粒突变率是宿主基因组的10万倍(图2(c))。此后,Ravikumar等[34]借助此系统,在酿酒酵母中对恶性疟原虫来源的二氢叶酸还原酶(PfDHFR)进行连续进化,最终获得对乙胺嘧啶耐受性提高4万倍的突变体。最近,Liu Chang课题组的Arzumanyan等[35]对此系统进一步发展,在1个细胞中构建了pGKL1质粒/TP-DNAP1聚合酶对与pGKL2质粒/TP-DNAP2聚合酶对2个彼此正交的DNA复制系统,这样一对正交复制系统通过调节2个聚合酶的错配率,实现体内多基因的不同速率的进化。
除了用于正交质粒上的靶基因的连续进化,将易错倾向的DNA聚合酶用于基因组上任意靶基因的突变将更具应用价值。最近,美国加州大学的Halperin等[36]将易错DNA聚合酶与CRISPR技术相结合,构建了一种名为“EvolvR”的体内进化系统(图2(d))。该系统将只产生单链断裂的nCas9蛋白突变体与易错倾向的缺口DNA聚合酶突变体融合,由gRNA引导至特定靶序列,随后nCas9蛋白切割产生单链缺口,易错的DNA聚合酶从缺口处开始补上新的核苷酸,替换下游的核苷酸,对靶基因生成一系列突变体,在1 d内完成整个进化过程。一方面通过CRISPR系统规定了靶基因突变的起始位点,并以多组gRNA的共表达实现对基因组上多个靶位点的同时进化;另一方面通过调节DNA聚合酶突变体的持续合成能力、保真度及错误插入偏好性,从而相应地控制靶基因的突变序列长度、突变率及核苷酸替代偏好,由此,理论上可实现所有物种的任意多个靶基因的体内持续进化。
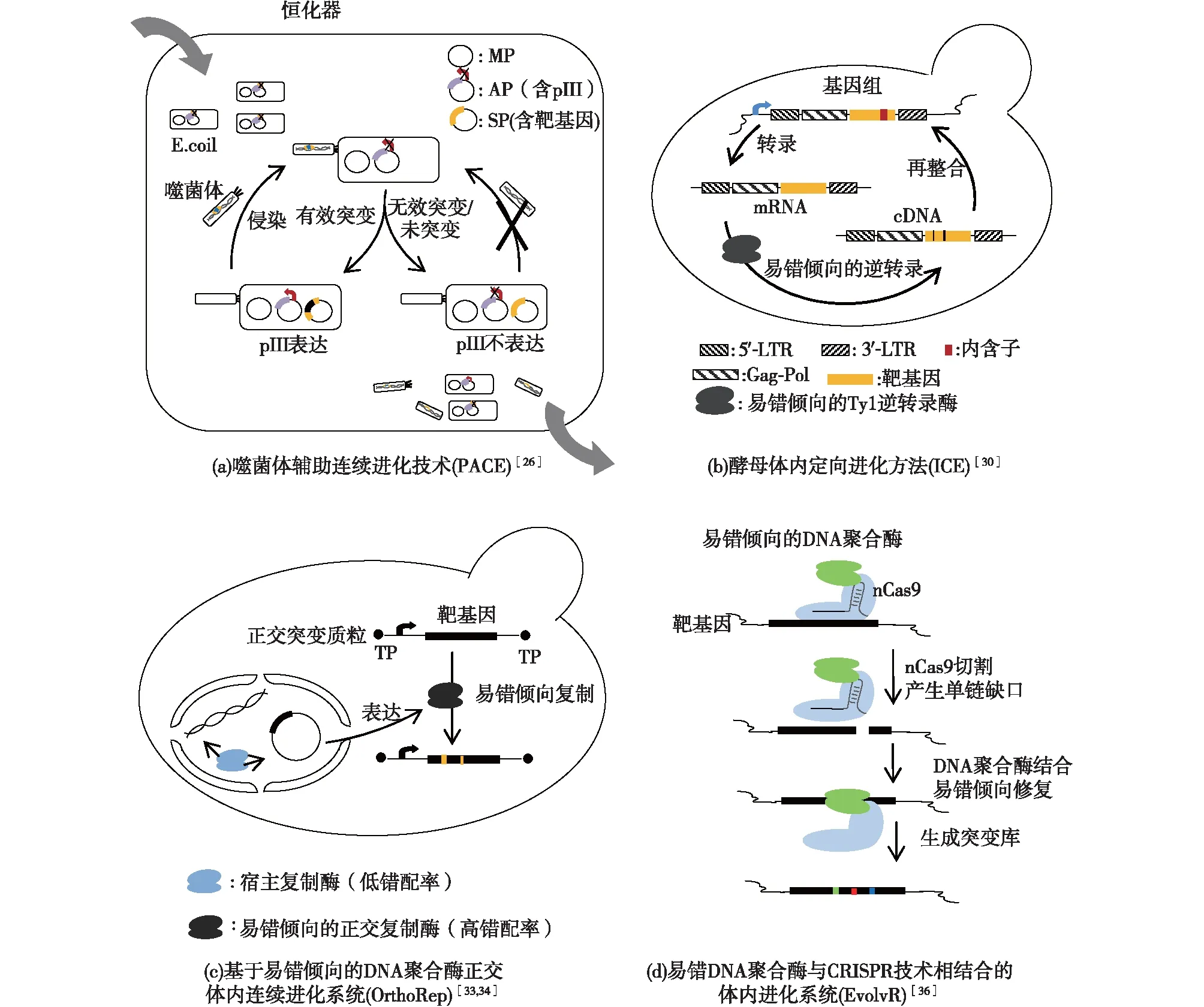
图2 体内构建突变库示意图Fig.2 Schematic diagram of in vivo targeted mutagenesis
将现有的微生物实验进化策略的详细内容进行总结,见表1。
3 连续自动化培养技术的发展
事实上,不管是近年来发展迅猛的连续定向进化策略还是早期依赖环境选择压力的适应性进化方法,皆是基于微生物连续繁殖、富集突变而获得特定表型的进化过程。微生物的连续培养繁殖主要是通过手动连续稀释或自动化培养装置实现的,前者容易出现种群瓶颈、培养密度波动及选择压力不均匀等问题;而后者的应用却常遇到生物膜积累、培养环境受限及高成本等阻碍,因此在推动微生物实验室进化的进程中,连续自动化技术的发展尤为重要。
为解决生物膜积累的问题,de Crecy等[37]开发了一种叫“Evolugator”的连续进化装置,在生物反应器中设置不同隔离分区,以与动态控制器相连的浊度计的测量值来调节培养物的循环,达到减少生物膜形成和抑制贴壁生长的目的。利用这个平台,研究人员在4个月内成功进化出2株耐高温的昆虫病原真菌突变株,广泛应用于害虫防治[38]。
随着低成本及人性化的培养设备的研发,一些适用于小实验室的连续自动化装置渐渐发展起来,如Matteau等[39]设计的多功能连续培养装置(versatile continuous culture device,VCCD)、Takahashi等[40]设计的具有开发资源的多路复用恒浊器(Flexostat)及Hoffmann等[41]设计的基于扩展卡尔曼滤波器原理估计细胞增长率的低成本恒浊器等,这些装置皆具有由3D打印或易于操作的部件制成、受开放资源的软件控制的特点。
此外,近几年液体处理机器人[42]、微型恒化器阵列[43]及微液滴恒化器[44]等的出现,推动了连续自动化装置与高通量平行化培养筛选策略的结合,在微生物实验室进化过程中对选择参数、突变率及突变范围实现更高程度的控制,并一定程度上限制了人为干预。最近,Wong等[45]开发了一种名为“eVOLVER”的可任意缩放及实现用户自定义的装置,其开源的湿件、软件及硬件等高度模块化,可实现快速重新配置以适应几乎所有的自动化连续培养实验,实现实验室进化过程中自动化培养过程的高度可控性及高通量性的平衡。

表1 微生物实验室进化策略的对比
4 总结
实验室定向进化大大加速了人类改造蛋白质、代谢途径甚至细胞的步伐,在发现蛋白质新功能、提高酶活性及提升微生物细胞工厂产能等研究中具有应用潜力。连续进化方法,可有效打破基因突变范围、筛选能力及突变率等传统进化方法的遗传瓶颈,大幅度减少人为操作,为同时进行多个平行进化实验提高可行性,也减少人为因素带来的实验误差,大大推动了微生物实验室进化的发展。
体内连续进化方法也有其自身的缺陷,如连续培养过程中逃逸筛选的无效突变菌株的扩增、对自动化设备的高度依赖等,故体内连续进化应与其他实验室进化方法相互补充,而非简单替代。目前计算机辅助的体外进化设计技术的普及[46-48]、生物分子功能与报告分子或细胞生长耦联技术的广泛研究[49-50]及连续自动化技术的进步等,将为充分实现微生物实验室进化的潜力发挥出关键作用。
