南极磷虾中不同形态虾青素的分离制备、结构鉴定及含量分析
2019-02-15丛心缘孙伟红张辉珍冷凯良邢丽红苗钧魁刘小芳
丛心缘,孙伟红,张辉珍,冷凯良,邢丽红,苗钧魁,刘小芳
1 (青岛大学 公共卫生学院,山东 青岛,266071)2 (中国水产科学研究院黄海水产研究所,农业部极地渔业开发重点实验室,山东 青岛,266071)3(青岛市食品药品监督管理局,山东 青岛,266100) 4(海洋国家实验室海洋药物与生物制品功能实验室,山东 青岛,266100)
南极磷虾(Antarctic krill)是生活在南极洲水域的甲壳类无脊椎动物,蕴藏量十分丰富,有极大的开发价值[1],富含二十碳五烯酸(EPA)、二十二碳六烯酸(DHA)等n-3多不饱和脂肪酸,生物利用度高于鱼油,有降血脂,预防心脑血管疾病的保健功效[2-4]。南极磷虾除了具有高优质蛋白、低碳水化合物、高脂质等优点外[5],还含有活性物质虾青素。
虾青素(astaxanthin)为萜烯类不饱和化合物,分子式:C40H52O4,具有较长的共轭双键链,其化学性质不稳定,存在多种同分异构体[6],最常见有13-顺虾青素、全反式虾青素和9-顺虾青素。虾青素共轭双键链两端环结构存在两个手性中心,分别可以产生3种光学异构体: 3S,3′S、3S,3′R、3R,3′R[7]。虾青素在海洋生物如藻类、虾、蟹中含量较高[8],是目前已知的抗氧化性最强的天然抗氧化剂之一,能缓解皮肤因紫外线辐照而带来的伤害[9],有清除自由基、增强免疫力、改善动脉硬化等作用[10-11]。雨生红球藻、红发夫酵母和南极磷虾是虾青素的重要生物来源[12],其中雨生红球藻和南极磷虾中的虾青素大多以虾青素酯的形态存在,脂肪酸的羧基可以和虾青素共轭双键末端的羟基结合形成酯,根据结合脂肪酸的数量,可以分为虾青素单酯和虾青素双酯[13]。
南极磷虾中超过90%的虾青素是以虾青素酯的形式存在[14]。目前对虾青素的研究主要集中在对游离虾青素的提取及活性研究[15-16],张莎莎[17]利用硅胶柱层析,以石油醚-乙酸乙酯为洗脱剂分离南极磷虾虾青素酯,该方法只能分别制备虾青素单酯或虾青素双酯,无法1次完成不同形态虾青素的分离。南极磷虾总虾青素中3S,3′S、3S, 3′R、3R,3′R 3种立体异构体比例分别为: 10%~20%、10%~20%、60%~70%[18],但对南极磷虾中不同形态的虾青素结构的研究未见报道。YAMAGUCHI等[19]研究表明南极磷虾中虾青素单酯占25%~35%,双酯占55%~64%,该研究利用薄层色谱法进行相对含量的测定,缺少对不同形态虾青素含量的准确定量。本实验首次采用石油醚-丙酮溶液作为洗脱体系,利用硅胶柱层析分离南极磷虾中不同形态的虾青素,并对分离出的虾青素进行结构鉴定和含量测定,为深入研究南极磷虾中不同形态虾青素的构效关系和功能食品开发提供可靠依据。
1 材料与方法
1.1 材料与试剂
南极磷虾,辽宁省大连海洋渔业集团公司,于-80 ℃ 保存;全反式虾青素标准品,德国Dr.Ehrenstorfer公司,纯度(95.8±0.5)%。
甲醇、正己烷、丙酮、乙酸乙酯、二氯甲烷(色谱纯),德国Merck公司;柱层析硅胶(200-300目)、GF254薄层色谱硅胶,青岛海洋化工厂;所有分离用有机溶剂均为国产分析纯。无水MgSO4、NaOH等均为优级纯。
1.2 仪器与设备
1100液相色谱仪(配紫外检测器),美国Agilent公司;R-200旋转蒸发仪,瑞士Buchi公司;KQ-300E超声波清洗机,昆山超声仪器有限公司;CR22G 高速冷冻离心机,日本Hitachi公司。
1.3 方法
1.3.1 样品制备
准确称取南极磷虾试样100 g,加入无水MgSO4,按1∶5的料液比(g∶mL)用丙酮低温超声浸提15 min,4 ℃下8 000 r/min离心5 min取上清液,多次提取直至提取液无明显红色,合并上清液,室温下旋转蒸发浓缩,得到5.29 g南极磷虾虾青素粗提物。
1.3.2 硅胶柱层析分离虾青素酯
实验对层析柱的规格(2 cm×30 cm、3 cm×40 cm、2.5 cm×50 cm)、硅胶用量(30、50、70倍上样量)和洗脱体系(石油醚-乙酸乙酯体系、石油醚-丙酮体系)进行比较。称取75 g 200~300目的硅胶,120 ℃活化4 h,冷却至室温后在石油醚中浸泡过夜。采用湿法装柱,首先倒入适量石油醚充分润洗层析柱,在柱内预留5~10 cm的石油醚,将硅胶沿壁缓缓倒入层析柱中,用玻璃棒轻轻敲打层析柱,避免断层和气泡的产生。硅胶完全倒入后,石油醚冲洗1 h,待硅胶柱高度不变后,取2.5 g样品用少量石油醚溶解后沿内壁缓慢倒入,塞入小团脱脂棉开始洗脱。利用石油醚-丙酮作为洗脱体系,以3.5 mL/min的流速洗脱。首先用2%丙酮-石油醚淋洗,弃去开始流出的约300 mL馏分;然后依次用石油醚-丙酮(94∶6、88∶12、75∶25)3个梯度洗脱,收集洗脱下来的3条色带,室温下旋转蒸发将溶剂旋出,称重,充氮密封冷藏保存备用。
1.3.3 展开剂的筛选
考察11种展开剂体系,分别进行薄层层析实验。选择适合分离虾青素酯的展开剂系统,将展开剂倒入展开缸中稳定30 min,少量丙酮溶解样品后,用3 mm毛细点样管在距离硅胶板下缘1.5 cm处重复点样,尽量减小点样斑点,待硅胶板完全干燥后放入展开缸,在溶剂前沿距离硅胶板边缘2 cm处取出。展开剂体系的组成见表1。
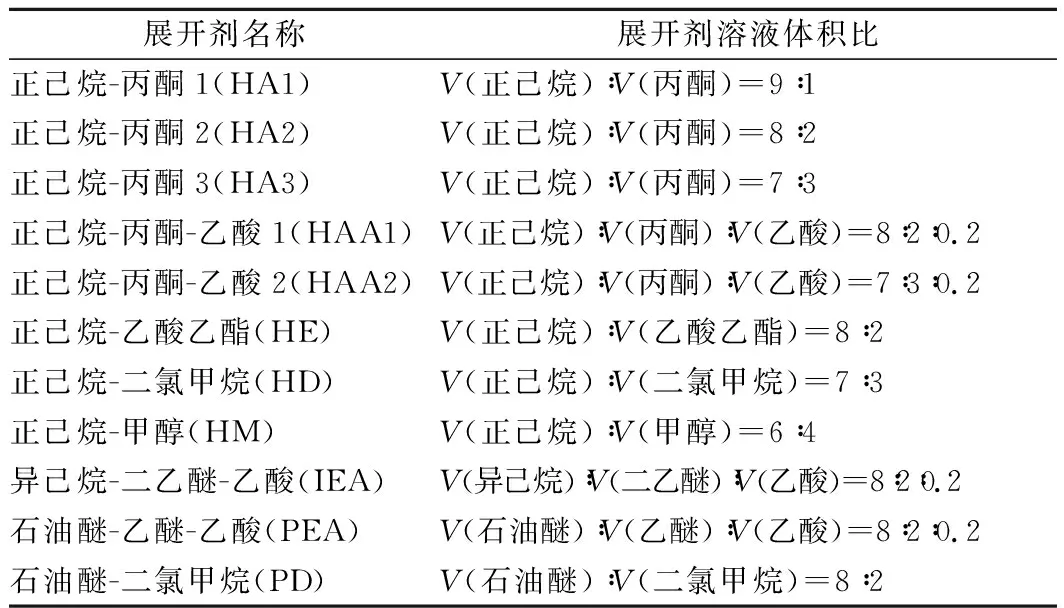
表1 不同展开剂的组成Table 1 Composition of different developers
1.3.4 南极磷虾中不同形态虾青素的光学异构体鉴定
首先将虾青素酯水解为游离虾青素,参考孙伟红等[20]水解过程,皂化条件如下:将制备的虾青素酯用丙酮溶解,加入适量0.02 mol/L NaOH甲醇溶液在4 ℃条件下反应过夜,然后在试样溶液中加入0.6 mol/L磷酸甲醇溶液中和剩余的碱,最后加入N-丙基乙二胺(PSA)填料净化,涡旋静置后使微孔滤膜待测。游离虾青素不需皂化,通过微孔滤膜后可直接进样。
色谱条件[21]: Chiralpak IC柱(250 mm×4.6 mm,5 μm);以甲基叔丁基醚-甲醇(50∶50,V/V)为流动相,采用等度洗脱,洗脱流速为1 mL/min;柱温:25 ℃;进样量:20 μL。
1.3.5 南极磷虾中不同形态虾青素含量的测定
称取30 mg虾青素双酯、6 mg虾青素单酯分别加入2 mL丙酮溶解后,进行1.3.4的皂化步骤后,供HPLC检测,游离虾青素不需皂化可直接进样。
液相色谱条件[20]:C30色谱柱(250 mm×4.6 mm,5 μm);流动相A:甲醇溶液,流动相B:叔丁基甲醚,流动相C:1%磷酸溶液;洗脱流速为1 mL/min;柱温:25 ℃;进样量:20 μL。线性梯度洗脱条件:0 ~15 min,B由15%上升到30%、C为4%;15~23 min,B由30%上升到80%、C为4%;23~27 min,B为80%、C为4%;27~30 min,B由80%上升到15%、C为4%;30~35 min,B为15%、C为4%。
实验以全反式虾青素标准进行定量,但皂化过程中会有一部分全反式虾青素转化为13-顺虾青素和9-顺虾青素,具体计算公式如下[19]:
实际虾青素含量=1.3×13-顺式虾青素+全反式虾青素+1.1×9-顺式虾青素。
2 结果与分析
2.1 硅胶柱层析分离南极磷虾中不同形态虾青素
本实验参考张沙沙[17]对南极磷虾中虾青素酯的分离提纯方法,采用硅胶柱层析法分离虾青素酯。为保证最佳分离效果,经过反复实验发现2 cm×30 cm层析柱上样量小,不能满足后续实验需要;2.5 cm×50 cm层析柱洗脱时间过长,洗脱剂用量较大;3 cm×40 cm层析柱在上样量、分离效果和洗脱时间都可以达到要求。硅胶用量不仅与上样量有关,也影响洗脱时间和分离效果,多次试验后发现,上样量2.5 g,硅胶用量为上样量的30倍,硅胶高度30 cm时,分离和制备效果最佳。硅胶石油醚-乙酸乙酯体系是柱层析常用体系,但在研究过程中发现这个体系洗脱时间较长,可能导致虾青素氧化;石油醚-丙酮体系在分离效果和洗脱时间上都优于石油醚-乙酸乙酯体系,依次尝试不同比例的丙酮-石油醚溶液,丙酮比例过大会导致所有虾青素色带整体下移,未能达到分离效果,若丙酮比例过小则洗脱速度太慢或虾青素酯无法洗脱。经多次实验发现依次用2%、6%、12%和25%的丙酮-石油醚溶液洗脱可接下3条红色色带且硅胶柱上无明显红色残留。根据上述实验结果,本实验使用3 cm×40 cm的层析柱、硅胶填充量为75.0 g、上样量为2.5 g,石油醚-丙酮作为洗脱体系。收集的第一条色带重量为1.06 g,第二条色带重量为0.13 g,第三条色带因含量太低未进行准确称量。
2.2 展开剂的筛选及薄层层析法鉴定
薄层层析法是一种快速分离和定性分析少量化合物的方法,具有操作简单、快速等优点。虾青素有肉眼可见的红色,无需使用显色剂或者紫外灯照射,可直接采用薄层层析法分离鉴定不同形态虾青素。本研究尝试了几种常见的适用于弱极性脂类的展开剂,结果见表2。

表2 不同展开剂的展开效果Table 2 Efficiency of different developers
表2采用正己烷-乙酸乙酯、正己烷-二氯甲烷等展开体系进行薄层层析时,虾青素随展开剂的前沿呈一条直线上移,无法将不同形态虾青素进行分离。而正己烷-丙酮展开体系表现出较强的分离虾青素及虾青素酯的能力,HAA1和HAA2都可以将不同形态虾青素分开,加入适量的乙酸还可以改善拖尾现象。通过计算比移值(Rf值)发现,HAA1展开体系分离的双酯、单酯、游离虾青素的Rf值分别为0.86、0.70、0.47;HAA2展开体系分离的双酯、单酯、游离虾青素的Rf值分别为0.73、0.53、0.30。Rf值一般在0.2~0.8较为合适,所以最终选择V(正己烷)∶V(丙酮)∶V(乙酸)=8∶2∶0.2做为最佳展开剂。
用HAA1展开剂分离南极磷虾中不同形态虾青素时,薄层层析板有3条清晰的色带,如图1中的b所示。图1中的a、c、d分别是收集的第三条、第一条和第二条色带。根据虾青素的极性大小和孙晓昀研究内容来看[22]可以确定图中点1为虾青素双酯,点2为虾青素单酯,点3为游离虾青素。a、c、d 3个样品都只出现了1条色带,说明样品的纯度较高。3条色带与南极磷虾虾青素粗提物的3点一一对应,证明接下来的3条色带依次为虾青素双酯、虾青素单酯及游离虾青素,柱层析法可以从南极磷虾中分离制备不同形态虾青素。
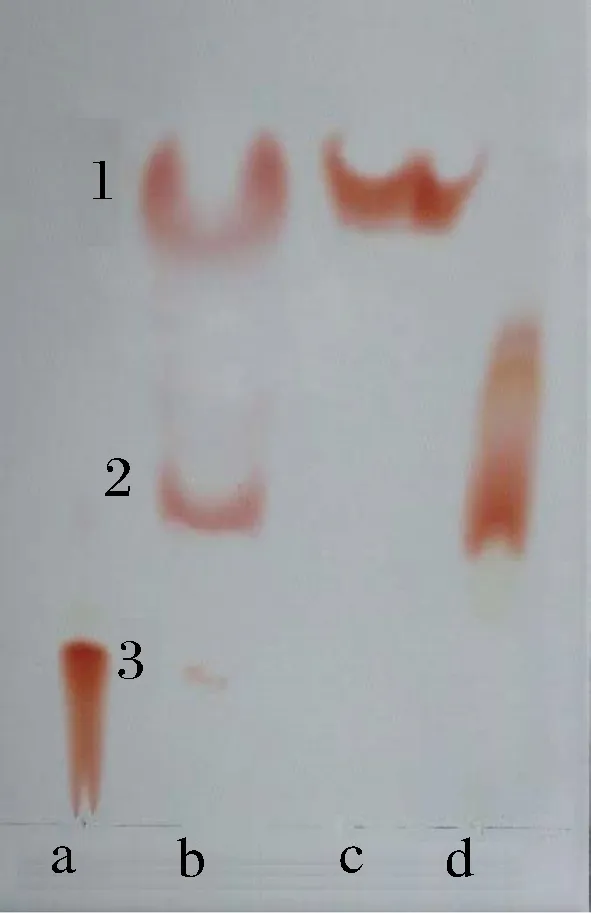
1-虾青素双酯;2-虾青素单酯;3-游离的虾青素 a-第三条色带;b-南极磷虾虾青素粗提物;c-第一条色带;d-第二条色带图1 分离不同形态虾青素效果对比图Fig.1 The effect of separating different forms of astaxanthin
2.3 南极磷虾中不同形态虾青素光学异构体的鉴定
通过手性柱对南极磷虾中不同形态虾青素和合成虾青素标准品进行了立体结构鉴定。由图2看出,合成虾青素中3S,3′S、3S, 3′R、3R,3′R的比例为1∶2∶1, 南极磷虾双酯和南极磷虾单酯中3R,3′R所占比例都在70%以上,远远大于3S,3′S和3S,3′R、3S,3′S比例最低,南极磷虾的游离虾青素约含有65%的3R、3′R,3R,3′R含量比虾青素酯低,3S,3′S和3S, 3′R所占比例相近。雨生红球藻粉含有87.6%的3S,3′S,10.1%的3S和3′R和2.3%的3R,3′R,红发夫酵母中提取的虾青素绝大部分以3R,3′R组成,仅含有1.5%的3S,3′R[23]。3种不同生物来源的虾青素相比较,发现立体结构存在很大差别,南极磷虾中3R,3′R所占比例高于雨生红球藻但低于红发夫酵母;3S,3′R含量:南极磷虾>雨生红球藻>红发夫酵母;3S,3′S在雨生红球藻虾青素中高达87.6%,红发夫酵母不存在这个光学异构体结构。
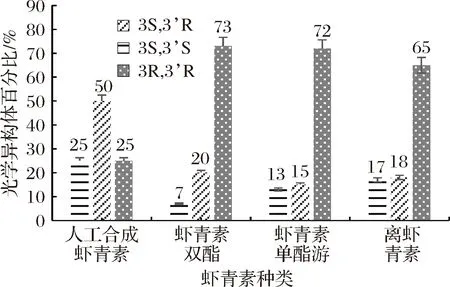
图2 虾青素光学异构体组成Fig.2 Composition of astaxanthin optical isomers
2.4 南极磷虾中不同形态虾青素含量的测定
由于虾青素酯没有相应的标准品,因此南极磷虾中虾青素酯需要转化为游离态虾青素后才能进行准确定量。本实验将南极磷虾中不同形态虾青素样品通过水解净化后经C30-HPLC法进行了测定(图3~图5)。
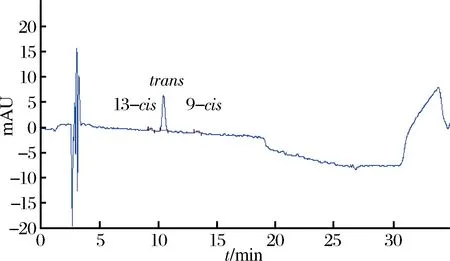
图3 南极磷虾中游离虾青素谱图Fig.3 Free astaxanthin spectrum in Antarctic krill
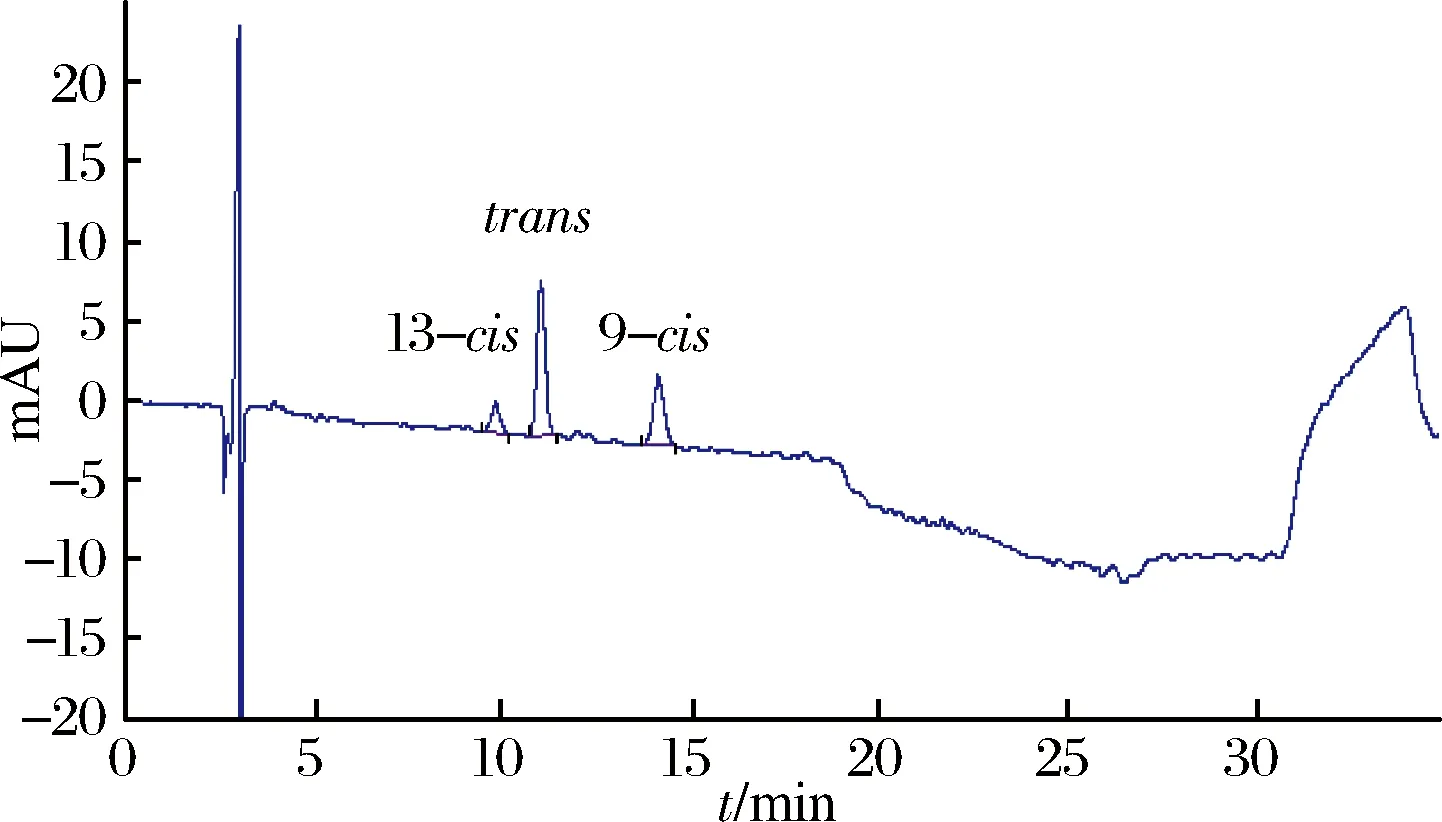
图4 南极磷虾中虾青素双酯皂化后谱图Fig.4 Spectrogram of saponification of Astaxanthin diester in Antarctic krill
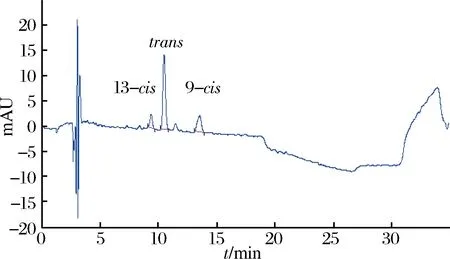
图5 南极磷虾中虾青素单酯皂化后谱图Fig.5 Spectrogram of saponification of astaxanthin monoester in Antarctic krill
南极磷虾中总虾青素含量为18.9 mg/kg,南极磷虾的虾青素双酯中虾青素含量为12.0 mg/kg,虾青素单酯中虾青素含量为6.1 mg/kg,南极磷虾中游离虾青素含量为0.8 mg/kg。虾青素双酯约为虾青素单酯的2倍,游离虾青素含量不到总虾青素的5%。
3 结论
本研究以丙酮-石油醚溶液为洗脱体系,对硅胶柱层析技术进行优化,分离南极磷虾中不同形态虾青素。筛选出最佳展开剂体系V(正己烷)∶V(丙酮)∶V(乙酸)=8∶2∶0.2,对制备的虾青素进行检验。利用手性柱对南极磷虾虾青素的结构进行了定性分析,发现南极磷虾不同形态虾青素中含有3S,3′S、3S,3′R、3R,3′R 3种异构体,且3R,3′R异构体含量远大于3S,3′S,3S,3′R 2种异构体。通过C30-HPLC法测定南极磷虾中不同形态虾青素的含量,测得虾青素双酯中虾青素含量为6.3 mg/kg,虾青素单酯中虾青素含量为3.2 mg/kg,游离虾青素含量为0.4 mg/kg。本实验系统研究了南极磷虾中不同形态虾青素的分离制备方法,并进行了立体结构组成分析和含量测定,可以促进南极磷虾资源的有效利用和功能食品升级。
