青藤碱对肝癌细胞株HepG2侵袭转移的影响
2019-02-15何晶晶张岭漪张亚武徐小东王哲元张有成
何晶晶 张岭漪 张亚武 徐小东 王哲元 张有成
中药青风藤主要的活性生物碱是青藤碱,对它的化学成分的研究也主要集中在对青藤碱的研究方面[1]。研究发现青藤碱具有显著的抗炎[2]、抗氧化[3]、免疫抑制[4]、镇痛[5]等作用。近年来,青藤碱的抗肿瘤作用越来越受到重视,它能抑制肺癌NCI-H460细胞、白血病HL-60细胞的增殖、诱导凋亡并具有化疗增敏的作用[6-7],同时还有抗乳腺癌和结肠癌的作用[8-9]。本实验以中国药品鉴定所生产的青藤碱标准品为研究药物,transwell小室及基质胶(Matrigel)用于体外构建基膜及细胞外基质,以研究青藤碱对人肝癌细胞系HepG2粘附、侵袭和迁移能力的影响,为后续机制的研究奠定了基础。
1 材料与方法
1.1 材料
1.1.1 试剂和仪器 RPMI-1640培养基、牛血清蛋白(BSA) 购自GIBCO公司;胎牛血清购自杭州四季青公司,胰酶、DMSO、MTT购自Sigma公司;Matrigel 购自BD Biosciences公司;其他均为国产试剂;Transwell小室、96孔培养板购自Corning Costar公司。青藤碱标准品购自中国药品鉴定所,批号:0774-200206,规格:20 mg/支。实验中使用的细胞培养箱由美国NAPCO公司生产, 酶联检测标仪由美国ERMA公司生产,离心机为国产白洋生产。
1.1.2 细胞培养 人肝癌细胞株HepG2由北京大学医学部普外科研究所提供。培养于37 ℃含5% CO2细胞培养箱内, 培养液为RPMI-1640培养基。细胞用浓度为0.25%的胰蛋白酶消化传代。使用倒置相差显微镜拍照观察细胞在不同培养时间点的生长状态。
1.2 实验方法
1.2.1 细胞增殖的MTT测定 用0.25%的胰蛋白酶消化对数生长期的HepG2细胞,细胞重悬并计数后,将单细胞悬液接种于96孔培养板中,分别设空白对照组、溶剂对照组和调零孔,每组设6个复孔。在细胞培养箱中于37 ℃,5% CO2温育24 h、48 h和72 h后,加入MTT溶液,并通过酶标仪在490 nm处测量每个孔的吸光度值和OD值。上述实验重复3次。计算青藤碱在上述3个不同时间点对HepG2细胞的增殖抑制率。增殖抑制率=(1-实验组平均OD值/对照组平均OD值)×100%。
1.2.2 细胞对胞外基质粘附 将含有matrigel胶的RPMI-1640培养液加入到96孔细胞培养板中,收集细胞与药物终浓度分别为0 mmol/L、0.125 mmol/L、0.25 mmol/L、0.5 mmol/L、0.625 mmol/L、1.0 mmol/L、1.25 mmol/L及2.5 mmol/L混和37 ℃孵育30 min后,将细胞悬液加入预处理的前述培养板,培养箱继续培养,每组细胞设6个复孔。加入MTT溶液,并通过酶标仪在490 nm处测量每个孔的吸光度值和OD值。粘附抑制率=(1-实验组平均OD值/对照组平均OD值)×100%。
1.2.3 细胞侵袭能力测定 将基质胶涂覆在24孔transwell上室的聚碳酸酯膜上,室温通风使其在微孔膜上构成基底膜结构。将对数生长期的HepG2细胞接种到transwell上室内,并设定青藤碱终浓度为0.125 mmol/L、0.25 mmol/L、0.5 mmol/L、0.625 mmol/L、1.0 mmol/L、1.25 mmol/L及2.5 mmol/L干预细胞,对照组使用等体积无血清RPMI-1640培养液代替药物,每组设3个重复孔; 将含15% FBS的RPMI-1640培养液加入下室中,37 ℃、5% CO2培养箱中培养24小时,滤膜以4%多聚甲醛和吉姆萨固定染色,双蒸水冲洗。在400倍光学显微镜下选择聚碳酸酯膜上下左右中五个视野,计数通过膜的细胞数,取平均值以计算药物对肿瘤细胞的侵袭抑制率。侵袭抑制率=(1-实验组平均侵袭细胞数/对照组平均侵袭细胞数)×100%。抑制率超过30%,统计学分析P<0.05被认为具有抗侵袭活性。
1.2.4 细胞迁移能力检测 该方法与检测侵袭能力的方法相同,除了人工基底膜胶没有铺在聚碳酸脂膜上之外,在下室中仅加入15%FBS,并置培养箱中培养12 h后取出。
1.3 统计学方法
采用SPSS 21.0软件对数据进行分析处理,计量资料以(均数±标准差)表示,采用t检验,以P<0.05表示差异具有统计学意义。
2 结果
2.1 青藤碱对肝癌细胞株HepG2增殖的影响
当 用 0.125 mmol/L、0.25 mmol/L、0.5 mmol/L、0.625 mmol/L、1.0 mmol/L、1.25 mmol/L及2.5 mmol/L浓度的青藤碱处理HepG2细胞24 h时,对HepG2细胞增殖抑制作用较弱,为3.21%~8.27%。48 h和72 h后,增殖抑制率显著增加,48 h抑制率为4.99%~41.29%。在72 h时,1.25 mmol/L和2.5 mmol/L实验组增殖抑制率为(38±3.4)%和(66.38±1.9)%,与0.125 mmol/L实验组抑制率(19.83±2.8)%相比,差异具有统计学意义(P<0.01),见图1。
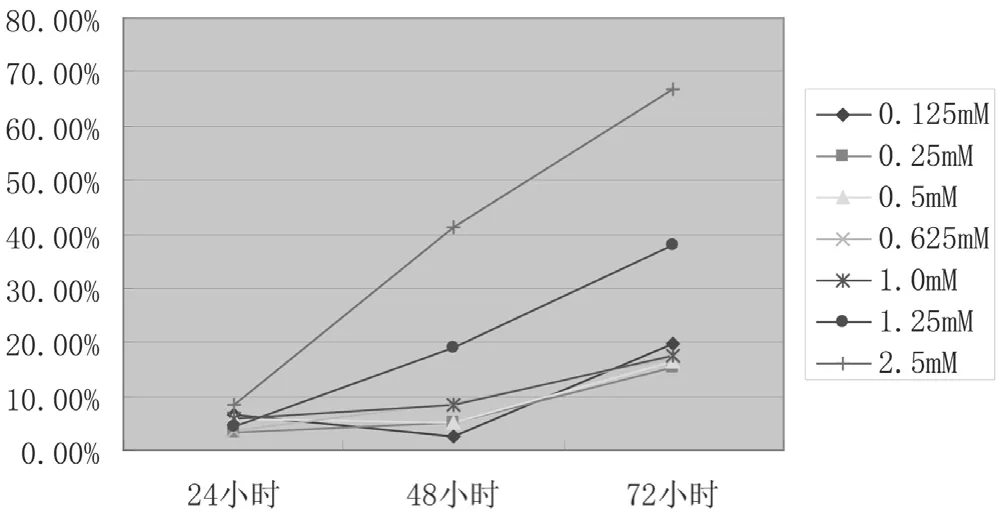
图1 青藤碱对肝癌细胞增殖能力的影响
2.2 青藤碱对肝癌细胞株HepG2粘附能力的影响
HepG2细胞在培养箱中与不同浓度的青藤碱一起温育30 min后,HepG2细胞与matrigel胶的粘附被显著抑制。粘附抑制率为19.38%~58.56%,随着药物浓度的增加抑制率也逐渐增加。OD值在实验组和对照组间比较,差异具有统计学意义(P<0.05)。其中,实验组1.0 mmol/L、1.25 mmol/L和2.5 mmol/L与对照组相比,差异具有统计学意义(P<0.01),见图2。

图2 青藤碱对细胞粘附的影响
2.3 青藤碱对肝癌细胞株HepG2侵袭能力的影响
用不同浓度的青藤碱干预HepG2细胞24小时后,通过人工基底膜的HepG2细胞的数量随着青藤碱浓度的增加而降低,见图3。其中0.125 mmol/L、0.25 mmol/L、0.5 mmol/L、0.625 mmol/L实验组的抑制率均≤30%, 这些浓度的青藤碱对肿瘤细胞没有抗侵袭作用。1.0 mmol/L、1.25 mmol/L和2.5 mmol/L实验组抑制率分别为30.8%、31.03%和51.56%。相比之下此浓度的青藤碱则能明显抑制肿瘤细胞的侵袭(P<0.01),见图4。
2.4 青藤碱对肝癌HepG2细胞迁移能力的影响
青藤碱抑制HepG2细胞穿过聚碳酸酯膜的能力在0.5 mmol/L、0.625 mmol/L、1.0 mmol/L、1.25 mmol/L及2.5 mmol/L组与对照组比较,差异具有统计学意义(P<0.01)。实验组的迁移抑制率为33.71%、51.05%、53.97%、58.67%和68.56%,青藤碱抑制肿瘤细胞迁移的能力随着浓度的增加而增强,见图5。

图3 通过聚碳酸酯膜和Matrigel胶后的HepG2细(×400倍)
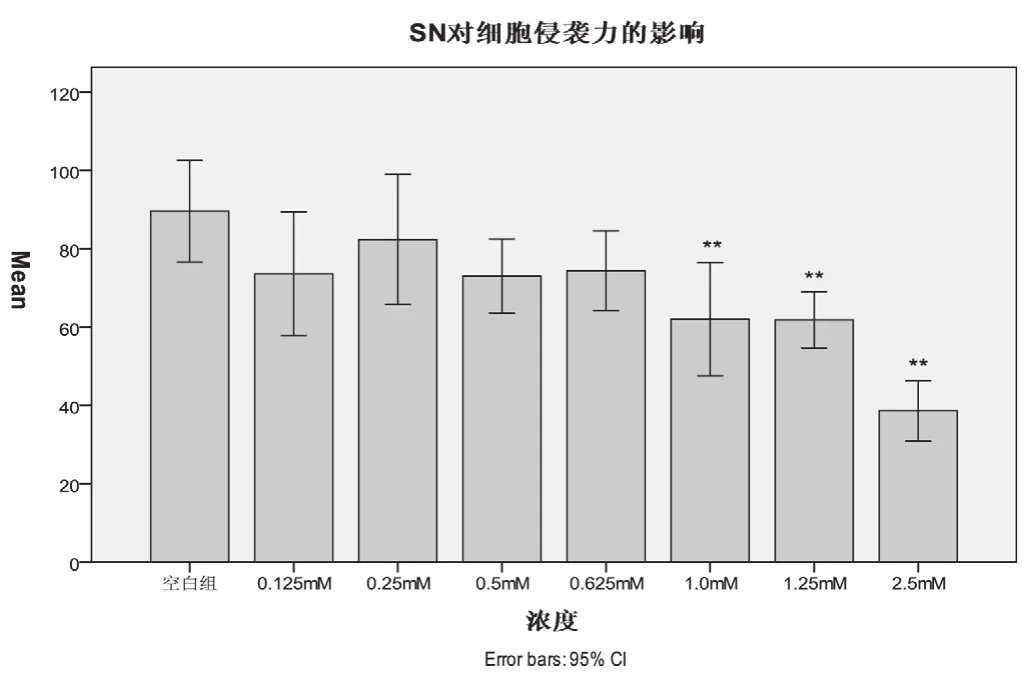
图4 青藤碱对细胞侵袭力的影响

图5 青藤碱对细胞迁移的影响
3 讨论
原发性肝癌是我国最常见的恶性肿瘤之一,也是全世界恶性肿瘤相关死亡的主要原因。2012年全球约有782 500例新发病例,同时约有745 500例死亡[10]。据估计,2015年我国新增原发性肝癌病例和死亡病例约为343,700人,占到了全球原发性肝癌总人数的近一半[11]。近年来对原发性肝癌的治疗取得了极大的进步,但患者的总体生存率仍不尽如人意。这主要因为原发性肝癌具有高侵袭转移性的生物学特性,并与肝癌患者的预后密切相关[12]。肿瘤细胞穿破基膜是恶性肿瘤侵袭的标志,恶性肿瘤远处转移需要突破一系列的组织屏障,这个过程包括:(1)原发恶性肿瘤增殖形成血管,肿瘤细胞局部侵袭;(2)恶性肿瘤细胞互相粘附,脱离原发灶;(3)肿瘤细胞突破基膜和细胞外基质;(4)穿透血管壁进入宿主血液循环;(5)与宿主的淋巴样细胞形成瘤栓,逃避宿主免疫系统攻击;(6)恶性肿瘤细胞通过血液循环到达继发部位,并粘附在血管内皮细胞下的基底膜上;(7)恶性肿瘤细胞粘附于继发部位的细胞外基质,促进新生血管形成,增殖并形成转移灶。
中药青风藤中主要的活性生物碱是青藤碱,它能够抑制人单核细胞和滑膜细胞的侵袭和迁移,也是一种细胞外基质金属蛋白酶的诱导产物[13]。近些年来,青藤碱的抗肿瘤作用有了初步的研究,如:青藤碱抑制肺癌细胞株NCI-H460、白血病细胞株HL-60的增殖,诱导肿瘤细胞凋亡并具有化疗增敏作用。青藤碱还能够抵抗乳腺癌和结肠癌[8-9]。
在本次实验中,发现青藤碱显著抑制了人肝癌细胞株HepG2对Matrigel胶的粘附,粘附抑制率随着药物剂量的增加而增加。在检测侵袭和转移的实验中,发现青藤碱以剂量依赖的形式显著的降低HepG2细胞对基底膜的侵袭。用青藤碱处理12小时后,HepG2细胞穿过聚碳酸酯膜的数量明显减少。这表明青藤碱对肝癌细胞侵袭和转移具有直接的抑制作用,实验结果与在其他肿瘤中的发现相一致。同时在本次研究中,通过MTT检测青藤碱对人肝癌细胞株HepG2增值影响时发现用浓度为0.125~2.5 mmol/L的青藤碱处理肿瘤细胞24 h后,细胞增殖抑制率无明显变化,但经过48小时、72小时后,药物终浓度为1.25 mmol/L、2.5 mmol/L的实验组增殖抑制率可达30%以上。说明青藤碱以时间和剂量依赖的形式抑制肝癌细胞增殖,也说明青藤碱对HepG2细胞与Matrigel胶的粘附、侵袭和迁移的抑制作用并非由药物的细胞毒性作用所致。
本研究证实,青藤碱在体外可以抑制人肝癌株HepG2的粘附、迁移、侵袭和增殖,抑制作用具有剂量依赖性。而青藤碱的这种抑制作用可能和它对上皮细胞的作用有关,其中具体的机制尚需要进一步的研究证实,从而更好的阐述青藤碱的抗恶性肿瘤作用。
