航天诱变高产酸副干酪乳杆菌A-4-2性质与酶活性研究
2019-02-15文鹏程隋馨瑶孙二娜任发政
文鹏程 隋馨瑶 孙二娜 赵 亮,3 任发政, 王 莹
(1.甘肃农业大学食品科学与工程学院, 兰州 730070; 2.中国农业大学食品科学与营养工程学院, 北京 100083; 3.河北省畜产食品工程技术研究中心, 三河 065200)
0 引言
航天诱变技术又称“空间诱变技术”,它是利用返回式卫星将植物种子送入太空,利用其特殊的环境,对种子进行多项诱变处理,改变种子自身的基因,从而获得有益突变[1],有利于选育出变异幅度大的特异质的菌种新品种。随着研究的深入,我国利用航天诱变技术开发新产品已经具备一定优势,其研究水平已经位居世界前列。近年来,利用航天育种技术已经培育出80多个农作物新品种,并已经投入生产[2]。魏丽勤等[3]通过返回式卫星,对泰乐菌素的最终产量进行了空间诱变,测定了弗氏链霉菌产泰乐菌素比出发菌株增加了74.6%。周方方等[4]通过空间诱变的方法,将干酪乳杆菌LC2W在胞外多糖上进行筛选,通过筛选得到了高产胞外多糖的3个菌株(LC2W-1、LC2W-2、LC2W-3),并将其进行了遗传稳定性的测定,结果表明,这3株菌的胞外多糖产量相对出发菌株增加了41.78%、26.15%、32.40%,胞外多糖质量浓度达到191.48、170.36、178.81 mg/L,且具有良好的遗传稳定性。李雄超等[5]将干酪乳杆菌G5送上太空,利用神舟八号飞船进行太空搭载,使菌株进入太空,产生突变。经过诱变后的菌株,进行了高产胞外多糖的筛选,获得了2株高产胞外多糖的乳酸菌,经过诱变后的菌株胞外多糖的产量分别提高了1.9、1.7倍。
干酪乳杆菌(Lactobacilluscasei)属于益生菌菌种。该菌种分布范围广,在奶酪、酸奶以及泡菜中均有发现,也存在于人体的口腔及肠道中[6],可有效抑制有害细菌的生长繁殖,维持肠道的生态平衡和正常功能。同时,它可以降低胆固醇含量,增强免疫反应,控制腹泻、缓解乳糖不耐受,抑制肠道病原菌,是一种益生菌菌种[7-9]。
副干酪乳杆菌L105是课题组从云南大理的乳扇中进行分离筛选后又经过耐酸、耐氧适应性驯化得到的。副干酪乳杆菌L105搭载于“神舟十一号”飞船经过33 d后返回。本文研究航天诱变筛选得到的高产酸菌株A-4-2的生长特性、形态学特性、耐受性及β-半乳糖苷酶活性、基因表达量,以期为该菌株的应用提供一定科学基础。
1 材料与方法
1.1 试验材料
1.1.1菌株来源
研究对象为副干酪乳杆菌A-4-2,该菌株是副干酪乳杆菌L105经航天诱变后筛选得到的高产酸菌株。副干酪乳杆菌L105(出发菌株)为从云南大理的乳扇中进行分离筛选的副干酪乳杆菌L9(野生菌株)进行耐酸、耐氧适应性驯化后得到的,该菌株具有良好的发酵性能。
1.1.2培养基
MRS(乳酸细菌培养基)液体培养基:蛋白胨10 g,葡萄糖20 g,牛肉膏10 g,酵母浸粉5 g,磷酸氢二钾2 g,柠檬酸二铵2 g,无水乙酸钠5 g,硫酸镁(MgSO4·7H2O)0.58 g,硫酸锰(MnSO4·H2O)0.2 g,吐温80(Tween-80) 1 mL,蒸馏水1 L,调节pH值至6.5。
MRS固体培养基:培养基成分同液体培养基,1 L添加琼脂15 g。
MRS耐胆盐培养基:MRS液体培养基中胆盐含量根据试验要求添加。
以上培养基均121℃灭菌15 min;12%脱脂乳培养基,110℃灭菌10 min;保护剂为12%脱脂乳中加入30%甘油。
1.1.3主要仪器及设备
XSZ-4G型显微镜,COIC公司;TGL-16B型台式离心机,上海安亭科学仪器厂;LDZM型立式压力蒸汽灭菌器,上海申安医疗器械厂;DELTA320型 pH计,METTLER-TOELDO公司;H1850R型台式高速冷冻离心机,长沙湘仪离心机仪器有限公司;DK-98-II2KW型洁净工作台,天津泰斯特仪器公司;UV-2102PC型紫外-可见分光光度计,上海Unico公司;DNP-9082型电热恒温培养箱,上海精宏实验设备有限公司;Bioscreen C型全自动生长曲线分析仪,芬兰Bioscreen公司;JY96-N型超声波细胞粉碎机,JY99-IIDN型超声波细胞粉碎机,宁波新芝生物科技有限公司;N203型组织研磨器,美国Biospec公司;Model-680型自动酶标仪,美国Bio-Rad公司;LightCycler 96型实时荧光定量PCR(聚合酶链式反应)仪,罗氏诊断产品(上海)有限公司。
1.2 试验方法
1.2.1菌株形态学鉴定
革兰氏染色:将筛选出来的高产酸菌株A-4-2与L9、L105接种、活化后,分别等量接种于pH值为6.5的MRS液体培养基中,在有氧条件下37℃连续培养12 h后,进行革兰氏染色,电子显微镜观察。
透射电镜:将菌株A-4-2与L9、L105接种、活化后,分别等量接种于pH值为6.5的MRS液体培养基中,在有氧条件下37℃连续培养12 h后,进行透射电镜样品处理:取大量样品离心(转速3 000~4 000 r/min),去除上清液,加入适当pH值(7.2~7.4)的0.1 mol/L PBS(磷酸盐缓冲液)清洗3次,清洗时菌体悬浮;2.5%戊二醛固定3 h,用PBS清洗2次,每次10 min。再用纯水清洗2次,用透射电镜Tecnai G2 F20 S-TWIN型(200 kV)观察。
1.2.2菌株保藏
经过鉴定后,确定为副干酪乳杆菌的菌株,将其接种在新鲜的pH值6.5的MRS液体培养基中,将其放入37℃恒温培养箱中,培养12 h左右,将培养后的菌液在超净工作台中进行转移,将其转移至10 mL离心管中离心10 min(4 200~4 500 r/min),弃去上清液,加入保护剂2 mL,充分混匀,用移液枪吸取1 mL分装于1.5 mL离心管中,于-20℃中保存[10]。
1.2.3菌株生长曲线测定
将菌株A-4-2与L9、L105接种、活化2代后,按1%接种量分别接种于pH值为6.5的MRS液体培养基中,用Bioscreen C型全自动生长曲线分析仪,在有氧条件下37℃连续培养24 h,测定波长600 nm处菌悬液的光密度,绘制600 nm处光密度(OD值)对培养时间的生长曲线[11]。
1.2.4菌株耐酸能力评价
低pH值下菌株致死率:待测菌株接种、活化后,按1%接种量分别接种于pH值为6.5的MRS培养基中,在有氧条件下37℃连续培养16 h后,离心收集菌体,将菌体沉淀分别接入pH值为3.5、3.0和2.5的MRS培养基中,并在37℃下分别培养0、2、4 h时,对菌株进行平板计数,计算菌株致死率。每组试验至少有3个重复[12]。
发酵7 d后菌株耐酸能力评价:将待测菌株进行37℃静置12 h活化后,按1%接种量分别接种于12%的脱脂乳培养基中,放入37℃恒温培养箱中,连续发酵7 d后,将发酵乳样品充分混匀,并吸取1 mL样品分别加到pH值为3.5、3.0、2.5的MRS液体培养基中,37℃下分别培养0、2、4 h时进行活菌计数。每组试验至少有3个重复。
1.2.5菌株耐胆盐能力评价
待测菌株接种、活化后,按1%接种量分别接种于pH值为6.5的MRS培养基中,在有氧条件下37℃连续培养16 h后,离心收集菌体,将菌体沉淀分别接入胆盐质量分数为0.1%、0.2%和0.3%的MRS胆盐培养基中,37℃下分别培养0、1、2、3、4 h,对菌株进行平板计数计算菌株致死率。每组试验至少有3个重复[12-13]。
1.2.6菌株产胞外多糖能力评价
(1)胞外多糖的分离与含量测定
将待测菌株经37℃静置12 h活化后,按1%的接种量接种于10 mL质量分数12%的脱脂乳培养基中,放入37℃恒温培养箱中,连续发酵7 d,在发酵1、3、5、7 d时取发酵乳样品10 mL,向其加入3 mL 16 g/(100 mL)的三氯乙酸溶液,放入4℃冰箱放置2 h后,10 000g离心30 min,取上清液备用;取6 mL上清液,并加入等体积的无水乙醇,4℃静置12 h;将混合液10 000g离心30 min,取沉淀,采用苯酚-硫酸法测定多糖的含量[14-18]。
(2)葡萄糖标准曲线的绘制
用万分之一天平称取葡萄糖 0.10 g,于100 mL容量瓶中,加入少量蒸馏水溶解,定容摇匀。从100 mL容量瓶中,分别吸取 0.5、1.0、1.5、2.0、2.5、3.0 mL 葡萄糖溶液,加入10 mL容量瓶中,定容摇匀。蒸馏水做空白对照。吸取不同浓度的标准溶液1 mL,于室温(20℃)下在其中加入5%苯酚1 mL并摇匀,再快速加入5 mL浓硫酸。待反应结束溶液冷却至室温时,用紫外分光光度计于490 nm处测其吸光度。空白样以1 mL蒸馏水按照同样的步骤进行[19-20]。获得标准曲线方程式为:y=0.009x+0.136,R2=0.999。
(3)样品中胞外多糖含量的测定
取1 mL样液,于室温下在其中加入5%苯酚1 mL并摇匀,再快速加入5 mL浓硫酸。待反应结束溶液冷却至室温时,用紫外分光光度计于490 nm处测定吸光度,根据标准曲线计算样品中胞外多糖含量。
1.2.7菌株表面疏水性评价
待测菌株接种、活化后,1%接种量分别接种于pH值为6.5的MRS培养基中,在37℃恒温培养箱中,于有氧条件下连续培养12 h后,离心(4 200~4 500 r/min,10~17 min)弃去上清液,将菌体沉淀用PBS溶液(pH值7.2)洗涤两次,重悬于0.1 mL/L KNO3(pH值6.2)中,将菌悬液菌体浓度调整为1×108CFU/mL,同时测定菌悬液在600 nm处的吸光度A0。取上述3 mL菌悬液与1 mL二甲苯混合,室温放置10 min后漩涡混合2 min,再于室温下放置20 min,测定600 nm处水相的吸光度A1。表面疏水性指数以细菌黏附有机溶剂的百分率A来表示,计算公式为[21]
A=(1-A1/A0)×100%
1.2.8菌株β-半乳糖苷酶活力测定
(1)发酵过程中乳糖酶提取
将活化后的待测菌株按1%接种量接入12%脱脂乳培养基中,37℃连续发酵7 d。分别取发酵1、3、5、7 d的酸奶样品10 mL,用1 mol/L NaOH中和至pH值6.5,加入1%的柠檬酸三钠以使酪蛋白胶束溶解,离心(4℃,10 000g,10 min),弃去上清液;将菌体细胞沉淀用PBS磷酸缓冲溶液(pH值6.5)洗涤3次,得菌体沉淀。将菌体细胞悬浮于0.01 mol/L PBS(pH值6.5)中,进行超声破碎,注意将样品始终保持在冰浴中,离心(4℃,12 000g,5 min),得酶提取液,待测酶活[22]。
(2)样品中β-半乳糖苷酶活力测定
ONP(邻-硝基苯酚)标准曲线制作参照文献[23]。浓度梯度为0.02、0.04、0.06、0.08、0.10、0.12、0.14 μmol/mL,按下面方法制备:准确称取139 mg ONP于1 000 mL容量瓶中,用10 mL 95%的乙醇溶解,用水稀释定容,混匀。用移液管分别取2.0、4.0、6.0、8.0、10.0、12.0、14.0 mL上述配制溶液,分别加到100 mL容量瓶中,每个容量瓶中加入25 mL Na2CO3溶液(50 g Na2CO3和37.2 g EDTA(乙二胺四乙酸)于1 000 mL容量瓶中,少量水溶解稀释),用磷酸盐缓冲液稀释,混匀。以水作空白,用10 mm比色杯在420 nm下测定每个ONP标准溶液的吸光度,以ONP浓度为横坐标,吸光度为纵坐标,绘制标准曲线,方程式为:y=0.006x+0.003,R2=0.998。
采用ONPG(临-硝基酚-β-D-吡喃半乳糖苷)为酶作用底物,生成有色产物ONP,通过比色法测定,每个时间点样品做3个重复,每次重复测定3次后取平均值。反应体系:50 mmol/L PBS(pH值6.5)、1 mmol/L MgCl2、1 mmol/L 2-巯基乙醇、2.32 mmol/L ONPG和2 mg/mL酶提取液,37℃水浴反应30 min,在420 nm波长处测定吸光度。在此条件下,每分钟从底物ONPG中释放出1 μmol ONP所需的酶量定义为一个酶活单位(U)。酶提取液蛋白浓度测定参照试剂盒进行,标准曲线方程式为:y=0.561x-0.002,R2=0.995。
1.2.9菌株β-半乳糖苷酶基因表达量测定
酸奶样品中RNA提取:经活化的菌株按1%接种量接入12%脱脂乳中,37℃连续发酵7 d。分别取发酵1、3、5、7 d的酸奶样品10 mL,加入20 mL 1% EDTA(pH值12.0)混匀,离心(4℃,10 000g,10 min),弃去上清液;将菌体细胞沉淀用磷酸缓冲溶液(pH值6.5)洗涤1次,得菌体沉淀。每个时间样品做3个重复。核酸提取参照VANDECASTEELE等[24]的方法进行。提取的核酸样品用70%预冷乙醇洗涤,离心(4℃,12 000g,5 min),弃上清液,室温干燥5~10 min,加入20 μL DEPC(焦炭酸二乙酯)水测浓度。并立即用abm反转录试剂盒合成cDNA。
引物的设计和合成:选取16S rDNA作为内参基因,实时荧光定量PCR的引物根据美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)数据库中的基因序列,采用NCBI中BLAST在线引物合成软件进行设计,由英潍捷基(上海)贸易有限公司合成。
β-半乳糖苷酶基因扩增引物:上游引物5′-ATGGAATTCTGGGACGGCTG-3′;下游引物5′-TAGGAAGTCACTTGCGGCAG-3′。16S rDNA内标引物:上游引物5′-TCTTGGCTGAAAGATGGCGT-3′;下游引物5′-TTGCTCCATCAGACTTGCGT-3′。
实时荧光定量PCR:以cDNA为模板进行实时荧光定量PCR,采用20 μL反应体系:cDNA模板1 μL、上下游引物各1 μL、dd H2O 7 μL、SYBR Premix试剂10 μL;real-time PCR反应程序:50℃ 2 min,95℃ 10 min,(95℃ 15 s,58℃ 30 s,40个循环),95℃ 15 s,60℃ 1 min,95℃ 30 s。每个样品设定3个平行,每次平行试验做3次生物学重复。采用ΔΔCt法计算基因的表达量[25],利用内参基因扩增的Ct值进行校正,以发酵1 d样品的β-半乳糖苷酶基因表达量为参照,计算其它样品中β-半乳糖苷酶基因的相对表达量F=2-ΔΔCt,ΔΔCt表示处理样本和对照样本间校正过的循环数变化量。
1.2.10数据统计分析
全部试验数据采用Microsoft Excel 2016和SPSS 19.0数据处理系统进行分析,运用ANOVA进行统计学分析,平均值由3个重复值所得。所有单因素方差检验均采用Duncan’s新多变域测定法,且用P<0.05表示差异显著。
2 结果与分析
2.1 菌株形态学鉴定结果
按照1.2.1节的方法,对菌株进行了形态学观察。结果如图1、2所示,电子显微镜结果显示,3株菌形态均呈杆状,排列方式呈链状,并无明显差别;透射电镜结果也显示,3株菌形态并无明显差别。
2.2 菌株生长曲线评价
为了解突变菌株的生长情况,测定了突变菌株A-4-2与L105、L9在600 nm处27 h的光密度(OD值),结果如图3所示。副干酪乳杆菌27 h培养过程中培养时间与OD值的关系:0~12 h期间,OD值不断提高,培养16 h时达到对数稳定期,此后曲线趋于平缓,曲线呈S型。经过统计分析得到,A-4-2突变菌株在有氧条件下的生长情况基本与野生株L9保持一致,表明了其产酸性能提高的同时,又不失其原有生长特性。

图1 革兰氏染色显微镜观察Fig.1 Microscopic observation of gram stain

图2 透射电镜观察结果Fig.2 Observation result of transmission electron microscope

图3 副干酪乳杆菌27 h生长曲线Fig.3 Growth curves of Lactobacillus paracasei for 27 h
2.3 菌株耐酸能力评价
根据1.2.4节的方法对出发菌株L105和突变株A-4-2的耐酸能力进行比较,结果如表1所示。在不同pH值的培养液中,活菌数明显有所下降,说明在酸性环境下,副干酪乳杆菌的生长受到了抑制,对菌体代谢活动多需的营养物质以及能量有所减少,对菌体的存活产生了一定的影响。如表1所示,在pH值3.5培养1 h与2 h,突变株较野生株的存活率显著升高(P<0.05),而在pH值3.0与pH值2.5条件下,突变株与野生株各时间存活率在pH值3.0培养1 h和2 h及pH值2.5培养1 h有显著差异(P<0.05),其他培养时间无明显差异,且存活率较低,说明突变株维持了良好的耐酸能力。
注:每列相同字母表示不同菌株间无显著性差异;每列不同字母表示不同菌株间有显著性差异且P<0.05,下同。
根据1.2.4节发酵7 d后菌株耐酸能力评价的方法对突变菌株发酵7 d后的耐酸能力进行评价,如表2所示。0 h时,突变株的活菌菌体浓度为8.28 lgCFU/mL,在pH值为3.5的培养基中培养2 h后,活菌有所下降,达到8.20 lgCFU/mL,而在pH值为3.0和2.5的培养基中,菌数下降得更为明显,分别为8.17 lgCFU/mL和8.01 lgCFU/mL,同时结果显示,培养2 h和4 h后,不同pH值条件下,突变菌株的活菌数均显著高于野生菌株L9(P<0.05)。说明突变菌株在发酵7 d后,在酸性环境下的生长能力受到明显的抑制。
2.4 菌株耐胆盐能力评价
益生菌潜在的另一个重要特性是它们能够存活于人类小肠内的胆汁中,在大肠中定植并繁殖。本研究对野生株L9和突变株A-4-2的耐胆盐能力进行比较,结果如表3所示。在不同胆盐浓度的培养液中,副干酪乳杆菌L105活菌数随胆盐浓度的升高数量减少,副干酪乳杆菌在高胆盐浓度条件下生长受到抑制。

表2 副干酪乳杆菌发酵7 d后不同pH值下菌株存活情况Tab.2 Survival of Lactobacillus paracasei under different pH value conditions after 7 d fermentation
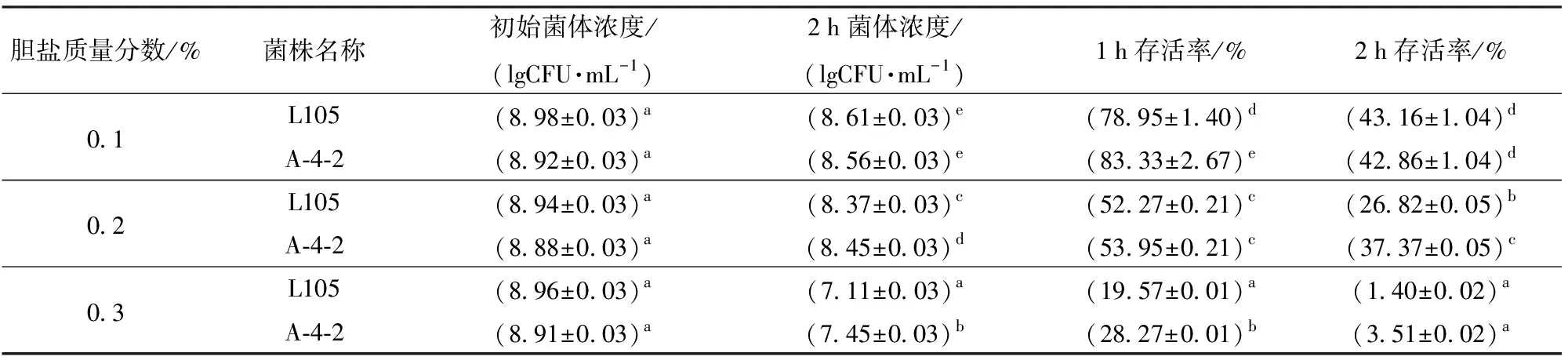
表3 副干酪乳杆菌不同胆盐浓度下菌株存活情况Tab.3 Survival of Lactobacillus paracasei under different bile salt concentrations
由表3可知,0.1%胆盐条件下培养2 h,突变株与野生株存活率基本相同,且存活率保持在40%左右;相比于含0.1%胆盐的培养条件,0.2%与0.3%胆盐含量的两株菌存活率明显下降(P<0.05),说明胆盐对于副干酪乳杆菌的生长有抑制作用。在胆盐环境培养2 h过程中,仅0.2%胆盐时,突变株存活率显著高于野生株,其他浓度突变株与野生株的存活率无显著性差异,说明航天诱变没有降低副干酪乳杆菌对胆盐的耐受能力。
2.5 菌株产胞外多糖能力评价
乳酸菌胞外多糖(EPSs)通常以与细菌细胞表面相关联的胶囊或分泌到周围介质中的粘液两种形式存在。近年来由于其独特的物理化学性质引起了相当多的关注[26]。EPSs可直接应用于发酵乳制品,以增强其质地和流变特性[27]。将菌株所制备的发酵乳样品进行胞外多糖的测定。突变菌株A- 4-2具有较高的产胞外多糖的能力,其胞外多糖产量为419.78 mg/L。相比而言,出发菌株L105的胞外多糖产量为415.11 mg/L,而突变菌株A-4-2的产胞外多糖能力比出发菌株L105略高。因此,说明航天诱变没有降低副干酪乳杆菌产胞外多糖的能力。
2.6 菌株表面疏水性评价
益生菌可有效调节人体免疫系统,这种能力与益生菌的黏附能力相关[28],而对益生菌黏附能力的研究中发现,菌株的表面疏水性可以影响其黏附能力,并且是重要的因素之一[29]。表面疏水性越高,细菌黏附能力越强[30]。
本文测定了突变菌株与L105对二甲苯的疏水能力。突变菌株与L105疏水性存在显著差异(P<0.05)。通常,高度疏水性的菌株具有很强的附着细胞的能力。但有研究表明,一株菌株对细胞的黏附率为40%,而该菌株的表面疏水能力极低。因此,疏水性可以促进粘附,但强疏水性并不是强粘附的必要条件。
2.7 菌株β-半乳糖苷酶活力评价
经过全基因组测序后,并没有发现其中与产酸相关的基因发生突变。为了进一步研究产酸提高的原因,本试验对其产酸关键酶,即β-半乳糖苷酶进行了研究。测定了副干酪乳杆菌发酵7 d内的β-半乳糖苷酶比活力,结果如图4所示。

图4 β-半乳糖苷酶比活力Fig.4 β-galactosidase specific activity
发酵7 d内,β-半乳糖苷酶比活力呈明显上升趋势,随着发酵时间的延长而逐渐增大(P<0.05)。虽然出发菌株与突变菌株酶比活力都呈现上升趋势,突变菌株酶比活力增长的速率显著高于出发菌株(P<0.05)。发酵7 d后,突变菌株的酶活力显著高于出发菌株L105(P<0.05),这与试验前期测定的滴定酸度的变化保持一致。由图4可知,发酵1 d时,菌株的产酸能力以及酶活力较低,可能是由于发酵初期,菌株经发酵产生的一部分β-半乳糖苷酶与培养基中的乳糖产生反应,形成了酶复合物,从而使乳糖得到分解,生成葡萄糖和半乳糖,致使β-半乳糖苷酶的活力较低[31-32]。随着发酵时间的逐渐延长,菌株产生的β-半乳糖苷酶活力逐渐增强,促进了发酵过程中低聚糖的产生,随着时间增长,代谢过程中的低聚糖逐渐增加,当累积到一定值时,可充当益生元,进而对菌体生长起到促进作用,提升了菌株细胞内β-半乳糖苷酶的活力,最终提高了菌株的产酸能力。
2.8 菌株β-半乳糖苷酶基因表达量评价
为了更进一步研究产酸提高的原因,从基因水平采用实时荧光定量PCR的方法,对菌株在发酵过程中β-半乳糖苷酶基因表达量进行了研究,如图5所示。将发酵1 d的β-半乳糖苷酶基因的表达量作为对照,发现随着菌株发酵时间的延长,β-半乳糖苷酶基因的表达量呈现明显的上升趋势;发酵7 d后,各菌株中的β-半乳糖苷酶基因表达量与发酵初期相比,上升了1倍左右(P<0.05);同时,还发现在发酵过程中,突变菌株的变化曲线一直高于出发菌株。这种结果与之前测定的酶活力呈现对应关系,并与滴定酸度的结果保持一致。

图5 菌株β-半乳糖苷酶基因相对表达量Fig.5 Gene expression changes of β-galactose glucoside enzyme by real-time PCR
3 结束语
本文将筛选获得的突变菌株A-4-2进行了形态学观察、生长曲线的测定、耐酸性、耐胆盐能力、胞外多糖含量以及表面疏水性的研究,结果表明,经过革兰氏染色、电子显微镜观察以及透射电镜观察,发现与出发菌株相比突变菌株在形态学上没有明显变化;经航天诱变后的高产酸菌株耐胆盐、产胞外多糖能力均与野生株无显著差异,诱变菌株产酸能力及β-半乳糖苷酶基因表达量升高,通过进行β-半乳糖苷酶活性和基因表达量的测定,探究产酸提高的原因。研究结果有效证明了β-半乳糖苷酶活性与产酸有密不可分的关系,为菌株的广泛应用奠定了基础。
